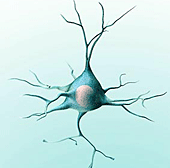
Что будет если потратить все нервные клетки
Нервничать можно! Но осторожно
«Незрелые клетки, способные самообновляться и превращаться в специализированные клетки организма, получили название стволовых». Цитата из материала «Нобелевка за стволовые клетки. Как Синъя Яманака повернул развитие вспять»
Чтобы жизнь продолжалась, клетки должны размножаться, что и происходит с большинством их разновидностей. Активнее всего процесс восстановления протекает в клетках эпителия и органах кроветворения (красный костный мозг).
Процесс регулярного «клеточного умирания»
запрограммирован в самих клетках
Иное дело нейроны (а также клетки сердечной мышцы). В них гены, ответственные за размножение делением, «выключены». Но тогда встаёт закономерный вопрос: если нейроны гибнут и не обновляются, то каким образом нам удаётся сохранять психические способности до достаточно почтенного возраста?
«Ты не один»: негимнастическая пластичность
Функции погибших нейронов берут
на себя выжившие «собратья»
Почему же способности нервной системы возвращаются? Ведь клетки погибли? Как оказалось, функции погибших нейронов берут на себя выжившие «собратья». Они становятся больше и образуют новые связи, компенсируя потерянные функции. В этом и заключается суть пластичности нервной системы.
Не пластичностью единой: развенчание мифа
В начале 60-х годов XX века в высокорейтинговом научном издании «Science» появилась статья, в которой было показано, что в головном мозге крысы могут образовываться новые клетки. В следующие нескольких лет автор исследования опубликовал ещё ряд работ, подтверждающих возможность нейрогенеза (появления новых нервных клеток в головном мозге взрослых млекопитающих).
Феноменальное по сути открытие почему-то не вызвало энтузиазма у специалистов по нейробиологии, так что развития работы не получили.
Применительно к человеку полагают, что нейрогенез может иметь место в более протяжённых областях мозга, в том числе в коре больших полушарий.
Феномен нейрогенеза довольно широко используется в терапии нейродегенеративных патологий.
Размножение стволовых клеток сопровождается
риском развития злокачественных новообразований
В США уже существуют «библиотеки» нейрональных стволовых клеток, взятых из зародышевой ткани. Их пересадки выполняются больным людям. Вместе с тем пока ещё существует серьёзная проблема: размножение стволовых клеток сопровождается риском развития злокачественных новообразований. Надёжно предотвращать такой побочный эффект пока не научились. Однако, несмотря на это, этот вид терапии без сомнения займёт одно из ведущих мест в лечении таких нейродегенеративных патологий, как болезни Альцгеймера и Паркинсона, ставших значимой социальной проблемой современной цивилизации.
Не только ждать, но и действовать
Исключаем вредности для нашего мозга. Это, среди прочего, хроническое переутомление, недосыпание, нерациональное питание, злоупотребление спиртными напитками, малая подвижность.
Лечимся. Депрессия, тревожные расстройства, стресс, синдром хронической усталости, травмы и другие недуги негативно отражаются на нервной системе. А потому своевременно получайте квалифицированную помощь, не игнорируя имеющиеся проявления.
«Интересно отметить, что стресс одинаковой интенсивности может вызвать как значимая угроза, так и творческая удача». Цитата из материала «Существует ли прививка от стресса?»
Учимся новому. Учёные доказали, что освоение новых видов деятельности позволяет сохранять и развивать «гибкость» нервных процессов до самой старости.
Меняем взгляды на жизнь. Психическому и нервному здоровью может помочь пересмотр жизненных ориентиров. Новые цели, вера в свои силы, принятие людей с их особенностями, умение справляться со стрессом, хорошие поступки. Не всегда легко, но точно имеет смысл попробовать.
Автор: Энвер Алиев
Вопрос на T&P: что убивает нервные клетки и можно ли все-таки их восстановить?
Анна Докучаева
Стресс негативно сказывается не только на психическом состоянии человека, но и на физическом. Но действительно ли нервная система изнашивается из-за череды стрессовых ситуаций? T&P продолжают находить ответы на вопросы вместе с порталом The Question. В новом выпуске студент медицинского вуза попытался доходчиво объяснить, отчего на самом деле погибают нервные клетки и почему утверждение о том, что они не восстанавливаются, — миф.
Станислав Витковский
студент старших курсов медицинского университета
Следует отметить тот факт, что нервные клетки гибнут постоянно: каждый день мы теряем некоторое количество нейронов, и это биологически запрограммированный процесс. Каждый нейрон состоит из аксона и большого количества дендритов, при помощи которых он связывается с другими нейронами и образует сеть. Количество связей — показатель активности: если у нейрона их нет, значит, он не участвует в процессе обработки информации и передачи сигналов, а следовательно, просто так расходует энергию. От таких нейронов можно избавляться.
Утверждения «нервные клетки не восстанавливаются» и «нервная система статична и не способна к регенерации» давно опровергнуты. В головном мозге есть определенные зоны (субвентрикулярная зона и субгранулярная зона), в которых проходит процесс образования новых клеток — нейрогенез. Часть из них умирает, оставшиеся же образуют новые синаптические связи и включаются в общий процесс. Сейчас этот вопрос активно изучается, чтобы можно было стимулировать нейрогенез извне, что помогло бы в лечении нейродегенеративных заболеваний.
Само понятие стресса очень расплывчатое. Для организма в принципе любое воздействие — это стресс, потому что любая информация, воспринимаемая нами, закономерно приводит к возбуждению определенных нейронов и, соответственно, к выработке нейромедиаторов, гормонов и так далее. Но есть также такое понятие, как «дистресс» — сверхпороговый раздражитель, который приводит к активации различных областей мозга и систем организма. Гормоном стресса закономерно считается кортизол, также при стрессе повышается и уровень норадреналина и адреналина, в головном мозге увеличивается количество глутамата (активирующего медиатора) и снижается уровень ГАМК (тормозного медиатора, отвечающего в том числе и за способность головного мозга восстанавливаться до состояния покоя). Повышение глутамата — закономерная реакция на стресс. Оно приводит нервную систему в состояние гипервозбуждения, чтобы можно было реагировать на стрессовую ситуацию как можно быстрее. Но при хроническом стрессе повышенное содержание глутамата приносит по большей части негативные последствия. Постоянно повышенная возбужденность, снижение количества ГАМК приводит к перевозбуждению нейронов. Непосредственно от этого они не погибнут, они просто выключатся из работы и снизят свою активность. Но хронический стресс в долгосрочной перспективе может нарушить не только механизм передачи сигнала между нейронами и биохимию нейромедиаторов, но и метаболические процессы организма. И как раз из-за этих нарушений нейроны и могут погибнуть.
При стрессе в организме нарушается обмен глюкозы, кислородный обмен, липидный обмен, повышается артериальное давление. В конечном итоге можно сказать, что нейроны при хроническом стрессе могут погибнуть вследствие возникающего недостатка питательных веществ и витаминов, а также из-за кислородного голодания, вызванного нарушением кровоснабжения тканей головного мозга и интоксикацией различными продуктами жизнедеятельности. Например, при стрессе повышается уровень кетоновых тел, которые, в свою очередь, весьма токсичны для организма.
Все это справедливо для действительно сильного стресса, который сохраняется на протяжении длительного времени в случае, если сам человек не пытается себе помочь.
Как в мозге уничтожаются поврежденные нейроны?
Считается, что микроглия (иммунные клетки нервной системы) принимают участие в восстановлении ткани мозга после повреждений на этапе очистки зоны повреждения от некротических и поврежденных нейронов. Однако до настоящего времени оставалось неясным, каким образом микроглиальные клетки узнают поврежденные нейроны in vivo.
Недавно группе исследователей из Японии под руководством профессора Юничи Набекуры (Junichi Nabekura) из Национального Института Физиологических Наук (National Institute for Physiological Sciences) удалось с помощью двухфотонной микроскопии получить изображения микроглиальных клеток, «обследующих» синапсы (контакты между нервными клетками) в интактном мозге мышей и в мозге после экспериментального инсульта.
Результаты работы опубликованы в журнале Journal of Neuroscience 1 апреля 2009 г.
К удивлению исследователей, даже в нормальном (интактном) мозге, микроглиальные клетки с периодичностью примерно раз в час образуют выросты цитоплазмы, достигающие синаптических контактов между нейронами и сохраняющиеся примерно в течение 5 минут. Чем более активны синапсы, тем чаще контактируют с ними микроглиальные клетки своими отростками. В случае инсульта микроглиальные выросты остаются в контакте с синапсами до 2 часов, и зачастую после этого поврежденные нейроны уничтожаются, а их остатки подвергаются фагоцитозу. Это первые данные о том, каким образом происходит «обследование» поврежденных нейронов в мозге микроглиальными иммунными клетками, которые определяют, погибнет ли нейрон, или останется живым.
Ученые считают, что это открытие поможет в будущем для разработки терапевтических подходов по сохранению оставшихся после инсульта или травмы головного мозга нейронных сетей.
По материалам: National Institute for Physiological Sciences
NAME] => URL исходной статьи [
Ссылка на публикацию: Cbio
Код вставки на сайт
Как в мозге уничтожаются поврежденные нейроны?
Считается, что микроглия (иммунные клетки нервной системы) принимают участие в восстановлении ткани мозга после повреждений на этапе очистки зоны повреждения от некротических и поврежденных нейронов. Однако до настоящего времени оставалось неясным, каким образом микроглиальные клетки узнают поврежденные нейроны in vivo.
Недавно группе исследователей из Японии под руководством профессора Юничи Набекуры (Junichi Nabekura) из Национального Института Физиологических Наук (National Institute for Physiological Sciences) удалось с помощью двухфотонной микроскопии получить изображения микроглиальных клеток, «обследующих» синапсы (контакты между нервными клетками) в интактном мозге мышей и в мозге после экспериментального инсульта.
Результаты работы опубликованы в журнале Journal of Neuroscience 1 апреля 2009 г.
К удивлению исследователей, даже в нормальном (интактном) мозге, микроглиальные клетки с периодичностью примерно раз в час образуют выросты цитоплазмы, достигающие синаптических контактов между нейронами и сохраняющиеся примерно в течение 5 минут. Чем более активны синапсы, тем чаще контактируют с ними микроглиальные клетки своими отростками. В случае инсульта микроглиальные выросты остаются в контакте с синапсами до 2 часов, и зачастую после этого поврежденные нейроны уничтожаются, а их остатки подвергаются фагоцитозу. Это первые данные о том, каким образом происходит «обследование» поврежденных нейронов в мозге микроглиальными иммунными клетками, которые определяют, погибнет ли нейрон, или останется живым.
Ученые считают, что это открытие поможет в будущем для разработки терапевтических подходов по сохранению оставшихся после инсульта или травмы головного мозга нейронных сетей.
По материалам: National Institute for Physiological Sciences
Правда, что нервные клетки не восстанавливаются, и могут ли они закончиться?
На вопрос белгородскому журналу «ОнОнас» отвечает врач-невролог Сергей Стороженко.
«Человеческий организм имеет свойство избыточности, и нервных клеток в нём столько, что рассчитаны они примерно на 200 лет жизни. Поэтому закончиться они не могут даже у столетнего человека. Люди просто не доживают до момента, когда ресурс нервной ткани критически снижается.
При этом количество нервных клеток после 25-летнего возраста не меняется. Но суть не в этом количестве, а в качестве нейронных сетей. Соединений между синапсами нейронных клеток примерно столько же, сколько звёзд во Вселенной, и перестраиваться они могут ежечасно и ежеминутно. Это называется феноменом нейропластичности: хоть количество нервных клеток и не увеличивается, зато они могут переключаться, как своеобразное программное обеспечение в головном мозге.
По сути, именно с помощью нейропластичности и работает вся наша мыслительная высшая нервная деятельность. Эта уникальная способность мозга к самообучению позволяет ему восстанавливаться после повреждений, нейрохирургических операций и даже удаления части мозга. Перестройка нейронных сетей помогает обойти повреждённые участки почти без потерь функций.
Как увеличить эту способность? Для этого нужно изучать новую информацию, заниматься несвойственным тебе видом деятельности, достигать в ней каких‑то высот, а потом её менять. Например, пять лет заниматься шахматами, а потом переключиться на стендовую стрельбу, играть на музыкальном инструменте, а потом взяться учить иностранный язык. И начинать можно в любом возрасте. Это развивает мозг на 30–40 % – даже лучше, чем нейротренажёры! А вот сканворды и кроссворды, увы, не помогают».
Записала Александра Токтарёва
Защита нейронов от повреждения
С.Н. Иллаpиошкин
профессор, доктор медицинских наук
ГУ НИИ неврологии РАМН
В большинстве ситуаций врач-невролог при заболевании головного мозга вынужден бороться с последствиями уже свершившейся катастрофы, в результате которой часть нервных клеток (нейронов) в определенной зоне мозга погибла. Другими словами, речь может идти о восстановительном лечении и компенсации утраченных функций – реабилитации, возможности которой в неврологии, к сожалению, достаточно ограничены. Между тем наиболее благоприятные результаты лечения возможны только в случае непосредственного воздействия на процессы, приводящие к гибели нервных клеток. Это направление в неврологии обозначается специальным термином – нейропротекция.
Развитие современных представлений о нейропротекции стало возможным в последнее десятилетие благодаря поистине революционным открытиям ряда фундаментальных наук. Были детально изучены основные цепи биохимических реакций (так называемые “биохимические каскады”), приводящие к гибели нейронов в результате острых или хронических стрессов. Установлены закономерности функционирования клеточных и митохондриальных мембран нейронов в норме и при патологии. Раскрыты основные типы рецепторов мозга и их взаимосвязь с процессами передачи клеточных сигналов. Изучены особенности образования и потребления энергии в нейронах. Наконец, большой вклад в изучение жизнедеятельности нейронов внесли успехи молекулярной биологии и генетики, а также моделирование разных заболеваний нервной системы у лабораторных животных.
Результатом проведенных исследований стало установление универсальных механизмов гибели нейронов при разных видах патологии. К ним относятся: 1) повышение уровня свободных радикалов и окислительное повреждение мембран нервных клеток; 2) нарушение деятельности митохондрий – своеобразных «энергетических станций” клетки, что приводит к запуску генетически запрограммированной гибели нейронов (апоптозу); 3) неблагоприятное действие избытка возбуждающих нейропередатчиков аминокислот (в первую очередь, глутамата), приводящее к перевозбуждению глутаматных рецепторов, входу кальция внутрь нейрона и его гибели. Этот механизм носит специальное название – эксайтотоксичность (от англ. “excite” – возбуждать).
В различных странах неоднократно предпринимались попытки лечения заболеваний нервной системы с помощью препаратов, связывающих свободные радикалы и предотвращающих окислительный стресс. Эти препараты получили название “антиоксиданты”, а наиболее известными из них являются витамины Е (токоферол) и С (аскорбиновая кислота). Однако результаты остаются далекими от идеала, и главная проблема – плохое проникновение этих соединений к внутриклеточным мембранам, особенно в центральной нервной системе.
Другая группа нейропротекторов имеет целью нормализацию функций митохондрий, улучшение усвоения кислорода и обеспечение клетки энергией. Нередко эти препараты называют “корректорами тканевого дыхания”. К ним относятся: коэнзим Q10, янтарная кислота, рибофлавин и др. На практике при необходимости улучшения функции митохондрий применяют комбинацию нескольких препаратов из данной группы.
Недавно в практику сталивнедряться принципиально новые нейропротекторы. Их действие основано на предотвращении эксайтотоксичности глутамата, выделяемого в межклеточное пространство. Такой эффект достигается за счет фармакологической блокады рецепторов глутамата, то есть специальных образований на поверхности клетки, воспринимающих глутаматные сигналы.
Новым этапом в данной области неврологии стало внедрение впрактику антагониста глутаматных рецепторов мемантина. Мемантин обладает определенными преимуществами перед другимиизвестными “антиглутаматными” препаратами, поскольку блокирует не абсолютную, а лишь избыточную активацию рецептора глутамата и поэтому обычно хорошо переносится. Действие мемантина на рецептор в физиологических условиях сходно с действием магния (данный препарат иногда образно называют “улучшенным магнием”).
В большинстве стран мемантин зарегистрирован как препарат для лечения различных видов деменций (болезнь Альцгеймера, сосудистая деменция и др.). Показано, что применение мемантина сопровождается достоверным улучшением памяти и других интеллектуальных функций, а также снижением зависимости от посторонней помощи у больных с легкой, умеренной и тяжелой деменцией. Однако знание механизма действия мемантина позволяет ставить вопрос о более широком спектре его применения – не только с целью лечения слабоумия, но и для защиты нейронов при различных патологических состояниях. Так, в недавней работе американских исследователей было показано, что мемантин при непрерывном 2-летнем применении значительно замедляет и даже приостанавливает течение болезни Гентингтона (тяжелого наследственного заболевания, сопровождающегося насильственными движениями и изменениями психики). Нами в нейрогенетическом отделении Института неврологии РАМН был также показан нейропротективный эффект мемантина у пациентов с болезнью Гентингтона. Более того, полученный нами опыт позволяет рекомендовать препарат для защиты мозга у “асимптомных” носителей мутантного гена, которые являются близкими родственниками больных и имеют высокий риск заболевания. Вся эта работа выполняется совместно с Российской ассоциацией помощи семьям с болезнью Гентингтона, которая входит во всемирную ассоциацию аналогичного профиля и осуществляет важнейший комплекс юридических, моральноэтических, психологических и иных мероприятий, направленных на обучение и поддержку семей, родственников больных и самих пациентов с этим тяжелым и пока еще неизлечимым заболеванием.
С учетом универсального значения эксайтотоксичности в механизмах гибели нейронов сегодня обсуждается возможность использования мемантина (как и других аналогичных антагонистов глутаматных рецепторов) в симптоматической и превентивной терапии ряда других неврологических заболеваний – таких как болезнь Паркинсона, сосудистые заболевания мозга и др. Разумеется, решение о назначении препарата, длительности его приема и оптимальной дозировке должно приниматься лечащим врачом с учетом характера болезни, особенностей конкретного пациента и принципов доказательной медицины применительно к данной группе лекарственных средств.
По всем прогнозам, нейропротекция как важнейшее и самостоятельное направление в клинической неврологии будет в ближайшие годы одной из наиболее актуальных и интенсивно развивающихся областей медицинской науки.