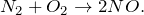Что будет если смешать азот и кислород
Реакция азота и кислорода
Реакция взаимодействия азота и кислорода.
Уравнение реакции взаимодействия азота и кислорода:
O2 + N2 ⇄ 2NO (t ≈ 2000 °C, р, kat = Pt, MnO2).
В результате реакции азота и кислорода происходит образование оксида азота (II).
Термохимическое уравнение этой реакции имеет следующий вид:
O2 + N2 = 2NO – 180,5 кДж; ΔH = 90,25 кДж/моль.
Таким образом, реакция азота и кислорода носит эндотермический характер.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
§ 3. Кислородные соединения азота
Азотный ангидрид пpeдcтaвляeт собой твердое вещество, а остальные окислы при обычных условиях газообразны.
Закись азота может быть получена разложением азотнокислого аммония, протекающим около 200 °С по уравнению:
Структура молекулы N2 O соответствует формуле N≡N = O. 3акись азота представляет собой бесцветный газ (т. пл. –91 °С, т. кип. –89°С) со слабым приятным запахом. В воде она довольно хорошо растворима, но химически с ней не взаимодействует. Выше 500°С закись азота разлагается по реакции:
Поэтому при повышенных температурах она действует как сильный окислитель. Например, тлеющая лучина вспыхивает в ней.
Так как температура человеческого тела далеко недостаточна Для разложения N2 O, этот газ, поддерживающий горение, дыхания не поддерживает. Вдыхание закиси азота в смеси с воздухом вызывает характерное состояние опьянения, сопровождающееся значительным ослаблением болевых ощущений. На этом основано использование N2 O при операциях в качестве наркотика.
2) Молекула N2 O линейна [d(NN) = 1,13 А, d(N0) = 1,19 А]. Закись азота является постоянной составной частью воздуха (0,00005% по объему). Один объем воды поглощает при 0°С около 1,3, а при 25 °С – 0, 6 объема N2 O.
Образование окиси азота из элементов при обычных условиях не происходит. Лишь примерно с 1200 °С начинает заметно протекать обратимая реакция:
Как видно из рис. 117, около 1500°С равновесие еще почти нацело смещено влево. Устанавливается оно при этих условиях чрезвычайно медленно: для достижения равновесного состояния требуется30 часов. Напротив, более высоким температурам отвечает не только большее содержание N0 в газовой смеси, но и несравненно быстрейшее достижение равновесия, которое при 3000°С устанавливается за миллионные дбли секунды. По Этим причинам NO всегда образуется в атмосфере при грозовьц разрядах.
Несмотря на эндотерйичность окиси азота, при обычных условиях она вполне устойчива. В лабораториях ее чаще всего получают по реакции:
Окись азота представляет собой бес цветный газ (т. пл. –164 °С, т. кип. –151°С), сравнительно малорастворимый в воде и химически с ней не взаимодействующий. Свой кислород она отдает лишь с трудом. Поэтому горящая лучина в атмосфере NO гаснет.
Наиболее характерны для окиси азота реакции присоединения. Так, при взаимодействии ее с хлором по реакции
образуется хлористый нитрозил (Сl–N = O), представляющий собой желтый газ (т. пл. – 64°С, т. кип. –6°С). Непосредственно соединяется NO и с кислородом. Известен также ряд комплексных соединений, содержащих NO во внутренней сфере.
3) Молекула NO характеризуется расстоянием d(NO) = 1,15 А и очень малой полярностью (длина диполя 0,03 А). Сто объемов воды растворяют при 0°С около 7 объемов окиси азота. В жидком и твердом состояниях она имеет синий цвет.
4) Если подсчитать общее число внешних электронов в молекуле NO, то получается цифра 11 (5 у азота и 6 у кислорода). Так как валентная связь осуществляется электронной парой, последняя должна быть системой более устойчивой, чем неспаренный электрон. Можно поэтому ожидать, что молекулы с нечетным числом электронов («нечетные» молекулы) будут склонны к димеризации (т. е. попарному сочетанию). Как правило, это и наблюдается уже при обычных условиях. К очень немногочисленным исключениям относится окись азота, проявляющая заметные признаки димеризации по схеме
лишь при низких температурах. В жидком состоянии при –163 °С содержание молекул N2 O2 достигает 95, а твердая окись азота состоит, по–видимому, уже только из таких молекул.
Спокойно протекающая реакция соединения NO с кислородом воздуха ведет к образованию двуокиси азота по уравнению:
Двуокись азота представляет собой бурый газ, легко сгущающийся в жидкость, кипящую при +21 °С. Будучи охлаждена до –11 °С, жидкость эта застывает в бесцветную кристаллическую массу. Определение молекулярного веса по плотности пара дает цифры, лежащие между простым (14 + 2 ·16 = 46) и удвоенным (92) его значениями, причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь при понижении.
Каждой промежуточной между –11 °С и +140 с С температуре отвечает определенное состояние равновесия обратимой реакции:
Положения этого равновесия при различных температурах показаны на рис. 118. Так как N2 O4 бесцветна, a NO2 имеет красно–бурый цвет, за смещением равновесия при нагревании или охлаждении газовой смеси легко следить по изменению ее окраски.
Двуокись азота является очень сильным окислителем. Уголь, сера, фосфор и т. п. энергично сгорают в ней. С парами многих органических веществона дает взрывчатые смеси.
6) Молекула NO2 характеризуется малой полярностью (длина диполя 0,08А). Выше 140 °С реакция образования двуокиси азота из N0 и кислорода становится заметно обратимой. Положения ее равновесия при различных температурах показаны на рис. 120. Как видно из последнего, выше 620 °С двуокись азота под обычным давлением существовать уже не может.
Взаимодействие NO2 с NO по обратимой реакции
ведет к частичному образованию азотистого ангидрида (N2 O3 ), который при охлаждении системы может быть получен в виде синей жидкости. Строение азотистого ангидрида выражается формулой O = N–О–N = O. В обычных условиях он неустойчив и равновесие приведенной выше реакции сильно смещено влево.
Растворение NO2 (или N2 O4 ) в воде сопровождается образованием азотной (HNO3 ) и азотистой (HNO2 ) кислот:
Тогда как азотная кислота в растворе вполне устойчива, азотистая легко распадается по обратимой реакции:
поэтому практически взаимодействие NO2 с водой идет по уравнению:
Подобным же образом (с образованием солей HNO3 ) протекает растворение NO2 в щелочах при наличии избытка кислорода. Напротив, в отсутствие последнего по реакции, например
образуется смесь солей азотной и азотистой кислот (в отличие от самой HNO2 соли ее в растворе устойчивы).
Сама HNO2 известна только в разбавленных водных растворах. По силе она лишь немного превышает уксусную кислоту.
Наиболее характерны для азотистой кислоты сильно выраженные окислительные свойства, причем восстанавливается она в большинстве случаев до NO. С другой стороны, действием сильных окислителей азотистая кислота может быть окислена до азотной. Типичные примеры характерных для нее окислительно–восстановительных процессов приводятся ниже:
Обе эти реакции протекают в кислой среде.
7) Для азотистой кислоты (K = 5 ·10 – 4 ) вероятно наличие двух способных переходить друг в друга структур:
Сущность первого метода заключается в каталитическом окислении аммиака кислородом воздуха. Как было выяснено еще в 1900 г., при быстром пропускании смеси NH3 с избытком воздуха над платиновым катализатором (нагретым до 800 °С) по реакции
8) Схема установки для окисления аммиака показана на рис. 121 (А –теплообменник). Катализатор из сплава платины с 5–10% родия оформляют в виде тонкой сетки, сквозь которую ‘ и продувается смесь исходных газов. На практике пользуются смесью аммиака с воздухом, содержащей не более 12%
NH3 по объему. Максимальный выход окиси азота составляет около 98% от теоретического.
Второй метод (т. н. дуговой) – получение азотной кислоты «сжиганием воздуха»–был разработан в 1905 г. Как видно из рис. 117, более или менее выгодное положение равновесия синтеза NO из элементов достигается лишь при очень высоких температурах. С другой стороны, устанавливается оно при этих условиях практически моментально. В связи с этим задача.технического осуществления синтеза NO формулировалась следующим образом: необходимо было изыскать способ нагреть воздух до возможно высокой температуры и затем очень быстро охладить газовую смесь ниже 1200°С с тем, чтобы не дать возможности образовавшейся окиси азота распасться обратно на азот и кислород.
Хотя при техническом осуществлении дугового метода выход NO составляет лишь около 2% по объему, однако это не играет особой роли ввиду бесплатности исходного сырья – воздуха. Гораздо более важным недостатком дугового метода является большой расход электроэнергии. Именно поэтому его промышленное значение в настоящее время невелико.
Наконец, третий способ получения азотной кислотыиз селитры – являлся в прошлом единственным, но теперь почти не имеет промышленного значения. В его основе лежит взаимодействие селитры с концентрированной серной кислотой:
Реакция эта легко протекает при нагревании.
9) Очень концентрированная (98%) HNO3 может быть получена взаимодействием воды или разбавленной кислоты с жидкой N2 O4 и кислородом под давлением 50 ат. Этот «прямой синтез» осуществляют обычно при 70 °С. Получаемая кислота находит использование в реактивной технике.
Безводная азотная кислота представляет собой бесцветную (при хранении быстро желтеющую) жидкость, которая кипит при 86 °С. Кипение сопровождается частичным разложением по реакции:
Растворяясь в перегнавшейся кислоте, двуокись азота сообщает ей желтую или красную (в зависимости от количества NO2 ) окраску. Так как NO2 постепенно выделяется из раствора, подобная азотная кислота называется дымящей. Разложение 100%–ной HNO3 медленно идет на свету уже при обычных температурах.
С водой HNO3 смешивается в любых соотношениях. Применяемая в лабораторной практике концентрированная азотная кислота содержит около 65% HNO3 и имеет плотность 1,40. По составу она приблизительно соответствует формуле HNO3· 2H2 O.
С химической стороны азотная кислота характеризуется прежде всего сильно выраженными окислительными свойствами.
Некоторые бурно реагирующие с разбавленной азотной кислотой металлы (например, Fe) практически не взаимодействуют с концентрированной (и особенно – дымящей). Обусловлено это тем, что на их поверхности образуется очень тонкий, но плотный защитный слой нерастворимого в кислоте окисла. Благодаря такой «пассивности» железа концентрированную HNO3 можно перевозить в стальных цистернах.
Для отличия азотной кислоты от азотистой важно их отношение к йодистому водороду, В то время как HNO3 тотчас окисляет его до иода, разбавленная азотная кислота на HJ не действует. Напротив, концентрированная HNO3 окисляет не только HJ, но и НСl. Однако в последнем случае реакция обратима:
Смесь концентрированной HNO3 с концентрированной НСl называют обычно «царской водкой», Она действует значительно энергичнее, чем каждая из этих кислот в отдельности. Так, даже Au и Pt легко растворяются в царской водке с образованием соответствующих хлористых соединений по схемам:
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2 O
Активным действующим началом царской водки является, с одной стороны, хлор в момент выделения с другой – легко отдающий его хлористый нитрозил.
Подобно окислительной, очень сильно выражена у HNO3 и кислотная функция. Так как при разбавлении раствора первая из них ослабляется, а вторая усиливается, реакции многих металлов с разбавленной HNO3 протекают по общему типу, т. е. с вытеснением водорода. Однако последний не выделяется, а расходуется на восстановление избытка HNO3 до производных более низкой валентности азота, вплоть до NНз. Как правило, получается смесь различных продуктов восстановления.
12) Характер конечных продуктов восстановления HNO3 сильно зависит от ряда факторов – концентрации кислоты, природы восстановителя, температуры и т. д. Как влияет концентрация самой кислоты (при равных прочих услозиях),видно из приводимого в качестве примера рис. 122. Кипячением в щелочной среде с порошком алюминия нитраты могут быть количественно восстановлены до аммиака. Реакция идет по уравнению, например:
При достаточном нагревании нитратов они разлагаются, причем характер распада зависит от природы катиона. Соли наиболее активных металлов (расположенных в ряду напряжения левее Mg) с отщеплением кислорода переходят в соответствующие нитриты, соли менее активных (Mg–Cu) распадаются с образованием окислов и еще менее активных (правее Cu) – свободных металлов. Примерами могут служить реакции:
Неодинаковый характер протекания этих реакций обусловлен различной устойчивостью соответствующих нитритов и окислов при температурах распада: в этих условиях для Na еще устойчив нитрит, для Рb он уже неустойчив, но еще устойчив окисел, а для Ag неустойчиво и то и другое соединение, вследствие чего и происходит выделение свободного металла.
Ввиду легкости отдачи нитратами кислорода при высоких температурах, смеси их с горючими веществами сгорают чрезвычайно быстро. На этом основано применение нитратов в пиротехнике и для изготовления черного пороха.
Отвечающий азотной кислоте ангидрид может быть получен взаимодействием NO2 с озоном:
Азот и кислород реакция
Подскажите азот и кислород реакция протекает при каких условиях? Запишите уравнение. Что собой представляет метод газовой хроматографии? На какие виды его классифицируют и в соответствии с какими признаками?
Азот и кислород реакция носит обратимый характер. Условиями для ее протекания являются: температура 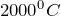
Газовая хроматография — метод разделения летучих соединений. Подвижной фазой служит инертный газ (газ-носитель), протекающий через неподвижную фазу, обладающую большой поверхностью. В качестве подвижной фазы используют водород, гелий, азот, аргон, углекислый газ. Газ-носитель не взаимодействует с разделяемыми веществами и неподвижной фазой. В зависимости от агрегатного состояния неподвижной фазы различают два вида газовой хроматографии — газотвердофазную (неподвижная фаза — твердый носитель: силикагель, уголь, оксид алюминия) и газожидкостную (неподвижная фаза — жидкость, нанесенная на инертный носитель).
Процесс разделения основан на различии в летучести и растворимости (или адсорбируемости) разделяемых компонентов. Через хроматографическую колонку быстрее движется тот компонент, растворимость которого в неподвижной фазе меньше, а летучесть (упругость пара) при данной температуре больше. Газохроматографическим методом могут быть проанализированы газообразные, жидкие и твердые вещества с молекулярной массой меньше 400, удовлетворяющие определенным требованиям, главные из которых — летучесть, термостабильность, инертность и легкость получения.
Азот. Химия азота и его соединений
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии :
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III) нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Суммарное уравнение процесса:
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами : с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Гидроксид меди (II) растворяется в избытке аммиака:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Способы получения солей аммония
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Химические свойства солей аммония
NH4Cl ⇄ NH4 + + Cl –
Соли аммония реагируют с щелочами с образованием аммиака.
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
Химические свойства оксида азота (I):
N2O + Mg → N2 + MgO
Еще пример : оксид азота (I) окисляет углерод и фосфор при нагревании:
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства.
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
Оксид азота (III)
Способы получения: м ожно получить при низкой температуре из оксидов азота:
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами :
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
4. Оксид азота (IV) димеризуется :
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Еще пример : оксид азота (V) реагирует с оксидом кальция:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
1. Азотная кислота практически полностью диссоциирует в водном растворе.
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
4. Азотная кислота частично разлагается при кипении или под действием света:
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Еще пример : азотная кислота окисляет йодоводород:
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO 2 существует только в разбавленных растворах, при нагревании она разлагается :
без нагревания азотистая кислота также разлагается :
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
Азотистая кислота окисляет соединения железа (II):
Кислород и пероксид водорода также окисляют азотистую кислоту:
Соединения марганца (VII) окисляют HNO2:
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
Нитрат марганца (II) разлагается до оксида марганца (IV):
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
При взаимодействии с очень сильными восстановителями ( алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака: