Что будет если смешать глицерин и азотную кислоту
Век XIX был веком торжества металлургии и химии. Заводы становились все крупнее, производилось все больше стали, строились новые мосты и дороги, тоннели и все более глубокие шахты. И в рытье новых тоннелей, строительстве новых дорог, выработке новых шахт большую роль сыграл нитроглицерин, а потом и созданный на его основе динамит.
Изобретение

Фото: ru.wikipedia.org
Итальянский химик Асканио Собреро, работавший в Туринском университете, проводил опыты по реакции между глицерином и смесью азотной и серной кислот. Смесь этих кислот сегодня называют «нитрующей смесью», ее воздействие на многие вещества создает новые вещества, часто очень неустойчивые и склонные к самопроизвольной детонации.
В то же время Нобели изучали и работу российских химиков, исследовавших возможность уменьшения чувствительности нитроглицерина. Нобели придумали способ подрыва нитроглицерина, создав капсюли-детонаторы на основе гремучей ртути. 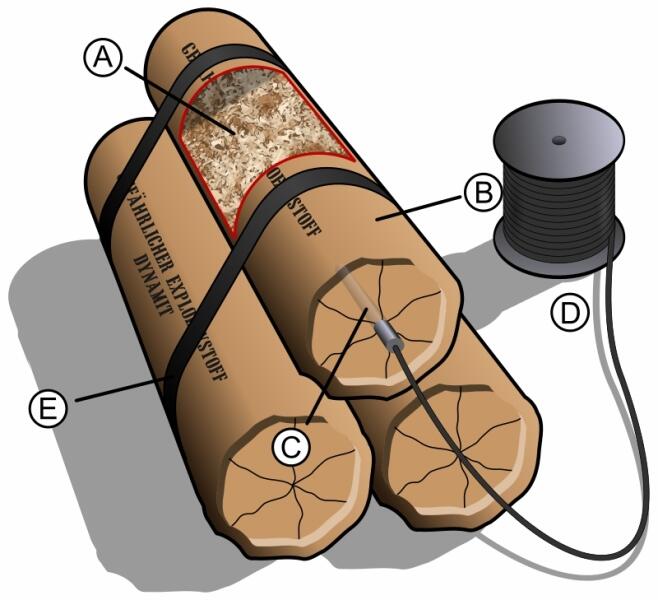
Фото: ru.wikipedia.org
Применение в медицине
При изучении свойств созданного вещества Асканио Собреро установил, что вещество обладает сладким вкусом и вызывает сильную головную боль. Сегодня врачи понимают, что эта боль вызвана снижением артериального давления. Но эти симптомы не были правильно интерпретированы тогдашними врачами.
Но история лекарства скоро продолжилась: новым препаратом заинтересовался врач из Лондона Вильям Мюррел. Он обратился к химику В. Мартиндейлу, который сумел придать нитроглицерину форму мелких стабильных гранулок. Пациент взял на язык одну гранулку — и боль в груди прекратилась. Если нет, то принять еще одну гранулку, рассосав ее на языке. Первое сердечное лекарство состоялось! 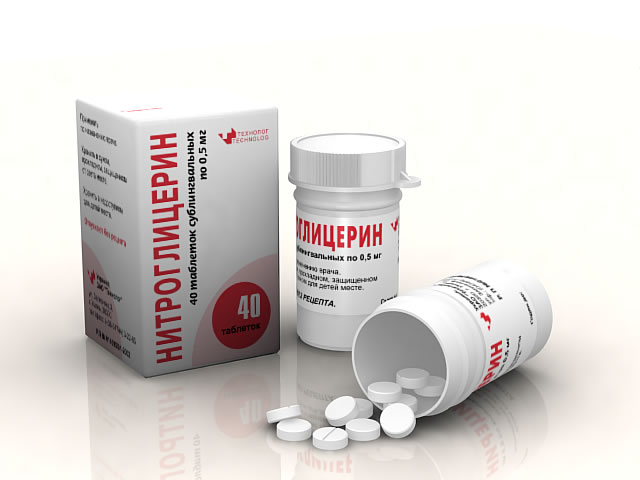
А понять, что этот нитроглицерин делает и почему сердце перестает болеть, сумели только в самом конце XX века три исследователя из США: Луис Игнарро, Роберт Фёрчготт и Ферид Мьюрэд, за что они и получили в 1998 году Нобелевскую премию по медицине и физиологии.
Оказывается, в организме человека нитроглицерин освобождает оксид азота, который расслабляет гладкомышечные клетки, что приводит к расширению кровеносных сосудов.
Создание динамита
Нобели придумали пропитывать нитроглицерином различные пористые материалы.
Одновременно с ними в других странах, в том числе и в России, проводились аналогичные исследования.
Динамит был нарасхват, за первые 8 лет его производство выросло в 800 раз — от примерно 10 тонн в год до 8000 тонн. И на этом производстве уже работала не одна небольшая фабрика, а несколько десятков фабрик. Генералы начали потирать руки в предвкушении боевого применения…
Боевое применение
Пытаясь уменьшить взрывоопасность динамита, исследователи создали желатин-динамит — при взаимодействии нитроглицерина и желеобразной массы, получаемой при разведении коллодия различными органическими растворителями. Желатин-динамиты, или «гремучие студни», широко использовались при строительстве тоннелей в Альпах. И туннель под перевалом Сен-Готард, и все остальные туннели, пробитые людьми в то время, своей прокладкой во многом обязаны «гремучим студням». 
Фото: ru.wikipedia.org
Триумф и закат эпохи динамита
Ручные гранаты — динамит. Террористические акты ирландцев в Великобритании и революционеров в России — динамит. Морские мины — динамит.
Век динамита почти закончился — осталось еще применение при прокладывании тоннелей, при постройке шахт.
Зато все до сих пор помнят Нобелей. В основном благодаря Нобелевской премии.
Даже шутливая премия Ignobel получила свое название именно от Нобеля.
Нитроглицерин
| Нитроглицерин | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитроглицерин |
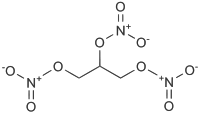
| Химическая формула | CHONO2(CH2ONO2)2 |
| Физические свойства | |
| Молярная масса | 227.0865 г/моль |
| Плотность | 1.595 г/см³ |
| Термические свойства | |
| Температура плавления | 13 °C |
| Классификация | |
| SMILES | C(C(CO[N+](=O)O |
Нитроглицерин (глицеринтринитрат, тринитроглицерин, тринитрин, НГЦ) — сложный эфир глицерина и азотной кислоты. Исторически сложившееся название «нитроглицерин» с точки зрения современной номенклатуры является несколько некорректным, поскольку нитроглицерин является нитроэфиром, а не «классическим» нитросоединением. Широко известен благодаря своим взрывчатым (и в некоторой степени лекарственным) свойствам. Химическая формула O2NOCH2CH(ONO2)CH2ONO2. Впервые синтезирован итальянским химиком Асканьо Собреро в 1847 году, первоначально был назван «пироглицерин» (итал. pyroglycerina ).
Согласно номенклатуре IUPAC именуется 1,2,3-тринитроксипропан.
Содержание
Получение
В лаборатории получают этерификацией глицерина смесью концентрированной азотной и серной кислот. Кислоты и глицерин должны быть очищены от примесей. Для этерификации предварительно при постоянном перемешивании и охлаждении смешивают кислоты, изготавливая таким образом нитрующую смесь, и добавляют по каплям глицерин при постоянном охлаждении колбы льдом и контроле температуры.
Описание реакции: 2H2SO4 + HNO3 ↔ H2SO4 · H2O + NO2 HSO4 Реакция равновесна с сильным смещением равновесия влево.
Затем реакционную смесь кислот и глицерина выдерживают непродолжительное время, при охлаждении льдом. Жидкость расслаивается на два слоя. Нитроглицерин легче нитрующей смеси и всплывает в виде мутного слоя.
Физико-химические свойства
Сложный эфир глицерина и азотной кислоты. Прозрачная вязкая нелетучая жидкость (как масло), склонная к переохлаждению. Смешивается с органическими растворителями, почти нерастворим в воде [1] (0.13 % при 20 °C, 0,2 % при 50 °C, 0,35 % при 80 °C, по другим данным [источник не указан 1317 дней] 1,8 % при 20 °C и 2,5 % при 50 °C). При нагревании с водой до 80 °C гидролизуется. Быстро разлагается щёлочами.
Токсичен, всасывается через кожу, вызывает головную боль. Очень чувствителен к удару, трению, высоким температурам, резкому нагреву и т. п. Чувствительность к удару для груза 2 кг — 4 см (гремучая ртуть — 2 см, тротил — 100 см). Весьма опасен в обращении. При осторожном поджигании в малых количествах неустойчиво горит синим пламенем. Температура кристаллизации 13,5 °C (стабильная модификация, лабильная кристаллизуется при 2,8 °C). Кристаллизуется со значительным увеличением чувствительности к трению. При нагревании до 50 °C начинает медленно разлагаться и становится ещё более взрывоопасным. Температура вспышки около 200 °C. Теплота взрыва 6,535 МДж/кг. Температура взрыва 4110 °C. Несмотря на высокую чувствительность, восприимчивость к детонации довольно низка — для полного взрыва необходим капсюль-детонатор № 8. Скорость детонации 7650 м/с. 8000-8200 м/c — в стальной трубе диаметром 35 мм, инициирован с помощью детонатора № 8. В обычных условиях жидкий НГЦ часто детонирует в низкоскоростном режиме 1100—2000 м/с. Плотность 1,595 г/см³, в твёрдом виде — 1,735 г/см³. Твёрдый нитроглицерин менее чувствителен к удару, но более к трению, поэтому очень опасен. Объем продуктов взрыва 715 л/кг. Фугасность и бризантность сильно зависят от способа инициирования, при использовании слабого детонатора мощность сравнительно невелика. Фугасность в песке — 390 мл, в воде — 590 мл (кристаллического несколько выше), работоспособность (фугасность) в свинцовой бомбе 550 см³. Применяется как компонент некоторых жидких ВВ, динамитов и главным образом бездымных порохов (пластификатор — нитроцеллюлоза). Кроме того, в малых концентрациях применяется в медицине.
Применение
Я пью его в мельчайших дозах,
На сахар капаю раствор,
А он способен бросить в воздух
Любую из ближайших гор.
Он, растворенный в желатине
И превращенный в динамит,
В далекой золотой долине,
Взрывая скалы, загремит.
И содрогнулся шнур бикфордов,
Сработал капсюля запал,
И он разламывает твердый,
Несокрушимый минерал.
Сердечной боли он – причина,
И он один лекарство мне –
Так разъяснила медицина
В холодной горной стороне.
В фармакологии
Нитроглицерин относится к категории веществ, называемых вазодилататорами — средствам, понижающим кровяное давление, расслабляет гладкую мускулатуру кровеносных сосудов, бронхов, желчных и мочевых путей, желудочно-кишечного тракта. Основное применение имеет при стенокардии, главным образом для купирования острых приступов спазмов коронарных сосудов. Для предупреждения приступов он мало пригоден из-за кратковременности действия. Иногда применяется при эмболии центральной артерии сетчатки, а также функциональных холицистопатиях.
Применяется в виде таблеток по 0,5 мг для помещения под язык; а также в 1 % спиртовом растворе.
Во взрывотехнике
Нитроглицерин широко применялся во взрывотехнике. В чистом виде он очень неустойчив и опасен. После открытия Собреро нитроглицерина, в 1853 г. русский химик Зинин предложил использовать его в технических целях. Спустя 10 лет инженер Петрушевский первым начал производить его в больших количествах, под его руководством нитроглицерин был применён в горном деле в 1867 г. Альфред Нобель в 1863 г. изобрёл инжектор-смеситель для производства нитроглицерина и капсюль-детонатор, а в 1867 г. — динамит, получаемый смешением нитроглицерина с кизельгуром (диатомитом, инфузорной землёй).
В литературе и кино
Герои приключенческого романа «Таинственный остров» (1874) Жюль Верна использует нитроглицерин для подрыва гранитной скалы. Автор подробно описывает процесс получения нитроглицерина из природных веществ, обнаруженных на острове (хотя Жюль Верн намеренно опустил один из важных этапов синтеза). Писатель характеризует это вещество следующим образом [3] :
Основная часть сюжета фильма «Плата за страх» (1953) заключается в процессе перевозки нитроглицерина на грузовиках.
В романе Чака Паланика «Бойцовский клуб» (1996) и одноимённом фильме (1999) главный герой получает нитроглицерин путём плавления мыла и добавления глицерина в азотную кислоту.
Возьмите одну часть 98%-ной дымящей азотной кислоты, и смешайте с тремя частями концентрированной серной кислоты. Делать это надо на ледяной бане. Затем добавляйте глицерин по капле из глазной пипетки. Вы получили нитроглицерин.
В фильме «Вертикальный предел» (2000) есть эпизод с самопроизвольной детонацией жидкого нитроглицерина от прямого воздействия солнечных лучей.
В сериале Побег сезон 2 серия 9 в ботаническом саду находят ящик с ампулами нитроглицерина, который спрятал Майкл Скофилд.
В фильме «Легенда Зорро» (2005) главный злодей демонстрирует нитроглицерин заказчикам, также финальная сцена фильма происходит в поезде, перевозящем нитроглицерин.
Что будет если смешать глицерин и азотную кислоту
Из них в настоящее время известны только два — одноазотный и трехазотный. Первый, получаемый при смешении глицерина с умеренно разведенной азотной кислотой (1ч. HNO 3 на 3 ч. Н 2 O) представляет жидкость, легко растворимую в воде и спирте, почти не растворимую в эфире и не взрывающуюся от удара. Трехазотный эфир получается при действии на глицерин смеси наиболее крепких кислот азотной и серной и отличается от предыдущего по своему отношению к растворителям, и в особенности по чрезвычайно сильной взрывчатости при быстром нагревании и ударе. Этот последний эфир и есть то могущественное взрывчатое вещество, которое впервые было приготовлено Собреро в лаборатории Пелуза в 1847 г. и с тех пор во взрывчатой технике называется Н. В числе первых лиц, давших толчок к применению его в практике, следует назвать профессора Зинина (1854 г.) и поручика артиллерии (впоследствии ген.-лейтенанта) В. Ф. Петрушевского, но главная заслуга в этом отношении бесспорно принадлежит шведскому инж. Альфреду Нобелю, который изобрел способ (превращением в динамиты) делать его достаточно безопасным при перевозке и обращении. В настоящее время производство Н. представляет одну из видных отраслей обрабатывающей промышленности.
1) Для приготовления нитроглицерина применяется общая реакция получения азотно-кислых эфиров алкогольных веществ, т. е. действие на глицерин (1 часть) крепкой азотной кислотой (3 части) в присутствии концентрированной серной кислоты (6 частей):
Приcутствие серной кислоты необходимо при этом, с одной стороны, для поглощения выделяющейся при реакции воды, которая, в противном случае, разжижая азотную кислоту, тем самым препятствовала бы полноте нитрации (стали бы получаться неполные азотные эфиры глицерина), с другой — для выделения образующегося Н. из раствора в азотной кислоте, так как он, будучи хорошо растворим в этой кислоте, не растворяется в смеси ее с серной. Эта реакция образования Н. сопровождается значительным самонагреванием, потому что, как самая этерификация глицерина азотной кислотой, так и соединение образующейся воды с серной кислотой отделяют тепло. Если бы вследствие самонагревания температура смеси повысилась до 50°, то действие кислот легко направилось бы в другую сторону: началось бы окисление глицерина и Н., сопровождающееся бурным выделением окислов азота (красно-бурых паров) и еще большим самонагреванием, которое могло бы окончательно привести к взрыву образовавшегося нитроглицерина. Поэтому реакцию должно вести при постоянном охлаждении смеси кислот и глицерин прибавлять к последней понемногу, размешивая каждую прилитую порцию. Образующийся непосредственно при соприкосновении с кислотами Н., обладая меньшим уд. весом (1,6) сравнительно с кислотной смесью (не менее 1,7), всплывает на поверхность, откуда и может быть собран по окончании реакции. Но самонагреванию при приготовлении Н. можно противодействовать и другим способом, именно — заставляя часть тепла выделиться ранее самого образования Н. и в особенности — замедляя реакцию этого образования предварительным изменением химического состояния реагирующих веществ. Бутми и Фоше достигли этого, приготовляя предварительно две отдельные смеси — серно-глицериновую и серно-азотную. Последняя составляется из равных частей Н 2 SО 4 н HNO 3, а первая из одной части С 3H5 (НО) 3 с тройным количеством H 2SO4, при чем образуется серно-глицериновый эфир C 3H5(HO)2HSO4 со значительным отделением тепла. Если обе смеси, после охлаждения, смешать между собой в такой пропорции, чтобы отношение количеств C 3H5 (НО) 3, Н 2 SО 4 и HNO 3 было приблизительно такое же, как в предыдущем способе, то: а) превращение серно-глицеринового эфира в Н. идет постепенно и медленно, так что оканчивается только через 12 и даже 24 часа, б) количество отделяемого тепла в течение всего этого процесса значительно понижается, так как та часть теплоты, которая происходит вследствие соединения воды с серной кислотой, уже выделилась ранее при образовании серно-глицериновой смеси, и с другой стороны, сам глицерин, превратившись в серно-глицериновый эфир, потерял тогда же часть своей энергии в виде тепла. Вследствие обеих приведенных причин приготовление Н. по этому способу и не может сопровождаться значительным разогреванием, так как пониженное количество теплоты при замедленном течении реакции успевает передаваться окружающей среде. Причина, почему система трех тел С 3H5 (НО) 3, H2SO4 и HNO 3, независимо от начального состояния, превращается так, что глицерин предпочтительно соединяется с азотной кислотой, а серная кислота — с выделяющейся водой, по толковании Бертело, заключается в том, что именно такая окончательная система тел отвечает наибольшему отделению тепла, т. е. принимаемому этим ученым принципу максимума работы, как общему правилу хода химических реакций. В действительности же вопрос сложнее, ибо и в реакции образования Н., как и в громадном большинстве других реакций, наблюдается обычное действие общего закона химических масс. В самом деле, опыты показывают, что из данного количества глицерина, при обыкновенных условиях приготовления, никогда не получается теоретического выхода трехазотного его эфира, а именно: из 100 ч. С 3H5 (НО) 3 не более 234, а обыкновенно около 210 ч. вместо 247. Это объясняется тем, что, по мере прибавления данного количества глицерина, в кислотной смеси остается все меньше и меньше HNO 3, между тем как масса H 2SO4 остается одной и той же, пока не наступает, наконец, такое отношение между количествами той и другой кислоты, при котором, в присутствии выделенной ранее воды, глицерин превращается в неполные азотные эфиры или даже совсем перестает нитроваться, образуя только серно-кислый эфир.
Заводское приготовление Н. может производиться по обоим указанным способам. Но способ Бутми и Фоше, примененный вскоре после его появления на нескольких заводах (франц. — в Вонже; бельг. — в Намюре, англ. — в Памберее), ныне совсем оставлен, как менее выгодный (выход продукта только 190 ч. из 100 ч. глицерина) и притом (судя по несчаст. случаям на этих заводах) не более безопасный сравнительно с обыкновенным способом, тем более, что при таком продолжительном соприкосновении Н. с кислотами (12 — 24 час.), какое имеет место при нитровании по этому способу, все-таки не предотвращается возможность развития реакции окисления с бурным выделением окислов азота. Что же касается обыкновенного способа, то, будучи вообще более выгодным в экономическом отношении, он, в то же время, теперь считается и более безопасным при надлежащей чистоте исходных материалов. Форма, в какой он применяется на заводах, может быть очень различна в своих подробностях. Сначала приготовляли Н. обыкновенно малыми порциями подобно тому, как это делается в лабораториях. Так, по Коппу, к 2 8 00 г кислотной смеси в глиняном или чугунном горшке, помещенном в сосуд с водой (5 — 6 литров), приливают 350 г глицерина из кружки при постоянном размешивании стеклянной или железной палочкой; получившуюся смесь переливают в разделительную воронку и выпускают отстоявшиеся кислоты, а Н. выливают в вышеозначенный сосуд с водой для промывания. Позднее стали, с одной стороны, увеличивать порции обрабатываемого за один раз глицерина, с другой — применять для размешивания при нитровании различные механические приспособления. Важным усовершенствованием в последнем отношении явилось применение (в первый раз на фабрики Мовбрея в Массачусетсе) продувания смеси сжатым воздухом, который производит не только перебалтывание, но и охлаждение вследствие своего расширения: в глиняные горшки, помещенные в общей водяной ванне кругом вытяжной трубы, наливается по 7 — 8 кг кислотной смеси обыкновенного состава, см. выше), и к этой смеси приливается по 0,8 кг глицерина с помощью сифонов из бутылей, поставленных на полке; при этом в каждый горшок по особой трубки проводится струя сжатого воздуха. С 1880 г. начали переходить к способам, в которых подвергаются обработке зараз большие количества глицерина, как это делается на заводах Нобеля, что опишем подробнее.
Исходные материалы, т. е. кислоты азотная, серная и глицерин, должны быть возможно чистые и безводные, именно: серная кислота уд. в. 1,84 с содержанием не менее 95 — 96% H 2SO4, азотная — уд. веса 1,50 с содержанием не мене 93% НNO 3 и глицерин уд. в. 1,26 с содержанием не более 3% воды. Такие примеси, как значительные количества азотноватой окиси в азотной кислоте или присутствие жирных кислот в глицерине, особенно вредны, так как они способствуют возбуждению опасных реакций окисления и препятствуют чистоте промывки приготовляемого Н. Приготовление кислотной смеси производится в больших цилиндрических чугунных сосудах с мешалками внутри или без мешалок. В последнем случае сначала вливается все отвешенное количество азотной кислоты, серная же кислота в соответственном количестве прибавляется после, причем вследствие разницы уд. весов обеих кислот местных разогреваний, однородность смешения достигается сама собой. Пропорция смешения, применяемая в настоящее время — на 1 ч. азотной кислоты ок. 1,666 ч. (большей частью) или 2 ч. (реже) серной кислоты. Из сосудов для смешивания смесь переводится в нитрационные аппараты или самотеком, или же с помощью толстостенных чугунных пневматических подъемников (montejus). Относительные количества при нитровании — на 1 ч. глицерина от 8 до 8,5 ч. кислотной смеси. Это количество смеси — значительно больше требуемого теорией, так как в 8 — 8,5 частях ее содержится около 3 ч. HNO 3, между тем как по теории для превращения 1 ч. глицерина в Н. требуется этой кислоты только 2,05 частей. При большом производстве азотная кислота обыкновенно приготовляется на том же заводе из чилийской селитры с помощью отработанной кислотной смеси. Самое нитрование глицерина производится в нитрационном аппарате (фиг. 1).
Он состоит из свинцового сосуда А, помещенного в деревянном чане В и закрывающегося съемной свинцовой крышкою I, которая при работе замазывается цементом. Через крышку проходят: концы двух свинцовых змеевиков D, находящихся внутри аппарата и назначаемых для охлаждения смеси посредством протекающей через них холодной воды; трубки С, приводящей в аппарат сжатый холодный воздух для размешивания при работе; труба F, отводящая из аппарата пары азотной кислоты; термометры Е, из которых один доходит почти до дна, а другой погружен только в верхний слой жидкости; трубка G для наливания отмеренного количества кислотной смеси; трубка Н для приливания глицерина, согнутая у дна аппарата в кольцо, с мелкими отверстиями. Кроме того, в крышке несколько стеклянных оконцев L для наблюдения за явлениями, происходящими в аппарате. Подобное же оконце J устроено и в вытяжной трубе для наблюдения бурых паров окислов азота, образующихся в случаях развития в аппарате опасных реакций окисления или так наз. разложения Н. Сосуд M служит для отмеривания количества глицерина, определяемого по указательной трубке N, а также для впрыскивания его в кислотную смесь посредством сжатого (до 2 атмосф.) воздуха, впускаемого по трубки О. Через кран К жидкость выпускается из аппарата. Холодная вода при работе проводится не только через внутренний змеевик, но и через кольцеобразное пространство между свинцовыми и деревянными наружными станками. За один раз обрабатывают 150 кг глицерина. Впустив требуемое количество кислотной смеси и охладив ее (пропусканием холодного сжатого воздуха и током воды) до 15 — 20°, начинают вбрызгивание глицерина (с температурой не ниже 20°), регулируя приток его таким образом, чтобы нагревание в аппарате не поднималось выше 25 — 30°. Если температура продолжает повышаться, приближаясь к означенному пределу даже по прекращении притока глицерина, то усиливают пропускание холодного воздуха, а если и после того поднятие не останавливается, то содержимое аппарата быстро выпускается в большой чан с водой; в противном случае легко может начаться разложение H., могущее окончиться взрывом. Вся операция обработки глицерина кислотами, считая наполнение смесью и опоражнивание, требует не более 1 — 1 1 /2 часа времени. Отделение Н. от кислот производится отстаиванием их смеси в так наз. сепараторе (фиг. 2).
Это — свинцовый четырехугольный ящик с коническим дном, вставленный в такой же деревянный ящик А. В крышке находятся: вытяжная труба D с оконцем Е; трубка К для введения смеси из нитрационного аппарата; отверстие для вставления термометра и несколько оконцев. Такое же оконце J с плотно заделанным стеклом находится и на боковой стенке для наблюдения уровней кислоты и всплывающего Н. От конического дна сосуда идет трубка G с оконцем F и кранами Н. Всплывание Н. на поверхность кислот происходит легче, если по мере выделения спускать его через кран J в рядом стоящий промывочный чан L. Присутствие посторонних примесей, напр. жиров в глицерине, серно-кислого свинца и т. п., затрудняет выделение. При нормальных условиях, с чистыми материалами, операция продолжается около 30 мин. По окончании сливания почти всей массы Н. выпускают кислотную смесь через один из нижних кранов, пока в оконце F не появятся слой мутной смеси, состоящей из примесей и различных низших нитропродуктов. В этот момент закрывают кран и выпускают остаток смеси в подходящий сосуд для переноса в чан L. Низшие нитропродукты, образующиеся из самого глицерина или посторонних примесей, обладают меньшим уд. весом сравнительно с Н., всплывают на нем в виде пены и являются особенно склонными к разложению со значительным отделением тепла при действии воздуха. Это нужно иметь в виду при производстве отделения Н., так как присутствие означенной пены может вызвать разложение и внутри сепаратора; тогда в оконце Е появляются красно-бурые пары и температура начинает сама собой подниматься. В таких случаях содержимое выпускается через третий нижний кран в большой чан с водой, как при разложениях в нитрационном аппарате.
Промывание Н., отделенного от избытка кислот, производится в два приема. Сначала подвергают его предварительной промывке в вышеупомянутом чане L. Это — цилиндрический свинцовый сосуд с наклонным дном и двумя кранами М, из которых нижний назначен для выпуска Н., а верхний для выливания воды. Перебалтывание производится помощью сжатого (до 2 атмосф.) воздуха, впускаемого по трубе N, которая внизу загнута и снабжена рядом мелких отверстий. Отстаивание, вследствие большой разницы уд. весов воды и Н., происходит быстро. Начальная температура воды должна быть ок. 15°, а во время приливания Н. не должна подниматься выше 30°. После первой промывки таким же образом производят вторую и третью; в последний раз промывают еще в 2,5% растворе соды, наливая этот раствор слоем в несколько сантиметров толщиной. Для окончательного удаления кислоты, Н. спускается в деревянные чаны, выложенные внутри свинцом и по своему устройству подобные предыдущему чану. Употребляя тройной объем воды, здесь производят от 10 до 18 промывок по 15 мин. каждую с перебалтыванием смеси с помощью сжатого воздуха (или механических мешалок); при 3-й и 5-й промывках вместо воды берется 1% раствор соды. Наиболее благоприятная температура воды 25 — 33°; на некоторых заводах первая промывка ведется при 50°. Продукт считается хорошо промытым, если он выдерживает нижеописанное испытание на стойкость при нагревании. Последняя операция при фабрикации состоит в фильтровании Н. для обезвоживания и удаления случайных твердых примесей. С этою целью его пропускают через специальные фильтры (фиг. 3).
В крышку деревянного, выложенного внутри свинцом, цилиндрического сосуда А с наклоненным дном вставлен фильтрационный свинцовый цилиндр G; на нижнем крае его К лежит бронзовое кольцо L с сеткой M и войлоком; на них насыпается слой прокаленной поваренной соли О и сверху кладется еще войлок P со свинцовым кольцом Q; на верхний войлок надавливает груз R. С помощью ручек J фильтрационный цилиндр может легко выниматься для чистки его или осмотра внутренности сосуда. Такой фильтр, смоченный безводным H., не пропускает сквозь себя механически примешанную (эмульсированную) воду, последние же следы влаги (растворенной в Н.) поглощаются поваренной солью; с целью лучшего высушивания — к последней иногда прибавляют высушенный хлористый магний. В кислотной жидкости, отделенной от продукта, с течением времени может образоваться еще небольшое количество Н.; поэтому эта жидкость, прежде чем пустить ее на переработку для извлечения HNO 3 и Н 2 SО 4, подвергается предварительному отстаиванию (около недели) в больших сепараторах, устроенных подобно вышеописанному; всплывающий Н. время от времени сливается и подвергается обычному промыванию. С другой стороны, спускаемые промывные воды также уносят c собой некоторое количество продукта механически; для отделения и улавливания мелко раздробленного в этих водах Н., их пропускают через длинный свинцовый ящик с поперечными перегородками, снабженными вырезами попеременно, то внизу, то вверху (фиг. 4).
Относительно извлекаемого при этих обеих операциях Н. нужно заметить, что он требует особенно тщательной промывки, так как в нем именно накопляются вышеупомянутые вредные низшие нитропродукты.
т. е. образуется: водяной пар, углекислота, азот и кислород. Этот кислород стараются утилизировать в динамитах (см.) с деятельным поглотителем. Отсутствие окиси углерода делает продукты взрыва совершенно безвредными, что особенно ценно при подземных взрывных работах. Об объеме образующихся газов, количестве отделяющегося тепла, скорости распространения взрыва в больших зарядах, силе и т. п. см. соотв. статью По отношению к различным химическим реагентам Н. содержится подобно другим азотным эфирам: щелочами обмыливается, кислотами разлагается с выделением азотной кислоты, восстановителями превращается обратно в глицерин с выделением окиси азота или аммиака. Для открытия самых малых количеств Н. прибавляют к испытуемой жидкости анилина и концентрированной серной кислоты: получается пурпурово-красное окрашивание, которое при разбавлении водой переходит в зеленое (Вербер).
Н. (мед.). При вдыхании паров, равно как после смазывания языка, Н., в малых дозах, вызывает головную боль, тошноту, головокружение, ощущение жара и учащенное сердцебиение; после внутреннего употребления более значительных доз наблюдались головная боль, дрожание, мышечная слабость, доходившая до полного паралича, отдышка, в некоторых случаях смертельного отравления — резкое расстройство дыхания, синюха и глубокое угнетение нервной системы. Несмотря на эти опасные свойства, Н., употребляющийся в гомеопатии при различных нервных заболеваниях (под названием «глоноина»), сравнительно недавно предложен как средство против невралгий, в особенности против припадков грудной жабы; далее, препарат этот испробован при бронхиальной астме, в некоторых случаях мигрени, при падучей, пляске св. Витта, и при остром и хроническом воспалении почек. Н. назначают по 0,0002 — 0,001 г несколько раз в день или в каплях, от 1 до 5 капель в 1% масляном или алкогольном растворе; средство это приготовляют также в пастилках.




