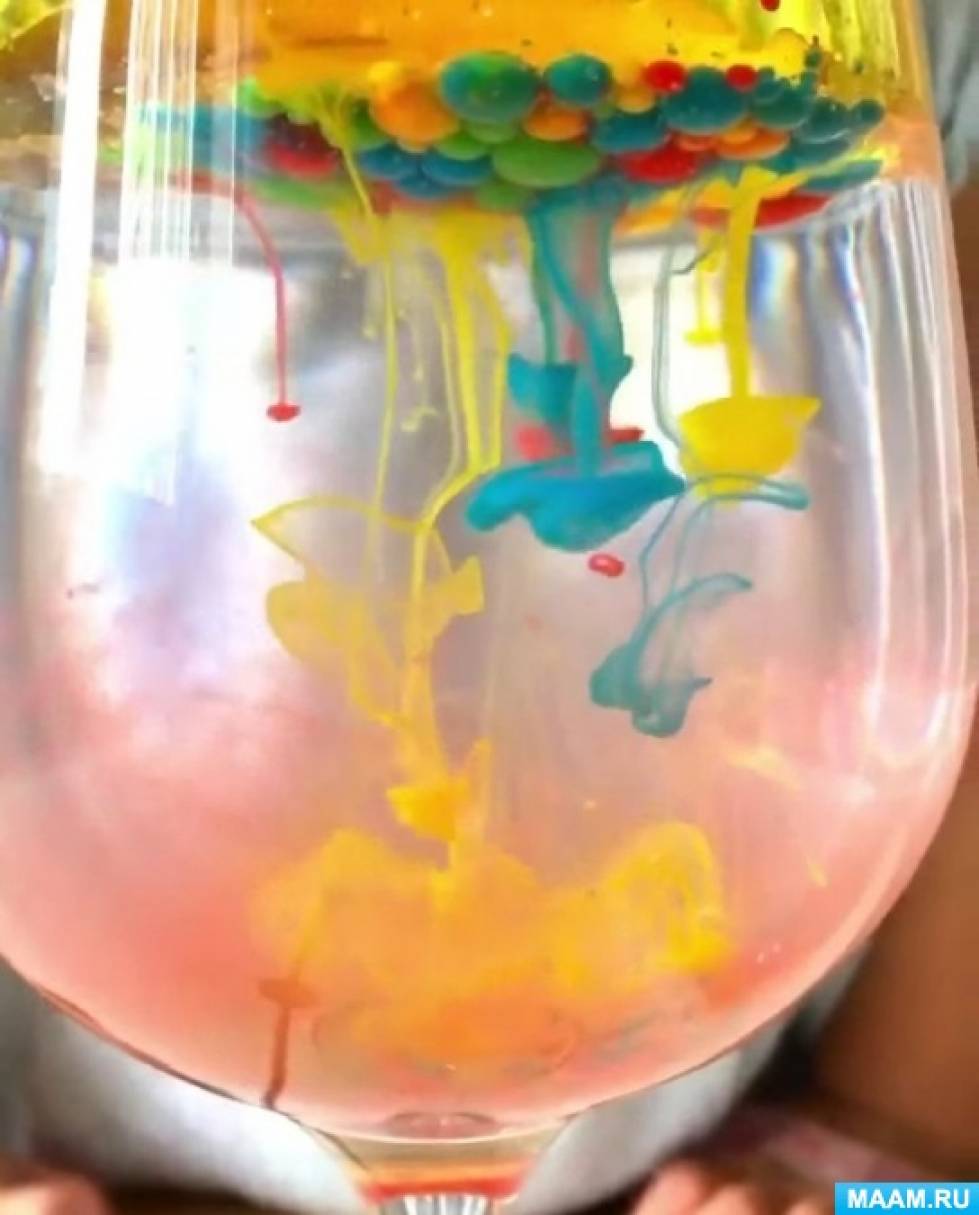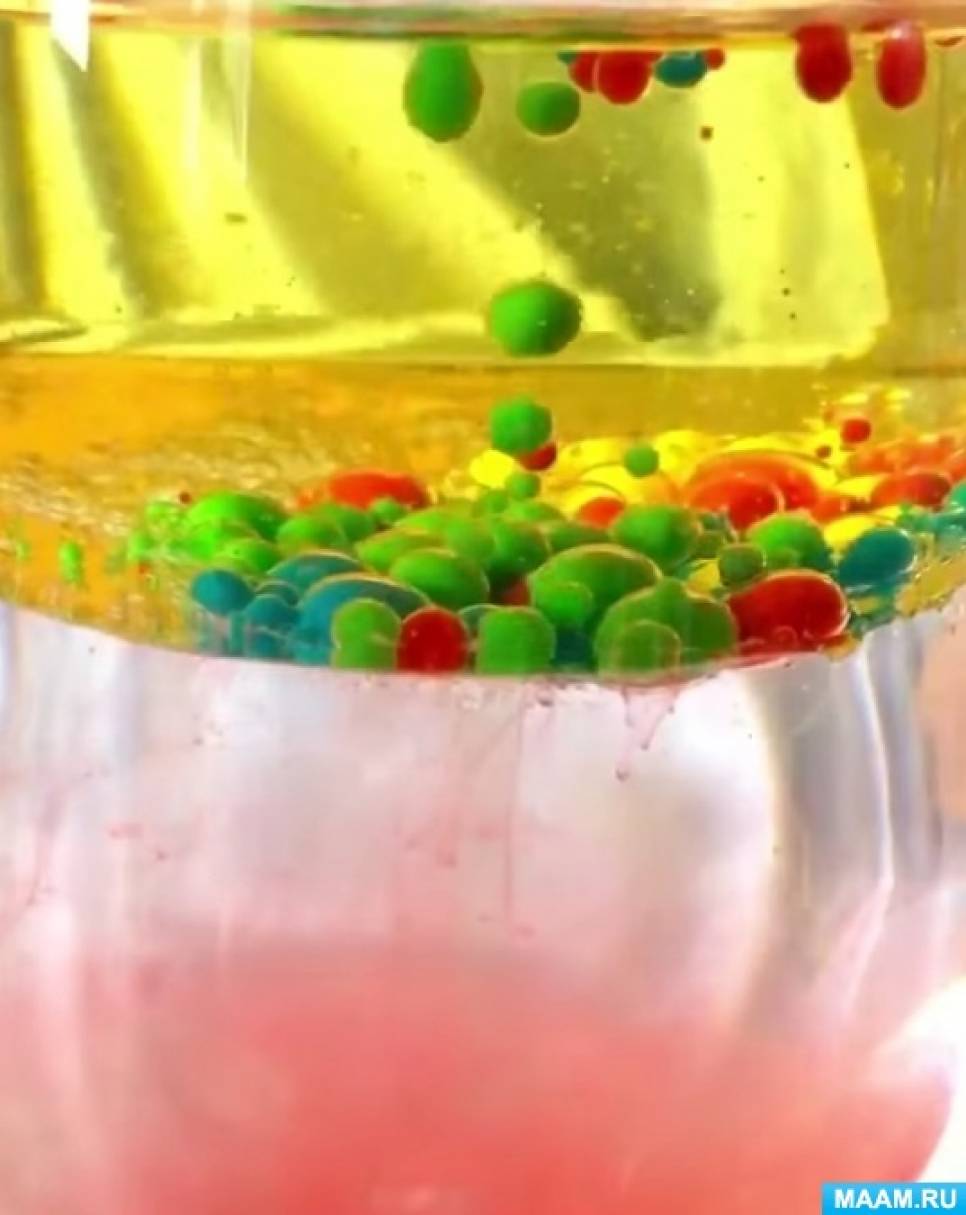Что будет если смешать масло и воду
Взболтать, но не смешивать
Все знают, что вода с маслом не смешивается.
Кто помнит школьную физику, легко назовёт третью жидкость, не смешивающуюся с этими двумя: ртуть.
Вопрос: а сколько всего известно взаимно нерастворимых жидкостей при условиях, близких к нормальным?
Тогда вопрос №2: а сколько можно найти взаимно несмешиваемых жидкостей, которые не страшно принести домой, чтобы показать демку детям?
Мне удалось собрать пять. Собственно, их сливанием вот в эту пробирку мы в статье и займёмся.
1. Рафинированное растительное масло:
В данном случае из виноградных косточек. Состоит оно главным образом из эфиров линолевой и олеиновой кислот. Слово «кислота» пусть не введёт никого в заблуждение. Обе молекулы — это главным образом длинные углеводородные «хвосты» вида *-(CH2)n-CH3. Они и отвечают за гидрофобность. По какой причине вместо масла вполне годится любой жидкий углеводород (пентан, гексан) или их смесь (бензин, керосин). Однако масло менее огнеопасно и покупается в обычном продуктовом магазине.
2. Подкрашенная голубой краской вода H2O:
3. Силиконовое масло:
Силиконовое масло — это смесь низкомолекулярных полимеров с общей формулой вида (C2H6OSi)n. Добытая на Амазоне разновидность используется как загуститель красок и оказалась вязка, как хороший мёд. Если повторять опыт, стоит поискать более текучие разновидности.
Эта жидкость «устаканилась» между водой и маслом, в соответствии с промежуточным значением своей плотности.
4. Расплавленный галлий Ga:
Галлий плавится при +29.8 C. Поэтому пробирка на время помещена в банку с тёплой водой.
Коллекционные количества галлия легко приобретаются в интернете, хотя бы на Амазоне. Металл этот достаточно безопасен, чтобы брать его в руки, и не образует ядовитых испарений. Однако, соприкасаясь с твёрдыми поверхностями и кожей, сильно пачкает их тёмным слоем оксида галлия. Этот оксид растворим в пищевых кислотах, а растворимые соли галлия могут быть и токсичными. Поэтому после работы всё, что с галлием соприкасалось, надо отмывать от его оксида. Обыкновенная тёплая мыльная вода прекрасно справляется с этой задачей.
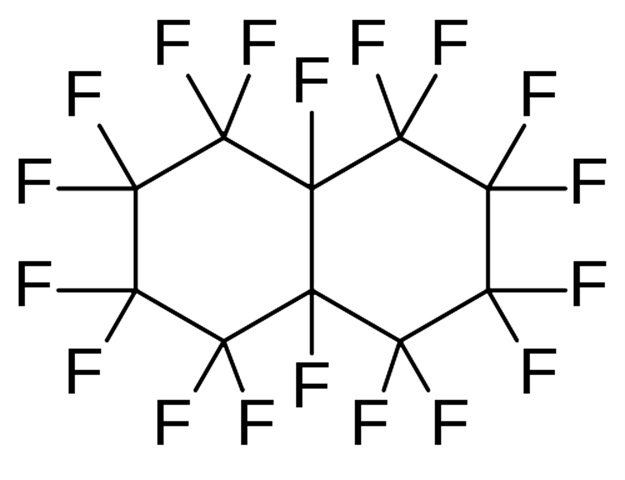
5. И последнее вещество — перфтородекалин (perfluorodecalyn) C10F18:
Эта жидкость заметно тяжелее воды, поэтому собралась над галлием. Состоит она исключительно из фтора и углерода:
В Штатах производители продают это вещество только бизнесам, имеющим легитимную потребность в работе с ним. К счастью, незначительные его количества (5-10 грамм) вполне законно приобретаются у частных лиц на eBay.
Ядовитым в строгом смысле этого слова перфтородекалин не является. Его даже добавляют в некоторые виды косметики, а близкородественные ему соединения используют в качестве основного компонента искусственной крови. Однако пары более лёгких его «родственников» вызывают отключку сознания и используются для наркоза, и мне не хотелось проверять, обладает ли конкретно эта жидкость теми же свойствами. Кроме того, в вопросе о воздействии его на глаза найденные статьи демонстрировали странное разногласие. Так что работал я с ним в очках, перчатках, на открытом воздухе, и не подпускал зрителей к пробирке слишком близко. На всякий случай.
6. Конечное состояние
Качественно перемешав все жидкости стеклянной палочкой, я дал им денёк отстояться, и получил в итоге вот такую картину:
Любопытно, что между некоторыми компонентами возникли тонкие слои дополнительных фаз, вероятно, из-за небольшой взаимной растворимости.
Написал конструктор, напиши и деструктор
Что со всей этой смесью потом делать?
Воду и масло спокойно выливаем. Силиконовое масло — в мусор. Конечные продукты его разложения — вода, углекислый газ и песок, хотя процесс этот небыстрый.
Галлий можно собрать пипеткой, слить в спичечный коробок, заморозить и держать дома для будущих опытов. Только не замораживайте его в стеклянной посуде. Этот металл здорово расширяется при застывании и рвёт её в клочья:
Если всё-таки не хочется держать галлий дома, везите его на свалку для тяжёлых металлов и/или токсичных отходов. Или подарите знакомым химикам, пусть найдут ему применение.
Сложнее всего избавиться от перфтородекалина. Вещество это химически настолько стойкое, что разрушить его в домашних условиях до безопасных компонент практически невозможно. Из-за той же стойкости разлагаться в природе оно будет тысячелетиями, путями не вполне понятными, и с неясным пока воздействием на биосферу за всё это время. Так что, по-хорошему, я бы рекомендовал связаться с организациями, перерабатывающими отходы от настоящих химических лабораторий, и сдать перфтородекалин им. Можно через знакомых химиков, что я и сделал.
Спасибо за чтение, хорошего всем дня! Кому надо, вот PDF.
Ученые рассказали, как можно смешать воду и масло
Ученые определили механизм, благодаря которому масло и вода смешиваются между собой. Это исследование можно расширить и на другие связи химических соединений.
Читайте «Хайтек» в
Ученые отметили, что вода может смешиваться с маслом только в исключительных случаях — например, когда она диспергируется в жидкости в виде маленьких капелек. Это странное поведение веществ не изучалось, и у исследователей не было объяснения этому процессу. Теперь группа из Федеральной политехнической школы Лозанны (EPFL) изучила этот вопрос с помощью новой оптической технологии и обнаружила механизм, благодаря которому они могут смешиваться.
«Молекулы воды имеют настолько сильные взаимодействия друг с другом, что они не любят включать в себя молекулы, которые в них не участвуют», — отметил профессор Сильви Роке, ведущий автор исследования.
К примеру, масло и вода отделяются друг от друга при простом смешивании. Однако при достаточном притоке энергии в виде ультразвука капли масла размером менее микрона смешиваются с водой. Причем при помещении в электрическое поле капли движутся по направлению к положительному электроду. Таким образом, смешивание нейтрального масла и воды приводит к образованию отрицательно заряженных капель масла.
Исследователи определили, что ответ на эту загадку оказался в границе между каплями масла и воды. Молекулы воды предпочитают отдавать и принимать электрические заряды от своих соседей посредством водородной связи. Однако, когда они приближаются к молекулам масла на поверхности капли, они уже не могут найти достаточно соседей воды для связи. Вместо этого молекулы воды отдают несбалансированные электрические заряды молекулам масла на поверхности капли. Это исследование показало, что взаимодействие воды и масла происходит через так называемую неправильную водородную связь.
Чтобы разгадать этот механизм, команда использовала сверхбыструю оптическую технику. На молекулярном уровне граница раздела между каплями масла и воды имеет большое сходство с границами, участвующими в сворачивании белков или формировании биологических мембран.
Занимательный опыт с водой и растительным маслом
ВОЛШЕБНАЯ ЖИДКОСТЬ.
Это отличный опыт, который непременно, порадует ваших детей. Умение видеть чудо в обыденных предметах отличает гения от других людей. Формируется творческое начало в раннем детстве, когда малыш пытливо изучает окружающий мир. Научные эксперименты, в том числе опыты с водой, — легкий способ заинтересовать ребенка естественными науками.
Чем хороша вода для опытов:
Вода — это идеальное вещество для знакомства с физическими свойствами предметов.
Преимуществами привычной нам субстанции являются:
— доступность и дешевизна;
— способность пребывать в трех состояниях:
— твердом, парообразном и жидком;
— способность легко растворять различные вещества;
— прозрачность воды обеспечивает наглядность опыта:
— малыш сможет сам объяснить результат исследования;
— безопасность и нетоксичность веществ, необходимых для экспериментов:
— ребенок может потрогать руками все, что его заинтересует;
— не нужно дополнительных инструментов и оборудования, специальных навыков и знаний;
— можно проводить исследования как дома, так и в детском саду.
Цель: совершенствование представления детей о разнообразных свойствах воды, познакомить со свойствами масла,
развивать наблюдательность, способность сравнивать, сопоставлять, делать выводы, развивать любознательность детей, поддерживать проявления самостоятельности в познании окружающего мира.
Всё что необходимо:
— краски смешанные с водой;
ОБЪЯСНЕНИЕ.
1. Вода и растительное масло не смешиваются друг с другом.

2. Вода плотнее и тяжелее, чем масло.
3. Краска, так как смешана с водой, попадая в масло, превращается в шарик.


4. Шарик с краской проходит через масло и, попадает в свою водную среду и смешивается с ней.


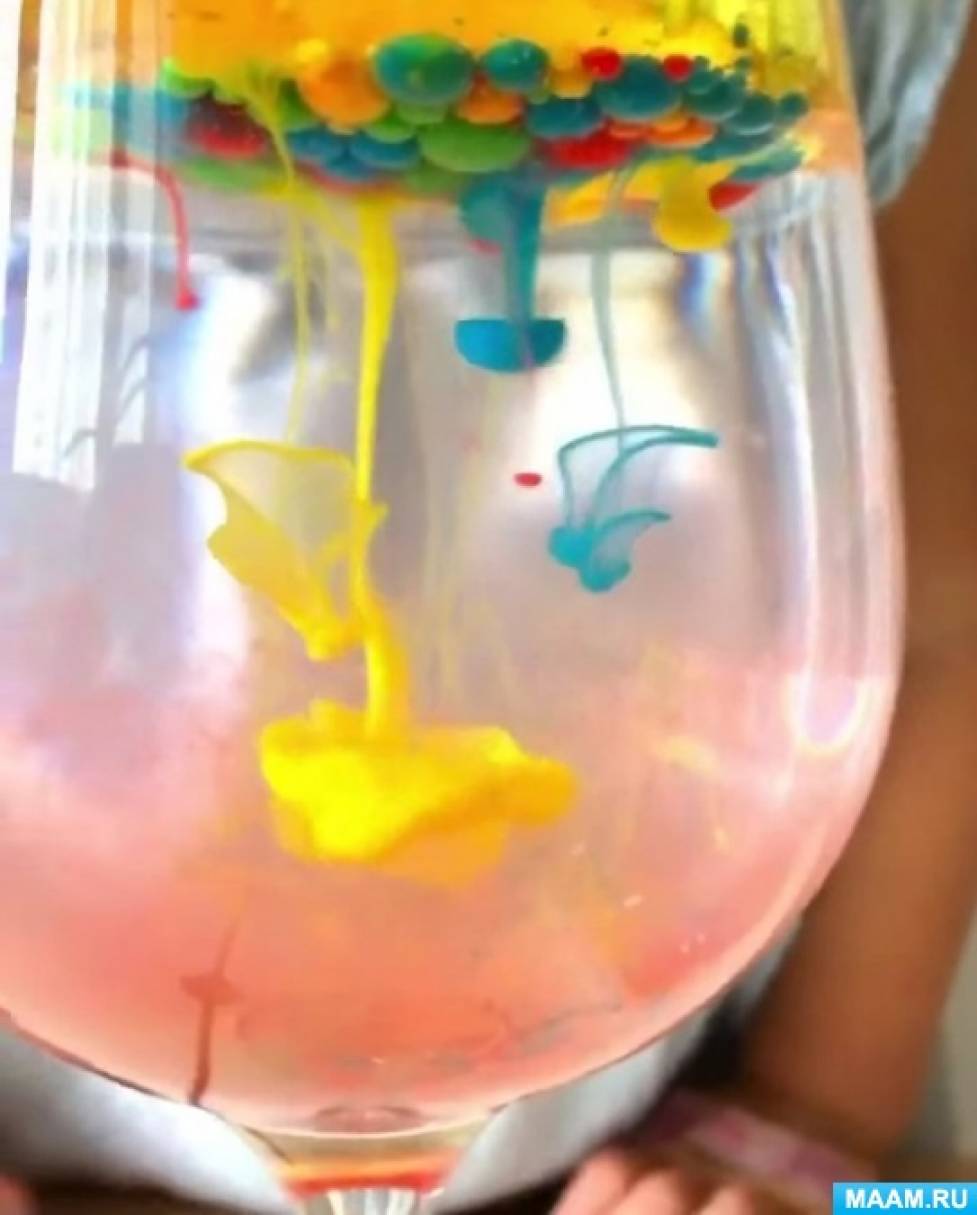



Опыт работы в дистанционном формате «Занимательный детский сад» ДИСТАНЦИОННЫЙ «ЗАНИМАТЕЛЬНЫЙ ДЕТСКИЙ САД» в ГУСЬ-ХРУСТАЛЬНОМ В период самоизоляции педагогам ДОУ в целях обеспечения психолого-педагогической.

Информационный проект «Занимательный материал для дошкольников по математике (1 часть)» Информационный проект «Занимательный материал для дошкольников по математике» (1 часть) Проект направлен на формирование у детей интереса.
Конспект занятия «Занимательный счет» в подготовительной группе Цель: развитие математических способностей воспитанников, логического мышления. Материалы: наборы цифр, карточки с цифрами от 1 до 20, счетные.

Х и м и я
Коллоидная химия
Взаимодействие «воды» и «масла».
Бытовые примеры
Силы межатомного притяжения. Ковалентная связь.
Полярные и неполярные ковалентные связи.
Неполярные ковалентные связи
Полярные ковалентные связи.
Молекулы дифильных веществ
Межмолекулярные силы. Силы Вандер Ваальса.
Дисперсионные силы. Масла – неполярные растворители.
Расслоение воды и масла.
Гидрофобность и гидрофильность.
Дифильность.
Поверхностно-активные вещества.
Взаимодействие жидкости и твёрдых поверхностей. Смачивание.
Бытовые примеры
В обычной бытовой жизни каждый из нас мог быть свидетелем некоторой «антипатии» между водой и маслянистыми жидкостями.
Например, каждый знает, как трудно отмыть жирные руки водой. Без использования мыла это сделать почти невозможно.
Известный факт: если в одной ёмкости смешать воду и масло, то через некоторое время произойдёт их расслоение. Вода, как более тяжёлая жидкость, соберётся в нижней части сосуда, а над ней появится плёнка масла.
Покрытые жиром перья птиц так хорошо отталкивают воду, что даже если птица полностью погрузиться в неё, то вынырнув, ей достаточно будет встряхнуться, чтобы вновь оказаться сухой.
Капли росы на листьях растений – ещё один пример взаимного отталкивания воды и жирной поверхности.
Листья растений покрыты тонкой плёнкой выделяемого ими воска. А воск – жироподобное вещество. Также как и масло, воск не смачивается водой.
А растворяемые вещества делят на:
Таким образом, мы имеем дело с системным отличием в свойствах двух больших классов соединений, как растворителей, так и растворимых веществ.
Разберёмся, с чем объясняются эти отличия.
Силы межатомного притяжения. Ковалентная связь.
Забегая вперёд, сразу скажем, что причина антипатии воды и масла кроется в принципиально разных силах, действующих между образующими их молекулами.
Но прежде, чем рассматривать межмолекулярные силы, необходимо рассмотреть силы межатомного притяжения. Именно они приводят к возникновению молекул и ответственны за различия межмолекулярных сил.
Сделаем это на примере водорода.
Водород – простейший атом. Он состоит из ядра (протона) и одного электрона, совершающего вращательное движение вокруг ядра.
Как известно, устойчивая молекула может возникнуть только при условии, что её потенциальная энергия меньше, чем суммарная потенциальная энергия образующих её атомов.
Английскому физику Ф. Лондону и работавшему в Англии немецкому физику В. Гейтлеру удалось получить уравнение, позволяющее найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от растояния r между ядрами этих атомов. (Позднее их расчёты были подтверждены экспериментально.)
При этом оказалось, что результаты расчёта зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов.
При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически не выгодным и химическая связь между атомами не возникает.
При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии. Дальнейшее сближение атомов вновь приводит к увеличению энергии.
Говоря другими словами, если попытаться сблизить атомы водорода на растояние, меньшее, чем r0, то между ними возникнет сила отталкивания, а если увеличивать расстояние между ними r > r0, то возникнет сила притяжения, пытающаяся вернуть систему в состояние r = r0.
Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 – устойчивая система из двух атомов водорода, находящихся на определённом расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов.
Вследствии такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков, что приводит к образованию устойчивой молекулы.
Химическая связь в молекуле водорода осуществляется путём образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам.
Такая двухэлектронная двухцентровая связь называется ковалентной.
Полярные и неполярные ковалентные связи.
Неполярная ковалентная связь
В случае большинства химических веществ, связь между атомами внутри молекул обеспечивается именно ковалентными связями. Но характер этой связи может отличаться.
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl2, и т.д., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов.
В подобном случае ковалентная связь называется неполярной.
Полярная ковалентная связь
Если же молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении заряда.
В таких случаях ковалентная связь назывется полярной.
Электроотрицательность химических элементов
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности.
Чем большее количество протонов содержит ядро атома элемента и чем меньше его радиус, тем выше будет его электротрицательность.
Понятно, что чем больше расстояние между ядром атома и его внешним электронным уровнем, тем меньше будет сила притяжения между ними и меньше будет поляризующий эффект.
Причём, если рассмотреть последовательность расположения элементов в периодической системе, то выяснится, что большее влияние на величину электроотрицательности будет оказывать, как раз увеличение радиуса элемента, а не массивность его ядра.
Наиболее электроотрицательные атомы окажутся в верхнем правом углу таблицы Менделеева, а наименее электроотрицательные – в нижнем левом углу.
В направлении, заданном этой диагональю (от Фтора F к Францию Fr) электроотрицательность элементов будет закономерно убывать.
Вот значения относительной элетроотрицательности некоторых элементов:
Относительная электроотрицательность атомов