Что будет с эритроцитами если каплю крови перенести в дистиллированную воду
Алгоритм проведения гемотрансфузии
Правила клинического использования донорской крови и (или)ее компонентов.
Трудноопределимые группы крови
Неспецифическая агглютинация наблюдается при аутоиммунной гемолитической анемии и других аутоиммунных заболеваниях, сопровождающихся адсорбцией аутоантител на эритроцитах, при гемолитической болезни новорожденных, эритроциты которых нагружены аллоантителами матери.
Кровяные химеры. Кровяными химерами называют одновременное пребывание в кровяном русле двух популяций эритроцитов, отличающихся по группе крови и другим антигенам.
Трансфузионные химеры возникают в результате многократного переливания эритроцитной массы или взвеси группы 0 (I) реципиентам другой группы. Истинные химеры встречаются у гетерозиготных близнецов, а также после пересадки аллогенного костного мозга.
Другие особенности. Определение группы крови АВ0 и резус принадлежности может быть затруднено у больных в связи с изменением свойств эритроцитов при различных патологических состояниях (у больных циррозом печени, при ожогах, сепсисе).
Проба на совместимость на плоскости при комнатной температуре
для проведения проб на индивидуальную совместимось используется кровь ( сыворотка) больного, взятая перед трансфузией или не более чем за 24 часа, при условии хранения при температуре +4+2°С.
Проба на совместимость с применением 33%полиглюкина
В пробирку вносят 2 капли (0, 1 мл) сыворотки реципиента 1 каплю (0, 05) мл эритроцитов донора и добавляют 1 каплю (0, 1 мл) 33% полиглюкина.
Пробирку наклоняют до горизонтального положения, слегка потряхивая, затем медленно вращают таким образом, чтобы содержимое ее растеклось по стенкам тонким слоем. Контакт эритроцитов с сывороткой больного при вращении пробирки следует продолжать не менее 3 мин.
Результат учитывают, просматривая пробирки на свет невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Ошибочный порядок расположения реагентов.
Температурные условия (определение группы крови производят при температуре не ниже 15°Си не выше 25°С)
Соотношение реагентов и исследуемых эритроцитов.
Продолжительность наблюдения. (позволяет выявить слабый агглютиноген А_2, характеризующийся замедленной агглютинацией)
Биологическую пробу проводят независимо от объема гемотрансфузионной среды и скорости ее введения.
При необходимости переливания нескольких доз компонентов крови биологическую пробу проводят перед началом переливания каждой новой дозы.
в течение 3 мин наблюдают за реципиентом, контролируя у него пульс, дыхание, артериальное давление, общее состояние, цвет кожи, измеряют температуру тела
такую процедуру повторяют еще дважды. Появление в этот период даже одного из таких клинических симптомов, как озноб, боли в пояснице, чувство жара и стеснения в груди, головной боли, тошноты или рвоты, требует немедленного прекращения трансфузии и отказа от переливания данной трансфузионной среды.
Экстренность трансфузии компонентов крови не освобождает от выполнения биологической пробы.
Врач, проводящий переливание компонентов крови обязан:
1.Определить показания для проведения гемотрансфузионной терапии с учетом противопоказаний.
2. Получить информированное добровольное согласие реципиента или его законного представителя на проведение гемотрансфузионной терапии по установленной форме.
3. Провести первичное определение групповой принадлежности крови больного по системе АВО.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ ИСПОЛЬЗОВАТЬ ДАННЫЕ О ГРУППОВОЙ ПРИНАДЛЕЖНОСТИ ПО СИСТЕМАМ АВО И РЕЗУС ИЗ ПАСПОРТА, ПРЕДШЕДСТВУЮЩЕЙ ИСТОРИИ БОЛЕЗНИ И ДРУГИХ ДОКУМЕНТОВ.
4. Внести в направление в клинико-диагностическую лабораторию (форма № 207/у), сведения о результате определения группы крови по системе АВО, серии диагностикумов, трансфузионный и акушерско-гинекологический анамнез. Подписать направление
5. Ознакомиться с заключением клинико-диагностической лаборатории. Перенести данные о групповой и резус-принадлежности больного на лицевую часть медицинской карты стационарного больного с указанием даты анализа и своей фамилии.
6. Оформить предтрансфузионный эпикриз.
7. Провести макроскопическую оценку лабораторного желатина и диагностикумов.
8. Провести макроскопическую оценку каждой дозы гемотрансфузионной среды.
9. Повторно непосредственно перед трансфузией определить группу крови реципиента по системе АВО
10. Определить группу крови по системе АВО с эритроцитсодержащей средой.
11. Проконтролировать соответствие паспортных данных.
12. Провести пробу на совместимость крови реципиента и крови донора (гемотрансфузионной среды) по системам АВО и резус.
13. Зафиксировать результат изосерологических исследований в протоколе операции переливания крови.
ПРОБЫ НА ИНДИВИДУАЛЬНУЮ СОВМЕСТИМОСТЬ ПО СИСТЕМЕ АВО И РЕЗУС НЕ ЗАМЕНЯЮТ ДРУГ ДРУГА.
ПРОВОДЯТСЯ ВО ВСЕХ СЛУЧАЯХ С ОБРАЗЦАМИ КРОВИ ИЗ КАЖДОГО КОНТЕЙНЕРА.
ОБЯЗАТЕЛЬНЫ, ДАЖЕ ЕСЛИ ЭРИТРОЦИТНАЯ МАССА ИЛИ ВЗВЕСЬ ПОДОБРАНЫ РЕЦИПИЕНТУ ИНДИВИДУАЛЬНО В СПЕЦИАЛИЗИРОВАННОЙ ЛАБОРАТОРИИ.
14. Провести биологическую пробу. Зафиксировать её результат в протоколе операции переливания крови.
15. Контролировать состояние реципиента, темп введения трансфузионной среды.
16. При изменении состояния больного в первую очередь исключить посттрансфузионное осложнение.
17. Оценить показатели артериального давления, пульса, результаты термометрии.
18. Зарегистрировать гемотрансфузию:
•в дневнике наблюдений медицинской карты стационарного больного;
•в журнале регистрации переливаний крови и её компонентов (форма № 009/у) ;
•заполнить протокол гемотрансфузии
19. Провести макрооценку первой порции мочи.
20. Назначить клинические анализы крови и мочи на следующие сутки после гемотрансфузии.
21. Провести оценку суточного диуреза, водного баланса, результатов анализов мочи и крови.
22. Наблюдать за больным с отражением результатов наблюдения в дневнике истории болезни. При изменении клинической симптоматики и лабораторных показателей до выписки больного из стационара в первую очередь исключить посттрансфузионное осложнение.
Осложнения
-Иммунные осложнения ( острый гемолиз, гипертермическая негемолитическая реакция, анафилактический шок, некардиогенный отек легких)
-Неиммунные осложнения (острый гемолиз, бактериальный шок, ОССН, отек легких)
-Непосредственные осложнения (аллоиммунизация антигенами эритроцитов, лейкоцитов, тромбоцитов или плазменными белками, гемолиз, реакция >, посттрансфузионная пурпура)
-Иммунные ( гемолиз, Реакция «трансплантат против хозяина», Посттрансфузионная пурпура, Аллоиммунизация антигенами эритроцитов, лейкоцитов, тромбоцитов или плазменными белками
А. Г. Румянцев, В. А. Аграненко. Клиническая трансфузиология-М.: ГЭОТАР МЕДИЦИНА, 1997.
Е. Б. Жибурт. Трансфузиология-С.: ПИТЕР, 2002.
Рагимов А. А. Трансфузиология. Национальное руководство-М.: ГЭОТАР Медиа, 2012.
Алгоритмы исследования антигенов эритроцитов и антиэритроцитарных антител в сложнодиагностируемых случаях. Методические рекомендации N 99/181 (утв. Минздравом России 17. 05. 2000)
Приказ Минздрава России от 25. 11. 2002 N363 » Об утверждении Инструкции по применению компонентов крови»
Приказ Минздрава России от 02. 04. 2013 N183н » Об утверждении правил клинического использования донорской крови и (или) ее компонентов»
Задания части 2 ЕГЭ по теме «Оболочка»
1. Опишите молекулярное строение наружной плазматической мембраны животных клеток.
1) Основу плазматической мембраны составляет двойной слой фосфолипидов, которые повернуты гидрофобными хвостами друг к другу, а гидрофильными головками к воде.
2) В состав мембраны входят проникающие, погруженные и поверхностные белки.
3) К белкам и фосфолипидам с наружной стороны могут прикрепляться углеводы гликокаликса.
2. Какие процессы изображены на рисунках А и Б? Назовите структуру клетки, участвующую в этих процессах. Какие преобразования далее произойдут с бактерией на рисунке А?
1) На рисунке А происходит фагоцитоз, а на рисунке Б пиноцитоз.
2) В этих процессах участвует плазматическая мембрана.
3) Бактерия на рисунке А далее будет переварена: фагоцитозный пузырек сольется с лизосомой, образуется пищеварительная вакуоль, бактерия расщепится на мономеры, которые поступят в цитоплазму.
3. Чем отличается оболочка растительной и животной клетки? Назовите не менее двух отличий.
1. У растительной клетки имеется клеточная стенка из целлюлозы.
2. У животной клетки имеется гликокаликс (слой гликолипидов и гликопротеидов на поверхности мембраны).
4. Почему эритроцит в пресной воде лопается, а инфузория-туфелька, хламидомонада и хлорелла – нет?
1) Осмос – это движение воды через мембрану в сторону более высокой концентрации веществ. Концентрация веществ в цитоплазме живой клетки выше, чем в пресной воде, поэтому вода будет заходить внутрь клетки.
2) Эритроцит набухнет, а затем лопнет.
3) Хлорелла надуется водой, но лопнуть ей не даст клеточная стенка.
4) Инфузория-туфелька и хламидомонада не лопнут, т.к. будут выкачивать воду с помощью сократительных вакуолей.
5. Известно, что в плазме крови концентрация солей в норме соответствует концентрации хлорида натрия 0,9%. В стеклянный стакан, заполненный раствором поваренной соли, поместили эритроциты. Сравните изображение нормального эритроцита в плазме (рис. А) и эритроцита в растворе (рис. Б). Объясните наблюдаемое явление. Определите концентрацию соли в стакане с раствором (более 0,9%, менее 0,9%, равна 0,9%).
1) эритроцит в растворе сморщился из-за потери воды, которая по закону диффузии (осмоса) поступила из эритроцита в раствор;
2) концентрация раствора соли в стакане – более 0,9%
6. Зимой на дорогах используют соль, чтобы не было гололеда. К каким изменениям в водоемах и почве это приводит?
Засоленность почвы приведет к тому, что растениям становится тяжелее забирать из почвы воду. Засоление водоемов приводит к тому, что водные организмы обезвоживаются, их обмен веществ нарушается.
7. В пробирку с кровью человека добавили такое же количество 0,1%-ного раствора поваренной соли. Что произойдет с эритроцитами крови? Ответ поясните.
1) эритроциты начнут набухать, могут лопаться;
2) при добавлении 0,1%-ного раствора соли понижается концентрация солей плазмы, вода по закону осмоса (диффузии) поступает в эритроциты
8. Кожицу лука поместили в концентрированный раствор соли. Объясните, что и почему произойдет в клетках. Какие научные методы применяются в этом исследовании?
1) в клетках произойдет отслоение протопласта (цитоплазмы) от клеточной стенки (плазмолиз) из-за того, что вода из клетки поступает в раствор, где концентрация соли выше (благодаря осмосу);
2) методы: эксперимент, микроскопия (наблюдение)
9. Если поместить растение корнями в подсоленную воду, то через некоторое время оно завянет. Объясните почему.
1) в соленом растворе клетки корня потеряют воду, произойдет плазмолиз, и клетки потеряют тургор;
2) нарушится транспорт воды в растение, и оно завянет.
10. Какие особенности строения молекул воды позволяют ей выполнять её функции в организме?
1) Полярность молекул определяет её функции растворителя гидрофильных соединений.
2) Способность к образованию водородных связей определяет её теплопроводность, плотность.
3) Вязкость определяет свойства слизей, секретов, внутренней среды.
11. Как строение клеточной мембраны соответствует выполняемым ею функциям?
1) Двойной слой липидов мембраны обеспечивает избирательное проникновение веществ в клетку.
2) Встроенные белки выполняют транспортную, строительную, сигнальную функции.
3) Встроенные углеводы выполняют структурную и сигнальную функции.
4) Пластичность мембраны позволяет ей осуществлять процессы фагоцитоза и пиноцитоза.
12. Определите, модель строения какой клеточной структуры изображена на рисунке. Молекулы какого вещества обозначены цифрой 1? Каковы их функции в этой структуре? Назовите не менее двух функций. С какой стороны (А или Б) от мембраны находится цитоплазма клетки? Ответ аргументируйте.
1) модель плазматической мембраны;
2) белки;
3) функции: транспортная, рецепторная, взаимодействие клеток, структурная, ферментативная (любые 2 функции);
4) цитоплазма находится со стороны Б от мембраны;
5) поскольку со стороны А на поверхности мембраны расположен гликокаликс
Стратегия заместительной терапии острой кровопотери. Часть I
Основные принципы коррекции постгеморрагических нарушений гомеостаза.
Заместительной терапии острой кровопотери, возможностях и различных методиках ее коррекции посвящено огромное число работ во всех областях клинической медицины. Само по себе это свидетельствует как о крайней актуальности проблемы, так и об отсутствии единого мнения о путях её решения. То, что совсем недавно принималось за аксиому, на современном этапе развития медицины стало не только ставиться под сомнение, но и порой полностью отвергаться. К примеру, концепция замещения по принципу «капля за каплю» и переливание цельной крови сегодня полностью оставлены. И это притом, что в литературе прошлых лет приводятся десятки и сотни примеров о почти фантастических по своей целебной силе эффектах переливания цельной крови и массивных гемотрансфузий. Эволюция биотехнологий и достижения фарминдустрии сегодня позволяют всё чаще говорить об ограничении трансфузии компонентов крови, порой даже в случаях массивной кровопотери. Однако, возможности использования последних достижений гемотрансфузиологии, к сожалению, ограничены в стационарах неотложной хирургии, хотя именно в них сосредотачивается основная масса пациентов с кровотечениями различной этиологии.
Гипоксия при кровотечении носит как циркуляторный, так и гемический (анемический) характер. Именно двойственность патогенеза нарушений кислородного режима организма при кровотечении обуславливает как тяжелые патофизиологические сдвиги, так и сложность их патогенетической коррекции. Циркуляторная гипоксия, связанная с падением сердечного выброса приводит к снижению величины рО2 в клетках, включению анаэробного пути метаболизма и развитию ацидоза. Особый практический интерес представляет наблюдающаяся с течением времени трансформация нарушений кислородного режима в постгеморрагическом периоде. Так, выходящая на первый план в период продолжающегося кровотечения циркуляторная гипоксия после остановки кровотечения и компенсации макроциркуляции постепенно сменяется на гемическую гипоксию в результате аутогемодилюции, либо вследствие интенсивной инфузионной терапии. В последние годы особое значение уделяется так называемой постинфузионной гемической гипоксии, определена её роль в нарушениях кислородного режима организма и тяжелые патофизиологические последствия. Оптимальным уровнем гемодилюции на фоне введения инфузионных сред большинством автором признается уровень гематокрита не ниже 30%. Именно при этом уровне гемодилюции наблюдается выраженное улучшение реологических свойств крови, и, что самое главное, происходит повышение сердечного выброса без увеличения силы сердечных сокращений и потребности миокарда в кислороде, а лишь за счет улучшения реологических свойств и снижения общего периферического сосудистого сопротивления. Однако, принятая концепция лечения острой кровопотери по принципу «сначала восполняется объем циркулирующей крови, а затем ее качество» порой приводит к выраженной постинфузионной гемодилюции (гематокрит
Эта статья.
. про отделения
Читайте также
Ограничения в связи с профилактикой распространения коронавирусной инфекции COVID-19
Госпитализация (круглосуточно)
8 (499) 394-67-57
Скорая помощь (круглосуточно)
8 (495) 620-84-04
8 (499) 390-80-84
Что они делают с нашей кровью? Это уже клиника!
Что они делают с нашей кровью? Это уже клиника!
Автор
Редакторы
Инфографика на конкурс «био/мол/текст»: Клинический анализ крови — самый распространенный лабораторный тест, назначаемый врачом, когда мы приходим на прием и жалуемся на плохое самочувствие. «Кровь из пальца, завтра с 8:00 до 9:30, натощак, N-ный кабинет», — такую фразу неизменно слышали несколько поколений. Однако технология исследования крови претерпела большие изменения за последние десятилетия и прошла путь от ручных методов к автоматическим. Разбираемся, как анализировали кровь вашей бабушки и почему сейчас все делается по-другому.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Что будем исследовать?
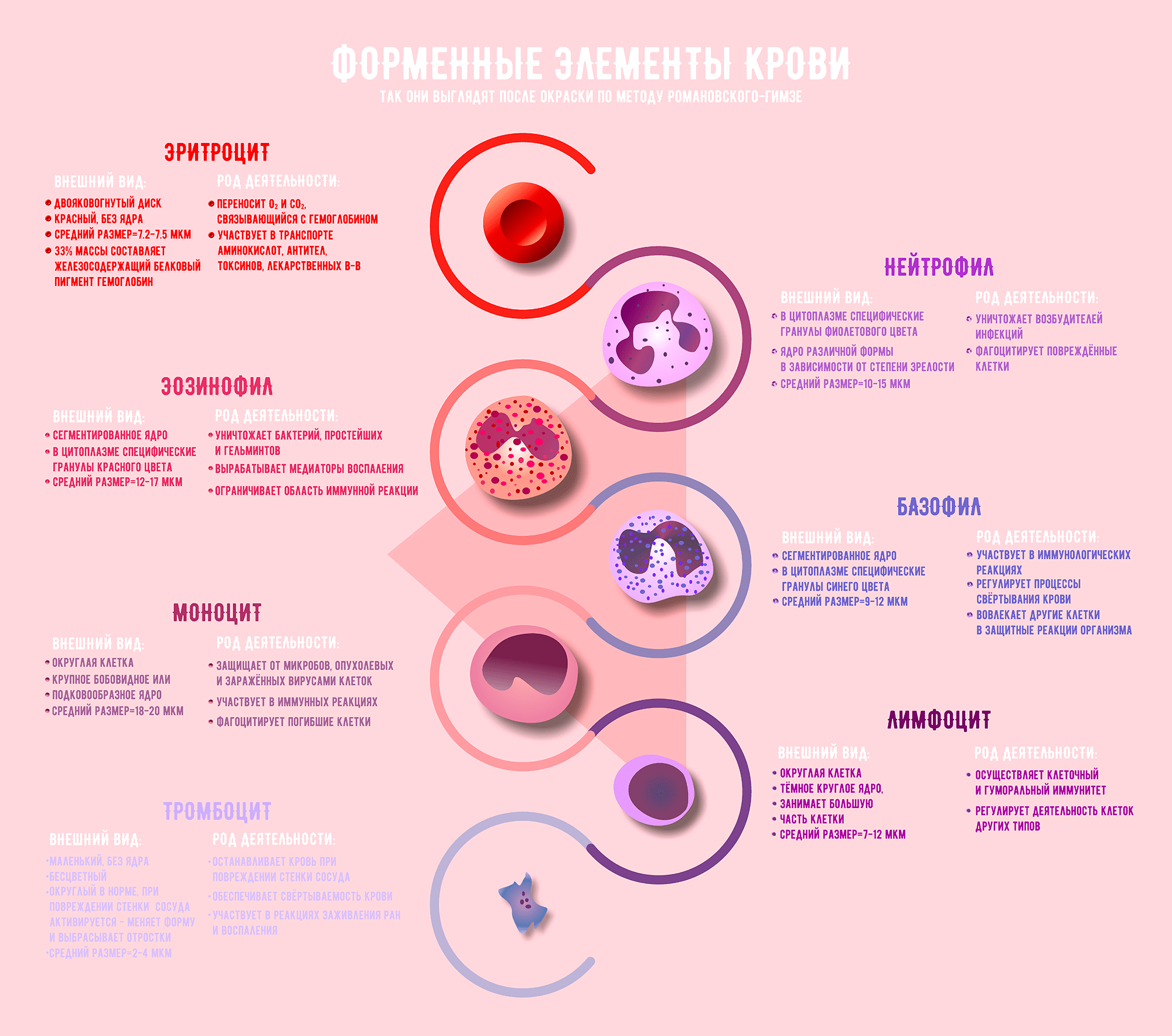
Кровь — жидкая соединительная ткань организма, состоящая из плазмы и трех типов форменных элементов: эритроцитов, тромбоцитов и лейкоцитов. Лейкоциты, в свою очередь, бывают с гранулами в цитоплазме — это нейтрофилы, эозинофилы и базофилы, — и без гранул — лимфоциты и моноциты. Для того чтобы отличить патологию от нормы, нужно знать, какова концентрация клеток крови, как они выглядят и какую функцию выполняют. Пришло время вспомнить, с кем мы имеем дело.
Рисунок 1. Форменные элементы крови [1–3]
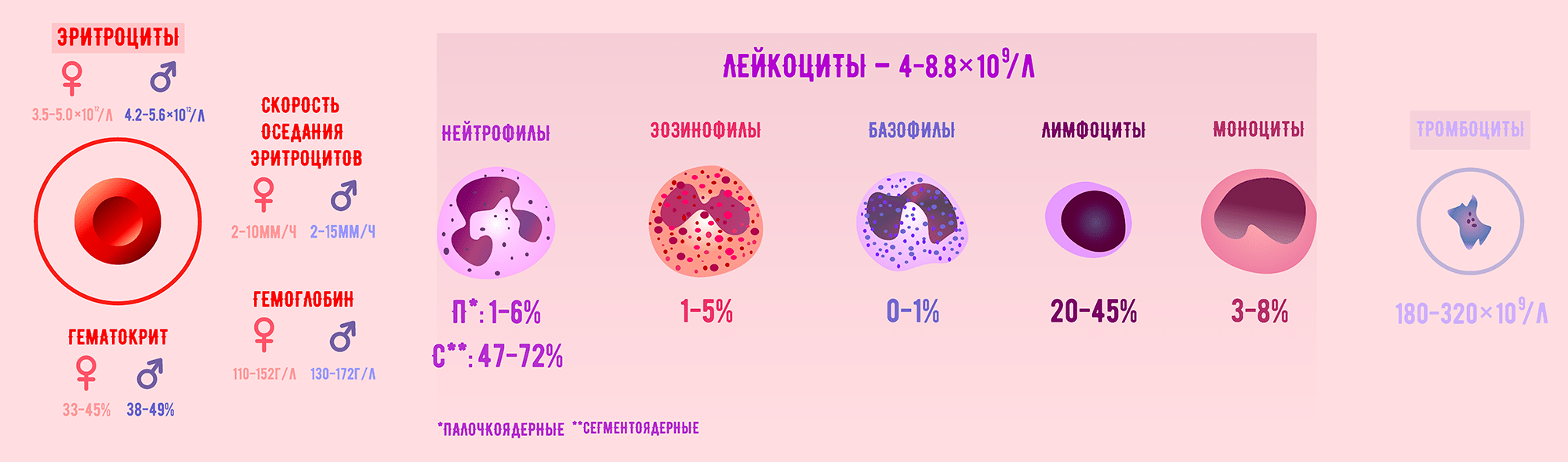
Рисунок 2. На рисунке представлены: концентрации форменных элементов крови в норме; лейкоцитарная формула — процентное соотношение разных видов лейкоцитов в крови; скорость оседания эритроцитов; концентрация гемоглобина; гематокрит в норме [4].
Итак, специалисты анализируют относительное и абсолютное содержание клеток, их морфологические характеристики, распределение по объему крови и многие другие параметры. Эти показатели могут рассказать, способны ли клетки в полной мере выполнять свои функции, а если нет, то указать на причину их «неработоспособности» и послужить основой для постановки диагноза.
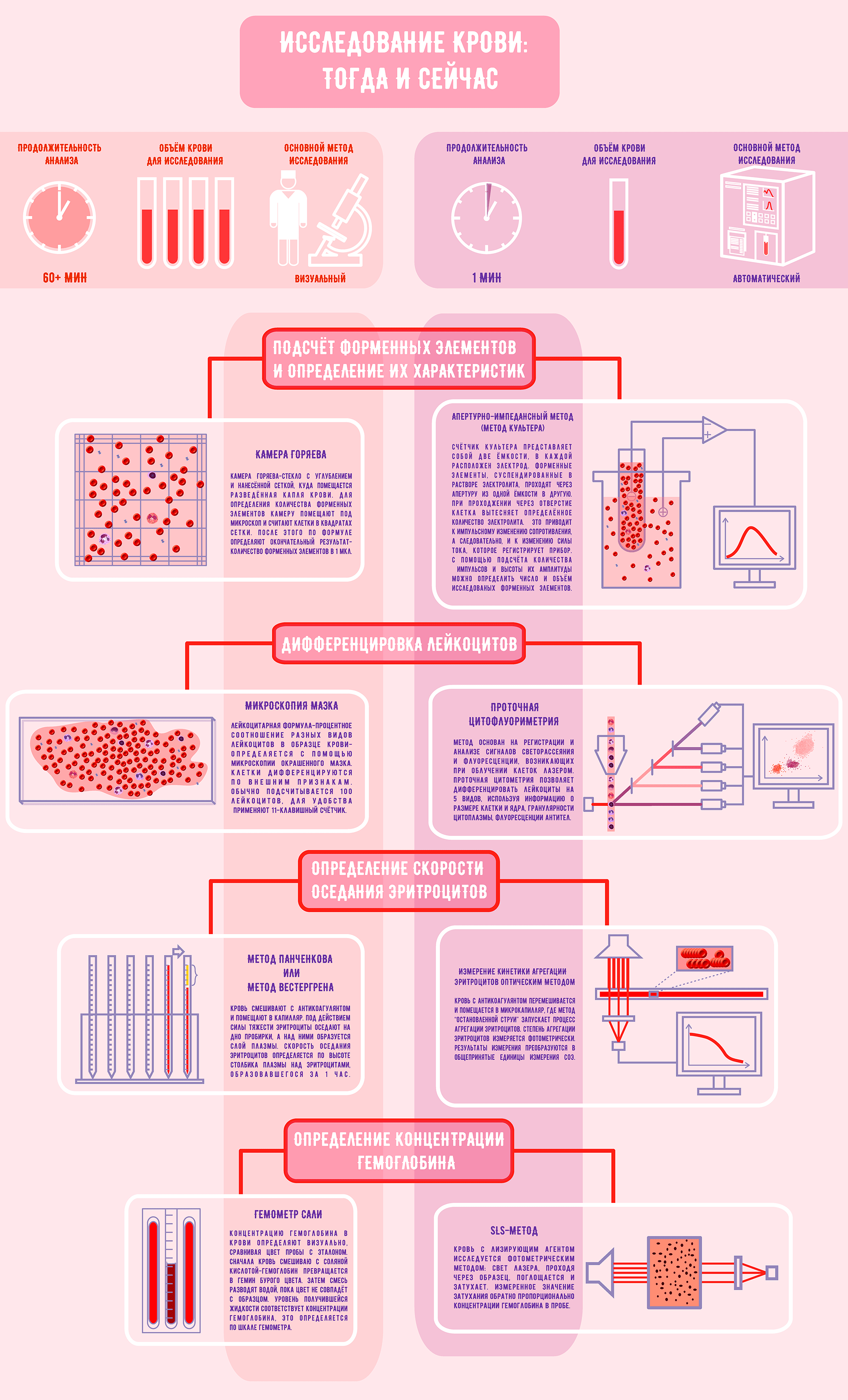
Рисунок 3. Исследование крови: тогда и сейчас
Вперед, в прошлое!
1965 год, 8 утра, в местной поликлинике очередь на анализы. Ваша бабушка сдала кровь, и лаборант относит ряд пробирок на исследование. Проследуем за ним в лабораторию и посмотрим, что там и как. В лаборатории мы видим врачей, склонившихся над микроскопами или работающих с пробирками. Без преувеличения можно сказать, что в молодости вашей бабушки глаз специалиста и микроскоп были основными инструментами для анализа крови. Определяют следующие основные характеристики крови: концентрация каждого типа форменных элементов, количество различных видов лейкоцитов, скорость оседания эритроцитов и концентрация гемоглобина. Помимо этого, специалист рассчитывает гематокрит — отношение объема эритроцитов к общему объему крови [5].
По порядку рас-счи-тайсь!
Первым делом производится подсчет клеток и определяется их концентрация в крови. Подсчет эритроцитов, лейкоцитов и тромбоцитов проводят в камере Горяева, названной в честь своего изобретателя. Камера Горяева — стекло с углублением и нанесенной сеткой, куда помещается разведенная в физрастворе капля крови. Для определения количества форменных элементов камеру помещают под микроскоп и считают клетки, находящиеся в больших и маленьких квадратах сетки. Для каждого типа клеток существуют свои правила подсчета и формула, по которой вычисляется их исходная концентрация с учетом разведения крови и количества квадратов сетки [6]. Изменение количества форменных элементов служит важным критерием для диагностики анемии, воспалительных и вирусных заболеваний, нарушений свертывающей системы крови и других патологических состояний [7].
Ты кто такой?
Другой этап исследования крови — дифференцировка лейкоцитов на популяции. Ей уделяется особое внимание: изменение концентрации определенного типа клеток говорит о конкретной патологии. Бактериальная инфекция, вирусы или аллергия? Лейкоциты подскажут, какой поставить диагноз и какое назначить лечение. Различение лейкоцитов доверяют только высококвалифицированному специалисту. Для начала мазок крови фиксируют в спирте и окрашивают по методу Романовского—Гимзы. Состав красителя подобран таким образом, что различные структуры клеток окрашиваются в разные цвета. Окраска зависит от способности компонентов красящей смеси связываться со структурами, содержащими кислоты или основания. Например, гемоглобин и гранулы эозинофилов приобретают красно-розовую окраску за счет эозина, а ядра форменных элементов и базофильные гранулы (имеющие сродство к основаниям) окрашиваются метиленовым синим и азуром в синий цвет [1]. Когда мазок готов, специалист в микроскоп исследует его и по внешнему виду определяет, к какому типу принадлежат разные клетки [8]. Наличие окрашенных гранул, особенности формы ядра, размер клетки — все параметры нужно держать в голове для безошибочной классификации. Обычно подсчитывали сто лейкоцитов с последующим вычислением процентного содержания, а для того чтобы не запутаться, использовали 11-клавишный счетчик [9]. Увидел в микроскоп клетку — нажми на клавишу с обозначением клетки данного типа, и в конце подсчета количество лейкоцитов каждого вида отобразится на экране счетчика [10].
Выпали в осадок
Еще одна характеристика, имеющая клиническое значение — скорость оседания эритроцитов (СОЭ). Это показатель, оценивающий скорость разделения крови на плазму и форменные элементы. В чем причина такого разделения? Макромолекулы, находящиеся в плазме крови, могут связывать одновременно два эритроцита друг с другом, в результате чего образуются «монетные столбики» [11]. Такие комплексы под действием силы тяжести оседают на дно пробирки, оставляя над собой слой прозрачной плазмы — это называется седиментацией эритроцитов. Увеличение скорости оседания эритроцитов указывает на патологические процессы, происходящие в организме, такие как воспалительные, инфекционные или онкологические заболевания [12].
Для определения СОЭ мировое признание получил метод Вестергрена, однако в России также был распространен метод Панченкова. Принцип работы методов одинаков, различаются только типы используемых пробирок. Кровь смешивают с антикоагулянтом — цитратом натрия — и помещают в капилляр — тонкую стеклянную трубочку. Эритроциты оседают на дно пробирки в течение часа, а затем измеряется высота столбика плазмы, образовавшегося сверху [13]. Таким образом получают скорость оседания эритроцитов, выраженную в мм/ч.
На вкус и цвет
Гемоглобин — красный пигмент эритроцитов, связывающий и переносящий кислород и углекислый газ. Снижение содержания гемоглобина в эритроцитах — причина анемий, сопутствующих целому ряду болезней. Концентрацию гемоглобина определяют визуально с помощью гемометра Сали. Прибор выглядит так: по центру — пробирка для анализируемой крови, а по бокам — окрашенные эталонные пробирки. В изучаемую кровь лаборант добавляет соляную кислоту — гемоглобин превращается в гемин бурого цвета. Затем кровь разводят дистиллированной водой, пока ее цвет (по субъективному мнению лаборанта!) не совпадет с цветом эталона. Уровень жидкости, получившийся в центральной пробирке, соответствует концентрации гемоглобина [14].
Как вы уже догадались, 50 лет назад при исследовании крови совершить ошибку было очень просто. Неверное определение вида лейкоцита или сбой при подсчете форменных элементов — все это приводило к неточным результатам анализа. Что было сделано для предотвращения ошибок? Вернемся в наше время и узнаем, как изучают кровь сегодня.
Времена меняются
Изменения видны уже на этапе забора крови: если раньше врач собирал кровь в несколько пробирок с реагентами, стеклянный капилляр и делал на стекле мазок, то сейчас используются совсем небольшие объемы — от 12 до 150 мкл [15] крови достаточно, чтобы исследовать ее по всем параметрам.
Заглянем в современную гематологическую лабораторию. Ого! Все заставлено оборудованием, и лаборанта что-то не видно. Может, отошел приготовить себе кофе? Не успеет! Анализ крови будет готов за минуту, и прибор выдаст результат в виде бумажной ленты с числами и аббревиатурами, за которыми скрываются всевозможные параметры.
Современные гемоанализаторы подразделяются на несколько классов, в зависимости от того, что они умеют делать. Каждый последующий класс — новая ступень эволюции — быстрее, точнее, совершеннее. Использование комбинации технологий творит чудеса: если первые анализаторы могли определять восемь параметров крови и не различали виды лейкоцитов [16], то новейшие приборы способны дифференцировать до семи популяций лейкоцитов [17] и в общей сложности исследовать более 40 характеристик крови.
Как сказал Артур Кларк: «Любая достаточно развитая технология неотличима от магии». И действительно, подробнейший результат за столь короткий срок не может не удивлять. Но вся магия основана на физических законах. И хотя такие названия, как электрический импеданс, светорассеяние и фотометрия на первый взгляд немного пугают, сейчас мы разберемся, какие принципы лежат в основе каждой технологии анализа.
Перепись населения
В середине прошлого века Уоллес Культер совершил революцию, запатентовав технологию автоматического подсчета клеток. Его именем назван один из лидеров в сфере производства гематологических анализаторов — компания Beckman Coulter [18]. Апертурно-импедансный метод (или метод Культера) основан на регистрации и анализе импульсов, возникающих при прохождении клетки через апертуру из одной емкости в другую, в каждой из которых находится электрод. Когда клетки в отверстии нет, через электролит между электродами свободно протекает ток под действием электрического поля. Чтобы направить клетки к апертуре, используют насос, откачивающий жидкость из одной емкости, в нее и устремляются форменные элементы. Проходя через апертуру, клетка вытесняет из одной емкости в другую объем электролита, равный своему объему. При этом возникает импульсное изменение сопротивление (импеданса) — мембрана клеток создает препятствие для свободного протекания тока. Одновременно меняется и сила тока, которую регистрирует счетчик. Число возникших импульсов соответствует количеству форменных элементов, а высота импульса пропорциональна объему клетки [19]. Используя информацию о количестве и объеме форменных элементов, прибор может рассчитать гематокрит, среднюю концентрацию гемоглобина в эритроците, ширину распределения клеток по объему и многие другие параметры [15].
Разделяй и властвуй
Дифференцировку лейкоцитов на популяции можно провести с помощью счетчика Культера, однако возникает проблема — различные виды лейкоцитов близки по объему и схожая амплитуда импульсов не всегда позволяет точно установить тип клетки. Как быть? Для решения этой загвоздки подбирают сочетания реагентов, которые изменяют размеры клеток в разной степени так, что становится возможным их разделить [15].
Но наиболее распространенный способ дифференцировки — проточная цитофлуометрия [20]. Метод работает следующим образом: клетки, находящиеся в потоке, поочередно облучаются лазером, а возникающие при этом сигналы светорассеяния и флуоресценции регистрируются детекторами и анализируются. Для того чтобы правильно определить принадлежность к популяции, исследуют сразу несколько параметров. Так, рассеяние света под малым углом дает информацию об относительном размере клеток, а рассеяние света под прямым углом позволяет «заглянуть» внутрь клетки и изучить ее внутреннюю структуру — наличие гранул и форму ядра. Еще один параметр — флуоресценция — способен рассказать о количестве антигенов и их виде на поверхности клеток — такое точно не определить на глаз. В отличие от ручных методов дифференцировки, анализируются не 100–200 клеток, а десятки тысяч в секунду! И к каждому лейкоциту индивидуальный подход: гидродинамическая фокусировка способствует тому, чтобы клетки выстраивались в ряд и облучались в проточной ячейке поодиночке. Результат подсчета появляется на экране в виде диаграмм рассеивания, где клетки со схожими свойствами формируют кластеры.
Выпали в осадок: 2.0
Современные приборы умеют измерять СОЭ двумя принципиально различными способами. Первый — модифицированный метод Вестергрена. Принцип работы не изменился со времен вашей бабушки, но за счет автоматизации стал более быстрым и точным. Второй — измерение кинетики агрегации эритроцитов оптическим методом [21]. Происходит это так: в кровь добавляется антикоагулянт, пробирки с кровью помещаются в ротор, где происходит автоматическое перемешивание. После этого анализатор отбирает часть крови в микрокапилляр, где она ускоряется и резко останавливается (так называемый метод «остановленной струи»). Остановка вызывает агрегацию эритроцитов, и в этот момент с помощью фотометра определяется оптическая плотность крови — чем плотнее будут расположены эритроциты, тем меньше света пройдет через пробу. Прибор использует полученные данные и строит кривую седиментации — ее анализ позволит представить результат в привычных единицах измерения СОЭ [22], [23].
Фото на память
Для определения концентрации гемоглобина Международный комитет по стандартизации в гематологии рекомендует метгемоглобин-цианидный метод. Однако сейчас повсеместно применяется иное исследование, не использующее токсичный цианид. Знакомьтесь, SLS-метод. Назван он по основному реагенту — лауритилсульфату натрия. SLS разрушает мембраны эритроцитов, после чего связывается с группами гема и образует стабильные комплексные соединения. Они анализируется фотометрически — через пробу крови пропускают свет лазера. Комплексные соединения поглощают часть света, в результате этого интенсивность выходящего светового потока ослабевает. Затухание измеряют с помощью фотодатчика и полученные данные преобразуют в единицы концентрации гемоглобина [24].
Это не предел
Итак, в процессе нашего экскурса мы посмотрели, как осуществлялся анализ крови во времена наших бабушек и как это делается сегодня. Выяснили, что в настоящее время благодаря переходу на автоматические методы существенно повысилась скорость получения результатов, а главное, их точность! Следует отметить, что современная аппаратная диагностика позволяет решить значительно больше задач, чем это было возможно пару поколений назад, но и это — тоже не предел!