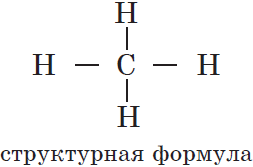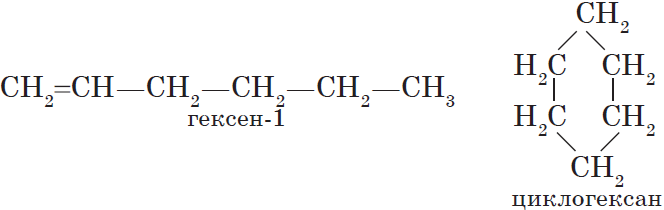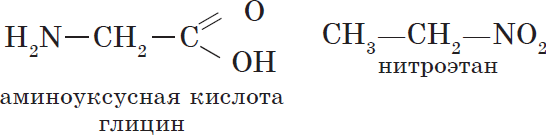Что бутлеров назвал строением химического соединения
Теория строения органических соединений. Типы связей в молекулах органических веществ
Теория к заданию 12 из ЕГЭ по химии
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Основные положения теории А. М. Бутлерова
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
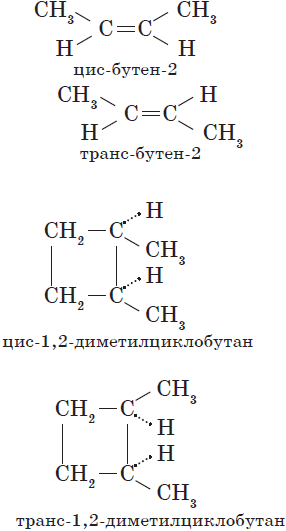
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
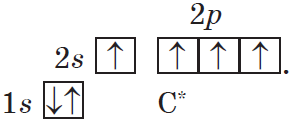
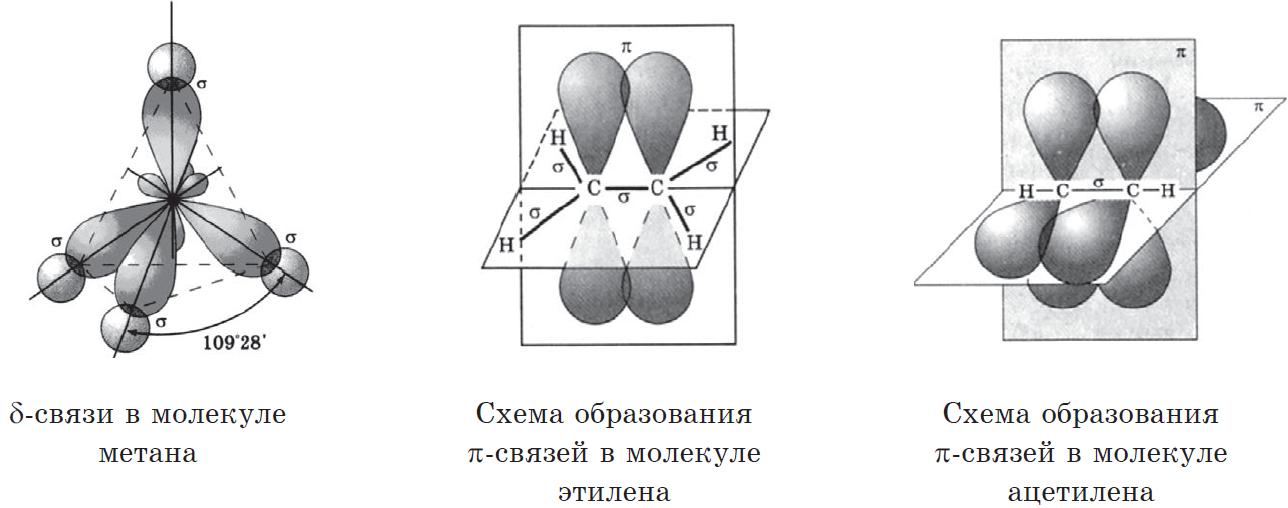
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5’$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (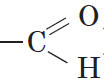
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
Что бутлеров назвал строением химического соединения
Другим значимым аспектом теории А. М. Бутлерова стало утверждение, что химическое строение веществ можно установить опытным путём химическими методами и отразить в формуле.
отражены в следующем:
1. Атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентности.
2. Свойства веществ зависят от вида и количества атомов, входящих в состав молекулы, а также от химического строения. Химическое строение определяет взаимное влияние атомов в молекуле.
3. Химическое строение молекулы может быть установлено в результате изучения свойств вещества.
Структуры органических соединений отображаются химическими формулами, в которых показан порядок соединения атомов в молекулах. Такие формулы называют формулами химического строения или структурными формулами.
Структурные формулы отображают только последовательность соединения атомов, но не расположение их в пространстве.
Каждая структурная формула отображает строение одной и той же молекулы пропана, т. к. последовательность соединения атомов в данном случае не изменяется.
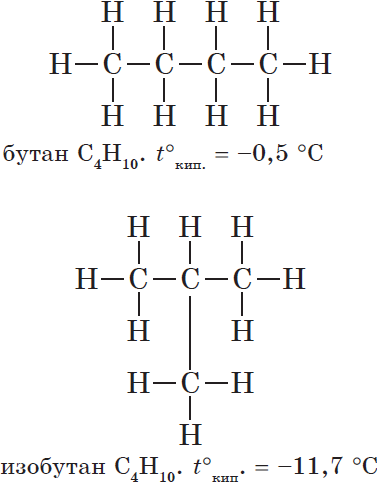
Структурные формулы веществ обычно изображают в сокращённом виде `»CH»_3-«CH»_2-«CH»_3`. В сокращённых формулах чёрточки показывают связь атомов углерода друг с другом, но не показывают связи между атомами углерода и водорода. Начиная с бутана возможен различный порядок соединения атомов при одном и том же составе молекулы, т. е. в бутане атомы углерода могут располагаться в виде линейной и разветвлённой цепей.
`»C»-«C»-«C»-«C»`
В первом случае каждый атом углерода соединён с одним (если он концевой) или с двумя (если он находится внутри цепи) соседними атомами углерода; во втором случае – появляется атом углерода, соединённый с тремя соседними атомами углерода. Различному порядку связывания атомов при одном и том же качественном и количественном составе молекулы должны соответствовать разные вещества.
Бутан линейного строения и изобутан различаются температурами кипения.
| `»CH»_3-«CH»_2-«CH»_2-«CH»_3` | |
| бутан (т. кип. `-0,5^@»C»`) | изобутан (т. кип. `-11,7^@»C»`) |
называют вещества, которые имеют одинаковый состав молекулы, но различное химическое строение.
С увеличением числа атомов углерода в молекуле число возможных изомеров резко возрастает. Различия в химическом строении являются причиной проявления изомерами различных физико-химических свойств.
Теория А. М. Бутлерова завоевала признание. Значение теории химического строения А. М. Бутлерова можно сравнить с Периодическим законом и Периодической системой химических элементов Д. И. Менделеева.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь:
Теория строения А.М. Бутлерова
Понятие химической структуры
Химическая структура молекулы представляет собой наиболее характерную и уникальную ее сторону, поскольку она определяет ее общие свойства (механические, физические, химические и биохимические). Любое изменение в химической структуре молекулы влечет за собой изменение ее свойств. В случае незначительных структурных изменений, внесенных в одну молекулу, следуют небольшие изменения ее свойств (обычно затрагивает физические свойства), если же молекула испытала глубокие структурные изменения, то и ее свойства (особенно химические) будут глубоко изменены.
Например, Альфа-аминопропионовая кислота (Альфа-аланин) имеет следующую структуру:
Альфа-аланин
Все эти конструктивные особенности определяют целый ряд свойств Альфа-аланина, таких как: твердое агрегатное состояние, температура кипения 295° С, растворимость в воде, оптическая активность, химические свойства аминокислот и т. д.
При наличии связи аминогруппы с другим атомом углерода (т.е. произошло незначительное структурное изменение), что соответствует бета-аланину:
Бета-аланин
Общие химические свойства по-прежнему остаются характерными для аминокислот, но температура кипения составляет уже 200° C и отсутствует оптическая активность.
Если же, например, два атомы в этой молекуле соединены атомом N в следующем порядке (глубокое структурное изменение):
1- нитропропан
тогда образованное вещество — 1-нитропропан по своим физическим и химическим свойствам совершенно не похож на аминокислоты: 1-нитро-пропан — это желтая жидкость, с температурой кипения 131°С, нерастворим в воде.
Таким образом, взаимосвязь «структура-свойства» позволяет описывать общие свойства вещества с известной структурой и, наоборот, позволяет найти химическую структуру вещества, зная его общие свойства.
Общие принципы теории строения органических соединений
В сущности определения структуры органического соединения, лежат следующие принципы, которые вытекают из связи между их структурой и свойствами:
а) органические вещества, в аналитически чистом состоянии, имеют один и тот же состав, независимо от способа их получения;
б) органические вещества, в аналитически чистом состоянии, обладает постоянными физико-химическими свойствами;
в) органические вещества с постоянным составом и свойствами, имеет только одну уникальную структуру.
В 1861 г. великий русский ученый А. М. Бутлеров в своей статье «О химическом строении вещества» раскрыл основную идею теории химического строения, заключающуюся во влиянии способа связи атомов в органическом веществе на его свойства. Он обобщил все имеющиеся к тому времени знания и представления о строении химических соединений в теории строения органических соединений.
Основные положения теории А. М. Бутлерова
кратко могут быть изложены следующим образом:
Ученик А.М. Бутлерова — В. В. Марковников продолжил изучение вопроса взаимного влияния атомов, что нашло свое отражение в 1869 году в его диссертационной работе «Материалы по вопросу о взаимном влиянии атомов в химических соединениях».
Заслуга А.М. Бутлерова и значение теории химического строения исключительно велико ля химического синтеза. Открылась возможность предсказать основные свойства органических соединений, предвидеть пути их синтеза. Благодаря теории химического строения химики впервые оценили молекулу как упорядоченную систему со строгим порядком связи между атомами. И в настоящее время основные положения теории Бутлерова, несмотря на изменения и уточнения, лежат в основе современных теоретических представлений органической химии.
Теория А. М. Бутлерова
Содержание:
Теория химического строения — комплекс тезисов о строении молекул, их характеристик и поведения. Ее создателем является химик Александр Михайлович Бутлеров. С помощью теории описываются валентные состояния и природа атомов, их местоположение в пространстве, распределение плотности электронов и особенности электронной поляризуемости.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Органическая химия
При знакомстве с соединениями углерода обращает на себя внимание большое их разнообразие и практически неограниченные возможности увеличения их числа.
Соединения углерода рассматриваются как самостоятельный раздел химии — органическая химия.
Деление химии на неорганическую и органическую сложилось исторически. С давних пор принято было считать, что органическая химия изучает вещества живой природы — вещества, получаемые из организмов. К началу XIX в. сложились представления, что вещества органического происхождения и их превращения управляются особой силой — жизненной силой (Берцелиус). 1828 г. принес первый факт, подрывающий основы учения о жизненной силе, — Велер синтезировал мочевину — один из продуктов, вырабатываемых организмом. Вслед за этим последовал синтез целого ряда органических соединений, среди которых были жиры (Бертло, 1854 г.) и углеводы (А. М. Бутлеров, 1861 г.).
Стало очевидным, что органические соединения, так же, как и неорганические, могут быть получены искусственным путем без вмешательства таинственной жизненной силы.
В органической химии восторжествовали материалистические представления. Постепенно стал расширяться круг соединений, получаемых в лаборатории.
Теория А. М. Бутлерова о строении органических соединений
В конце пятидесятых годов прошлого столетия органическая химия накопила огромный фактический материал, который не был и достаточной мере систематизирован. Ряд особенностей органических соединений не находил объяснения на основе существовавших в то время представлений.
Так, не находило теоретического объяснения открытое в двадцатых годах XIX столетия явление изомерии. Оно оказалось очень распространенным в органической химии и заключается в существовании веществ, обладающих при одинаковом составе и молекулярном весе различными свойствами. Оставался открытым и вопрос о строении органических соединений. Для создания теории строения органических соединений важное значение имело установление в 1857 г. Кекуле и, независимо от него, Купером и Кольбе четырехвалентности углерода и способности атомов углерода соединяться друг с другом с образованием цепей. При разработке теории строения органических соединений главным оставался вопрос о возможности установления строения молекулы органического соединения. Большинство химиков середины XIX столетия отрицало возможность познания структуры молекулы. Убежденным противником таких представлений о непознаваемости молекул был А. М. Бутлеров, которому и принадлежит честь создания теории химического строения органических соединений (1861 г.).
Бутлеров считал, что каждое вещество имеет определенное химическое строение, которое может быть установлено на основании изучения химических свойств этого вещества.
Под химическим строением А. М. Бутлеров понимал не только качественный и количественный состав молекулы данного вещества, но и последовательный порядок соединения атомов в молекуле и их взаимное влияние.
Атомы в молекуле испытывают взаимное влияние, не только находясь в непосредственной связи, но и будучи не связаны между собой непосредственно.
Бутлеров показал, что для установления химического строения вещества большое значение наряду с анализом имеет синтез его из простейших веществ, строение которых известно.
Теория химического строения, созданная А. М. Бутлеровым, заложила прочный фундамент органической химии. Она позволила научно систематизировать огромный фактический материал, объяснила важнейшие закономерности и определила дальнейшие пути развития органической химии.
Классификация органических соединений
Теория строения создала научные основы для классификации органических соединений.
В настоящее время органические соединения классифицируются как по строению углеродной цепи, так и по функциональным группам.
В соответствии со строением углеродной цепи все органические соединения подразделяются следующим образом.
I. Ациклические соединения, называемые также алифатическими, или соединениями жирного ряда. К этой группе относятся органические соединения с так называемой «открытой цепью» углеродных атомов. Среди них различаются насыщенные, или предельные, и ненасыщенные, или непредельные. Предельные соединения содержат только простые (одинарные) углеродные связи, Например:
Непредельные соединения содержат наряду с простыми и кратные — двойные или тройные — связи между атомами углерода
II. Циклические, или карбоциклические, соединения, содержащие в молекуле кольца, или циклы, состоящие из одних углеродных атомов.
Среди этих соединений различают алифатические циклические или сокращенно алициклические и ароматические:
а) алициклические соединения содержат циклы, состоящие из углеродных атомов, соединенных между собой простыми или кратными связями, например:
б) ароматические соединения содержат шестичленные углеродные циклы, в которых имеется сопряженная система чередующихся простых и двойных связей между углеродными атомами, например:
III. Гетероциклические соединения, содержащие циклы, в составе которых, наряду с углеродными, входят атомы и других элементов, например:
Органические соединения в зависимости от состава подразделяются на классы:
К этому классу относятся соединения, состоящие только из углерода и водорода, например:
2. Галогенопроизводные углеводородов.
Содержат, наряду с углеродом и водородом, атомы галогенов (F, Cl, Br, I). Эти соединения являются производными углеводородов, в которых один или несколько атомов водорода замещены галогеном, например:
3. Кислородсодержащие соединения:
а) спирты, производные углеводородов, содержащие одну или несколько гидроксильных групп ОН
б) эфиры, кислородсодержащие соединения, характеризующиеся наличием в углеродной цепи группировки С—О—С, например:
в) альдегиды и кетоны характеризуются наличием в соединении
группы 
У кетонов карбонильная группа располагается между углеводородными радикалами, например:
г) органические кислоты характеризуются наличием в соединении карбоксильной группы 
4. Азотсодержащие соединения:
а) нитросоединения — характеризуются наличием группы NO2, например:
б) Амины. Эти соединения могут быть рассмотрены как производные аммиака, в котором один, два или три атома водорода замещены углеводородными радикалами, например:
Вот далеко не полный перечень основных классов органических соединений.
Прежде чем переходить к описанию различных классов органических соединений, необходимо хотя бы кратко остановиться ни электронных представлениях о природе химической связи в органических соединениях.
В молекулах большинства органических соединений атомы связаны между собой ковалентной связью. Как уже указывалось, для ковалентной связи характерно наличие общей электронной пары между атомами. Такая связь возникает между атомами, характеризующимися примерно одинаковым отношением к электрону.
Если атом обозначить символом данного элемента, а точками вокруг него — электроны, находящиеся в наружном электронном слое атома в нормальном состоянии, то формулы молекул метана и этана примут следующий вид:
Связь между атомами углерода в этане не поляризована, что объясняется одинаковым отношением к электрону обоих атомов. Связь между углеродом и водородом оказывается слабо поляризованной, так как связующая пара электронов смещена к атому углерода. Это объясняется несколько большим притяжением электрона к атому углерода, чем к атому водорода.
связь углерода с хлором также поляризована, но вследствие большего притяжения электрона к атому хлора, чем к атому углерода, связующая пара электронов смешена от углерода к хлору
Многие органические соединения малополярны (например, углеводороды несимметричного строения). Эти вещества характеризуются малой плотностью, низкими температурами кипения и плавления этих соединений.
Углеводороды
Предельные углеводороды (парафины)
По мере роста углеродной цепи происходит увеличение молекулы каждого последующего члена ряда предельных углеводородов по сравнению с предыдущим на метиленовую группу —СН2:
Нетрудно заметить, что состав предельных углеводородов подчиняется определенной закономерности, выраженной следующей общей формулой 
Органические соединения одного и того же класса, характеризующиеся общей для всех членов формулой, и разностью — СН2 — между каждым последующим и предыдущим членами, называются гомологическим рядом, а разность — СН2 — гомологической разностью.
Начиная с четвертого члена ряда предельных углеводородов, наблюдается изомерия.
Явление изомерии состоит в существовании соединений, обладающих при одинаковом составе и молекулярном весе различными свойствами Такие соединения получили название изомеров.
Изомерия, наблюдаемая в ряду предельных углеводородов, вызвана различным строением углеродной цепи. Например;
По мере увеличения числа углеродных атомов возрастает и число изомеров. Так, формуле 






Изомерия, таким образом, является одним из факторов, обусловливающих многообразие органических соединений.
Одновалентные углеводородные радикалы, сохраняя в названии корни соответствующих углеводородов принимают окончание «ил»: 



Радикал — группировка атомов, содержащая один или несколько неспаренных электронов.
Например, если в метане
одна из общих электронных пар между углеродом и водородом разделяется таким образом, что образуется остаток — 
Числом неспаренных электронов определяется валентность радикала.
При составлении наименования углеводорода разветвленного строения сначала дается название радикалов, соединенных с главной цепью, вместе с цифрами, указывающими, с каким углеродным атомом главной цепи он связан, а затем название углеводорода, составляющего главную цепь. Так, углеводороды строения
по научной номенклатуре называются соответственно 2-метилпентан и 3-метилпентан. 2-Метилпентан и 3-метилпентан являются изомерами. Изомерия в данном случае вызвана различным положением радикала при одной и той же цепи и называется изомерией положения.
называются соответственно: 2,3-диметилбутан и 2,3,3-триметилпентан. Приставки ди— и три-, образуемые из корней греческих числительных, указывают на число одинаковых радикалов.
Физические свойства предельных углеводородов закономерно изменяются с увеличением молекулы. Первые четыре углеводорода этого ряда — бесцветные газообразные вещества без характерного запаха. Углеводороды нормального строения состава 

В химическом отношении предельные углеводороды являются чрезвычайно устойчивыми. Кислород и сильные окислители при низких температурах не окисляют предельные углеводороды. При сгорании углеводородов образуются
Предельные углеводороды не способны к реакциям присоединения и с трудом вступают в реакцию замещения атомов водорода на другие одновалентные группы.
Из реакций замещения особое значение имеет галогенирование предельных углеводородов, т. е. замещение в их молекулах атомов водорода на атомы галогена (F, Cl, Br, I).
Так, при действии хлора на свету на этан происходит образование хлорэтана:
При этом может происходить замещение и остальных атомов водорода на хлор:
Возможность замещения атомов водорода в предельных углеводородах на атомы галогена позволяет осуществить цепь взаимных превращений предельных углеводородов в непредельные, в спирты и другие классы органических соединений, что будет рассмотрено при разборе соответствующих соединений.
Из других превращений предельных углеводородов следует отметить открытую М. И. Коноваловым (1889 г.) реакцию нитрования, состоящую в замещении одного из атомов водорода на нитрогруппу и выделении воды.
Алициклические предельные углеводороды
Алициклические (предельные) углеводороды содержат в своем составе циклы, состоящие из углеродных атомов, соединенных между собой простыми связями:
Название циклических углеводородов складывается из названия углеводородов нормального строения, лежащего в основе цикла, с добавлением приставки цикло.
Если циклический углеводород содержит боковые группы, то к его названию добавляют наименование радикала, а при необходимости, и цифру, указывающую, с каким именно углеродным атомом цикла связан радикал.
Сопоставление метилциклопропана с циклобутаном показывает, что изомерия в указанном ряду углеводородов может вызываться различным строением циклов (изомерия циклив).
По химическим свойствам высшие циклопарафины напоминают предельные углеводороды с открытой цепью. Для алициклических насыщенных углеводородов, начиная с циклопентана, характерными являются реакции замещения
Низшие циклопарафины, заключающие в своем составе трех-или четырехчленные циклы, вступают в реакции, идущие с разрывом цикла:
В настоящее время существует много способов превращения соединений с открытой цепью в циклические соединения. Так, при действии металлов на дигалогенопроизводные с отдаленными друг от друга атомами галогена получаются циклические углеводороды:
Если учесть, что галогенопроизводные углеводородов могут быть получены из соответствующих предельных углеводородов, то очевидной становится возможность осуществления взаимных переходов углеводородов с открытой цепью в углеводороды циклического строения.
Непредельные углеводороды
Непредельные углеводороды характеризуются меньшим содержанием атомов водорода по сравнению с соответствующими предельными. Чем меньше содержит углеводород атомов водорода, по сравнению с предельными, тем больше степень его непредельности.
Первый гомологический ряд непредельных углеводородов может быть произведен от соответствующих предельных путем отнятия двух атомов водорода. Общая формула этого ряда 

и широко известен под названием этилен. Этилен — родоначальник гомологического ряда — углеводородов ряда этилена.
Для всех членов гомологического ряда этилена характерно наличие одной двойной связи в молекуле:
По женевской номенклатуре название углеводорода ряда этилена сохраняет корень названия соответствующего предельного углеводорода и принимает окончание «ен».
При этом, начиная с четвертого углеводорода этого ряда появляется новый вид изомерии — изомерия по положению двойной связи. В названии углеводорода положение двойной связи в цепи ‘обозначается цифрой, стоящей за окончанием «ен» и указывающей, от какого углеродного атома в цепи исходит двойная связь.
Формулы углеводородов еще более непредельных, чем этиленовые, могут быть выведены из формул соответствующих предельных углеводородов путем отнятия от последних четырех атомов водорода. Общая формула углеводородов этого ряда
По женевской номенклатуре, название углеводорода ряда ацетилена сохраняет корень названия соответствующего предельного углеводорода и принимает окончание «ин».
В тех случаях, когда это необходимо, вслед за окончанием ставится цифра, указывающая положение тройной связи в цепи
Физические свойства углеводородов ряда этилена и ацетилена изменяются так же, как и предельных углеводородов, с возрастанием молекулярного веса.
Так, первые четыре представителя обоих рядов — газы, углеводороды состава 


Непредельные углеводороды чрезвычайно активны в химическом отношении. Для них характерными являются реакции присоединения, сопровождающиеся разрывом кратной (двойной или тройной) связи. Присоединяя водород, непредельные углеводороды переходят в соответствующие предельные. Образование этана из этилена (этена) происходит по следующей схеме:
Эта реакция осуществляется при 150—200° С в присутствии мелкораздробленного никеля как катализатора. Еще легче происходит присоединение к этилену галогенов.
Так, при взаимодействии этилена с бромом
образуется 1,2-дибромэтан. При этом происходит обесцвечивание раствора брома. Этой реакцией часто пользуются как качественной реакцией на двойную связь.
Также легко присоединяются по двойной связи и галогеноводороды
В определенных условиях непредельные соединения присоединяют элементы воды, превращаясь при этом в соответствующие спирты. Ниже показано образование этилового спирта из этилена:
Эта реакция протекает под влиянием таких катализаторов, как серная кислота, хлористый цинк. Получение этилового спирта имеет большое народнохозяйственное значение и позволяет заменить пищевое сырье синтетическим.
Реакции присоединения с углеводородами ряда ацетилена протекают в две стадии: сначала образуются производные ряда этилена, а затем предельные соединения:
Присоединение водорода к ацетилену и его гомологам происходит только в присутствии катализатора (например, никеля) и при нагревании.
Очень активно взаимодействует ацетилен с галогенами.
Продукты взаимодействия ацетилена с галогенами нашли широкое применение как растворители жиров.
В присутствии катализатора углеводороды ряда ацетилена присоединяют галогеноводороды:
К полученному хлористому винилу (хлорэтен) можно присоединить еще одну молекулу галогеноводорода:
Радикал 
При этом присоединение галогеноводорода по месту разрыва (двойной или тройной) связи происходит таким образом, что водород направляется к тому углероду, у которого водорода больше (правило Марковникова)
В 1881 г. Кучеровым была открыта реакция присоединения к ацетилену молекулы воды (катализатором этой реакции являются соли двухвалентной ртути):
Образующийся непредельный спирт, содержащий гидроксильную группу при двойной связи, является неустойчивым и претерпевает перегруппировку (изомеризацию) в альдегид:
Реакция Кучерова открыла путь синтетического получения этилового спирта и уксусной кислоты из уксусного альдегида
Сам ацетилен получается в промышленности при взаимодействии карбида кальция с водой
Кроме указанных областей применения, ацетилен широко используется для автогенной сварки металлов, так как при горении ацетилена в смеси с кислородом развивается температура выше 3000° С. Ацетилен находит широкое применение в качестве исходного сырья для многочисленных синтезов, из которых наиболее важное значение имеет производство синтетического каучука, пластических масс, этилового спирта, уксусной кислоты и др.
Чрезвычайно важной для характеристики непредельных соединений является их способность к реакциям полимеризации, приводящим к получению высокомолекулярных соединений — полимеров. Процесс полимеризации заключается в соединении большого числа (5000—10 000) молекул исходного продукта между собой за счет разрыва кратных связей.
Так, при определенных условиях (повышенное давление, нагревание, катализатор) можно вызвать полимеризацию этилена:
Реакцию полимеризации удобнее записывать следующим образом:
Число п, показывающее, сколько молекул исходного продукта соединялось в макромолекулу полимера, называется степенью полимеризации; п может достигать значений 5000—10 000.
Исходные соединения для получения полимеров называются мономерами.
Замечательные свойства высокомолекулярных соединений, число которых постоянно увеличивается, определяют ведущее положение полимеров среди материалов современности. Низкая плотность, которой характеризуются органические полимеры, в сочетании с высокой механической прочностью делают эти материалы незаменимыми в самых разнообразных областях науки и техники. Большинство полимеров характеризуется высокими диэлектрическими показателями, что обеспечивает их широкое применение в электротехнике и радиотехнике.
Ароматические углеводороды
Ароматические углеводороды характеризуются наличием в их составе шестичленных циклов, состоящих из атомов углерода, соединенных между собой чередующимися двойными и простыми связями.
Строение простейшего углеводорода этого ряда — бензола — обычно изображают следующей формулой, предложенной впервые Кекуле в 1865 г.
Гомологи бензола могут быть произведены из бензола замещением в нем одного или большего числа атомов водорода углеводородными радикалами.
Для производных бензола, содержащих два боковых радикала, наблюдается изомерия по положению радикалов в бензольном кольце. Так, существует три изомера диметилбензола. Углеводород, содержащий два боковых радикала при соседних углеродных атомах, называется орто-изомером. Например, 1,2-диметилбензол, широко известный под названием ортоксилола
Углеводород, содержащий два боковых радикала у углеродных атомов бензольного кольца, отдаленных друг от друга одним углеродным атомом, называется мета-изомером. Например, 1,3-диметилбензол, широко известный под названием метаксилола.
Наконец, положению боковых радикалов у первого и четвертого углеродных атомов бензольного кольца соответствует пара-изомер. Например:
1, 4диметилбензол, или м-ксилол
Основным источником получения ароматических углеводородов является каменноугольная смола (продукт сухой перегонки каменного угля) и нефть.
В химическом отношении ароматические углеводороды весьма своеобразны, что проявляется в высокой устойчивости этих соединений к окислению, склонности их к реакциям замещении при малой активности в реакциях присоединения. «Ароматический характер» обусловлен особенностями строения этих углеводородов, а именно наличием в них системы чередующихся двойных и простых связей (сопряженной системы), стабилизирующих их молекулы.
Так, при взаимодействии бензола с хлором в присутствии катализатора легко происходит замещение атома водорода в бензоле хлором
При обработке бензола концентрированной азотной кислотой образуется нитробензол, который может быть рассмотрен как продукт замещения атома водорода в бензоле нитро-группой — NO2
В определенных условиях ароматические углеводороды вступают в реакции присоединения. Так, в присутствии мелкораздробленного палладия при повышенной температуре бензол присоединяет шесть атомов водорода и переходит в циклогексан
Ароматические углеводороды нашли широкое применение в народном хозяйстве. Они являются исходными веществами в синтезе красителей, лекарственных препаратов, взрывчатых веществ и др.
Нефть и основные продукты её переработки
Основу нефти составляют углеводороды (свыше 90%) различного строения. В небольшом количестве содержатся в ней кислородсодержащие производные углеводородов, главным образом кислоты, азотистые и сернистые соединения. Последние сообщают нефти неприятный запах. В зависимости от месторождения состав углеводородов нефти различен.
В уральской нефти преобладают ароматические углеводороды. Бакинская и эмбенская нефти содержат, главным образом, алициклические углеводороды. Майкопская нефть содержит приблизительно равные количества предельных алициклических, ациклических и ароматических углеводородов. В американской (Пенсильвания) нефти преобладают предельные углеводороды.
Для получения технически ценных продуктов нефть подвергают дробной перегонке, собирая отдельные фракции, кипящие в определенных интервалах температуры. С помощью такой дробной пере гонки (фракционирования) удается разделить нефть па более про стые по составу смеси углеводородов.
Первая фракция нефти, отбираемая в интервале температур 40º — 150° С, так называемый бензин, содержит, главным образом углеводороды с длиной цепи С5—С6.
Бензин находит широкое применение как топливо для двигателей внутреннего сгорания, в качестве растворителей и др.
В интервале температур 150 — 300º отгоняется керасин, содержащий углеводороды состава С 9 — С 15.
Из мазута посредством перегонки с водяным паром получается вазелин. Из некоторых сортов нефти выделяют парафин. Перегоняющийся остаток мазута — гудрон — используют для асфальтирования дорог.
Для повышения выхода бензина из нефти, последнюю подвергают крекингу (расщеплению). С этой целью нефть или её высококипящие погоны нагревают до 500—700° С без доступа воздуха под давлением 7—30 атм. При этом высшие углеводороды расщепляются на углеводороды с меньшим молекулярным весом, кипящие в интервале температур бензиновой фракции. Этим путем удаётся вдвое повысить выход бензина из нефти.
Спирты
Спиртами называются органические соединения, содержащие функциональную гидроксильную группу ОН. Спирты могут быть рассмотрены как производные углеводородов, в которых один или несколько атомов водорода замещены гидроксильными группами. По числу гидроксильных групп спирты подразделяют на одноатомные, двухатомные и т. д. Наибольшее практическое значение приобрели в настоящее время предельные спирты, являющиеся производными предельных углеводородов. Одноатомные предельные спирты характеризуются общей формулой
Названия спиртов по женевской номенклатуре складываются из названий соответствующих углеводородов с добавлением окончания «ол».
Спирт 

Для спиртов характерна изомерия как по строению углеводородного радикала, так и по положению гидроксильной группы. Так, от пропана можно произвести два изомерных спирта, соответственно замещая гидроксильной группой атом водорода первого углеводородного атома и второго
В названии изомерных спиртов цифрой, следующей за окончанием «ол», обозначают положение гидроксильной группы в цепи.
Физические свойства спиртов, так же как и углеводородов, зависят от молекулярного веса. Первые представители спиртов — жидкости, а начиная с 
Являясь производными углеводородов, спирты обладают всеми химическими свойствами, характерными для соответствующих углеводородов. Вместе с тем наличие гидроксильной группы в спиртах определяет их индивидуальные химические свойства.
Характерной для спиртов является реакция взаимодействия с металлическими натрием и калием
При этом образуются так называемые алкоголяты. Спирты взаимодействуют с галогеноводородами
с образованием соответствующих галогенопроизводных углеводородов. Эта реакция является обратимой и, в зависимости от условий, позволяет получать либо спирты из галогенопроизводных углеводородов, либо галогенопроизводные углеводородов из спиртов.
При нагревании и в присутствии водоотнимающих средств спирты претерпевают либо внутри- либо межмолекулярное отщепление воды. В первом случае образуются углеводороды ряда этилена:
Во втором — простые эфиры:
Спирты легко окисляются.
В зависимости от строения исходного спирта получаются различные продукты окисления. При окислении этилового спирта в мягких условиях образуется уксусный альдегид
Наиболее широкое применение в настоящее время находит этиловый спирт. Этиловый спирт — легкоподвижная бесцветная жид кость с плотностью 0,79, кипит при 78,3° С, замерзает при 117,3° С. С водой смешивается в любых соотношениях.
Получается этиловый спирт брожением сахаристых веществ. Исходными материалами служат крахмалосодержащие вещества — картофель, хлебные злаки и др.
Крахмал превращают в глюкозу, которая под действием ферментов дрожжей распадается на спирты и двуокись углерода
Для получения этилового спирта все шире используется непищевое сырье. С этой целью используют клетчатку, содержащуюся в древесных опилках или других отходах лесопроизводства. Клетчатку подвергают кислотному гидролизу, в результате которого образуется глюкоза, а из нее брожением получают этанол.
Наиболее перспективным методом синтеза этилового спирта является образование его из этилена прямым гидратированием при высоком давлении и нагревании
Этиловый спирт нашел широкое применение для получения синтетического каучука по способу академика С. В. Лебедева, а также для получения красителей, фармацевтических препаратов, при многочисленных синтезах, для консервирования анатомических препаратов.
Простейший двухатомный спирт — этиленгликоль
широко используется для приготовления не замерзающих при низкой температуре растворов (антифризов), используемых в зимнее время для охлаждения цилиндров автомобильных моторов.
Простейший трехатомный спирт глицерин
нашел широкое применение в медицине, в косметике (мягчитель кожи), для приготовления антифризов. Глицерин идет на приготовление взрывчатого вещества — тринитроглицерина и динамита.
Фенолы
Производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп ОН, непосредственно связанных с бензольным кольцом, носят общее название фенолов.
Простейший представитель этого ряда — фенол, давший общее название этому классу соединений, имеет следующее строение:
Фенол представляет собой кристаллическое вещество с температурой плавления 43° С и характерным запахом. При попадании на кожу фенол вызывает ожоги. Водные растворы фенола служат хорошим дезинфицирующим средством.
Получаются фенол и его гомологи из каменноугольной смолы и синтетическим путем.
Для фенолов характерны свойства спиртов. Они взаимодействуют с металлическими натрием и калием, дают эфиры, обменивают гидроксильную группу на галоген и т. п.
Вместе с тем фенолы обладают и рядом специфических особенностей, вызванных взаимным влиянием бензольного кольца и гидроксильной группы. Это проявляется в кислых свойствах фенола, который взаимодействует со щелочами:
Введение гидроксильной группы в бензольное кольцо значительно увеличивает реакционную способность ароматического радикала. Так, фенол легко бронируется
до трибромфенола, выпадающего в виде белого осадка. Это качественная реакция на фенол.
Фенол широко используется для получения красителей, проявителей в фотографии, медикаментов. В большом количестве фенол расходуется для приготовления пластических масс — фенопластов.
Альдегиды и кетоны
Для альдегидов и кетонов характерно наличие в молекуле карбонильной группы
У альдегидов в простейшем случае карбонильная группа связана с двумя атомами водорода:
Во всех остальных карбонильная группа соединена с углеводородным радикалом (R) и атомом водорода
Названия альдегидов производятся от названия соответствующих углеводородов с добавлением окончания «аль».
У кетонов карбонильная группа заключена между двумя углеводородными радикалами
Характерным в названии кетонов является окончание «он»:
Наличие у альдегидов и кетонов одной и той же функциональной группы 
Альдегиды и кетоны получаются окислением соответствующих спиртов:
Как уже указывалось выше, уксусный альдегид получают по реакции Кучерова из ацетилена:
Из гомологов ацетилена по реакции Кучерова получают кетоны
Карбонильная группа определяет высокую активность альдегидов и кетонов. Для карбонилсодержащих соединений характерна реакция присоединения. Так, альдегиды и кетоны легко восстанавливаются до соответствующих спиртов
Различия в строении альдегидов и кетонов определяют и ряд отличительных свойств этих соединений.
Так, альдегиды легко окисляются даже под действием такого слабого окислителя, каким является аммиачный раствор окиси серебра, образуя при этом соответствующие кислоты
При этой реакции выделяется металлическое серебро, которое, оседая тонким слоем на стенках стеклянного сосуда, образует серебряной зеркало. Реакция образования серебряного зеркала служит качен венной реакцией на альдегиды.
Кетоны в эту реакцию не вступают.
Наиболее широкое применение имеет простейший муравьиный альдегид. Он используется для получения красителей, лекарственных веществ, синтетического каучука. 40%-ный водный раствор его — формалин — используется как сильное дезинфицирующее средство. Формалин применяется для протравления семян, дли консервирования ароматических препаратов, при выделке кожи.
Широкое применение приобрел формальдегид, или метаналь, дли синтеза фенопластов (бакелитов), в основе получения которых лежат процессы ноли конденсации с участием метаналя.
Процессы поликонденсации, так же, как и процессы полимеризации, позволяют получать из большого числа молекул исходных мономеров (n = 50 — 100) высокомолекулярные соединения — полимеры.
В процессы поликонденсации вступают соединения, содержащие активные функциональные группы, способные к реакции конденсации. Эти процессы, наряду с образованием полимера, всегда сопровождаются выделением низкомолекулярных веществ, таких, как вода, аммиак, хлористый водород и др.
Например, образование фенолформальдегидной смолы может быть представлено следующими последовательно протекающими реакциями взаимодействия фенола с формальдегидом:
Полученное соединение взаимодействует с еще одной молекулой фенола.
Образующееся соединение взаимодействует с молекулой формальдегида:
Это соединение взаимодействует со следующей молекулой фенола:
В результате происходящих процессов образуются высокомолекулярные фенолформальдегидные смолы, идущие на получение пластмасс — фенопластов (бакелитов). Из них изготовляются разнообразные материалы: строительные, электроизоляционные, а также предметы бытового назначения.
Органические кислоты
Органические соединения, содержащие карбоксильную группу 
Органические кислоты могут быть рассмотрены как производные углеводородов, в которых один или несколько атомов водорода замещены карбоксильными группами.
Число карбоксильных групп, содержащихся в молекуле органической кислоты, определяет ее основность.
Так, муравьиная кислота — 
Одноосновные предельные карбоновые кислоты характеризуются общей формулой
Названия органических кислот по научной номенклатуре производятся от названий соответствующих углеводородов с добавлением окончания «овая» и слова кислота:
Органические кислоты легко получаются окислением соответствующих альдегидов
Химические свойства кислот определяются прежде всего функциональной карбоксильной группой. Органические кислоты диссоциируют в полярных растворителях (например, в воде) по кислотному типу:
Следует иметь в виду, что органические кислоты, за исключением простейшей (муравьиной), являются слабыми электролитами.
Органические кислоты взаимодействуют с металлами, стоящими в ряду напряжений левее водорода, образуя соли:
Вступают в реакцию нейтрализации с основаниями:
При взаимодействии кислот со спиртами образуются сложные эфиры:
Методом меченых атомов было показано, что гидроксильная группа уходит из кислоты.
Эта реакция обратимая, т. е. образующийся сложный эфир частично подвергается гидролизу с образованием исходных кислоты и спирта.
При действии восстановителей кислоты переходят в альдегиды
Среди одноосновных предельных кислот наиболее широкое практическое применение находит уксусная кислота. Как уже указывалось выше, уксусная кислота получается окислением уксусного альдегида. Последний получается по реакции Кучерова из этина.
Уксусная кислота при комнатной температуре — бесцветная жидкость с резким кислым запахом. Химически чистая уксусная кислота замерзает при +16,6° С, кипит при + 118,1° С, растворима в воде. Разбавленные водные растворы уксусной кислоты (5—7%), известные под названием уксуса, широко применяются в пищевой промышленности.
Уксусная кислота в больших количествах расходуется на приготовление красителей, лекарственных препаратов, для получения искусственных материалов (ацетатный шелк), пластмасс.
Некоторые соли уксусной кислоты (алюминиевые, хромовые и др.) нашли применение для крашения тканей.
Уксуснокислый свинец идет на изготовление свинцовых белил.
Широкое практическое применение находят соли высших предельных кислот, представляющих собой мыла. Натриевые соли этих кислот — твердые мыла, калиевые — жидкие.
В технике мыла получают путем гидролиза (омыления) жироп (см. § 12. Жиры), а также нейтрализацией высших предельных кислот, получаемых окислением парафинов.
Мыла находят широкое применение не только в быту, для мытья и стирки, но и в технике для отделки тканей, промывки шерсти и т. д.
Жиры
Важнейшая составная часть пищи — жиры — представляют собой сложные эфиры глицерина (пропантриола — трехатомного спирта) и высших предельных кислот.
Наиболее часто в состав жиров входят сложные эфиры таких кислот, как пальмитиновая 


Образование твердого жира можно представить схемой:
Эта реакция является обратимой и позволяет получать из жиров в результате гидролиза глицерин и высшие предельные кислоты (их называют жирными кислотами).
Примером масла может служить глицерид олеиновой кислоты:
Присоединяя водород по двойным связям указанного выше масла, можно перевести его в соответствующий твердый жир — глицерид стеариновой кислоты
Этот процесс гидрогенизации жиров очень широко используется в промышленности для получения из растительных масел более ценных твердых жиров.
При гидролизе жиров в присутствии щелочей получают глицерин и мыла:
Этот процесс получил название омыления жиров.
Углеводы
К углеводам относятся сахароподобные вещества, содержащие одновременно несколько гидроксильных групп и альдегидную или кетонную группу. Таким образом, углеводы представляют собой многоатомные альдегидоспирты или многоатомные кетоспирты.
Состав многих углеводов выражается следующей формулой: 
По сложности строения углеводы подразделяются на следующие группы:
Моносахариды
Важнейшим представителем моносахаридов является глюкоза (виноградный сахар) и фруктоза (фруктовый сахар).
Глюкоза 
Фруктоза 
Химические свойства этих соединений обусловливаются теми функциональными группами, которые входят в их состав. Для глюкозы характерны свойства спиртов и альдегидов. Так, глюкоза взаимодействует с металлическим натрием с образованием алкоголятов (сахаратов); взаимодействует с кислотами, образуя сложные эфиры
Будучи альдегидом, глюкоза легко восстанавливается до соответствующего спирта
окисляется, вступая в реакцию образования серебряного зеркала)
Как уже указывалось выше (см. §8. Спирты), глюкоза под влиянием ферментов дрожжей распадается на спирт и двуокись углеродав
Для фруктозы характерны свойства спиртов и кетонов. Фруктоза не вступает в реакцию образования «серебряного зеркала».
Глюкоза и фруктоза широко распространены в природе. Глюкоза в большом количестве содержится в виноградном соке (поэтому ее называют виноградным сахаром), в соке многих других плодов, цветов и т. д. Глюкоза является также составной частью меда. В большом количестве ее получают при кислотном гидролизе крахмала и свекловичного сахара.
Глюкоза — белое кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. Она находит применение в пищевой (кондитерской) промышленности, в медицине, а также для отделки и крашения тканей.
Дисахариды
Наиболее важное значение среди дисахаридов имеет сахароза, известная также под названием тростникового, или свекловичного, сахара. Сахароза встречается во многих растениях, но в наибольшем количестве она содержится в сахарном тростнике (14—26%) и в сахарной свекле (16—20%). В Советском Союзе сахароза (продажный сахар) получается из сахарной свеклы. Сахарозе отвечает формула 
Вот почему эта группа углеводов и названа дисахаридами. В молекуле сахарозы содержится большое число гидроксильных групп, но отсутствуют карбонильные группы, за счет которых и происходит соединение глюкозы и фруктозы в одну молекулу сахарозы. Поэтому для сахарозы характерны химические свойства спиртов и не характерны реакции на альдегидную и кетонную группы. Так, сахароза не вступает в реакцию образования «серебряного зеркала».
Применение сахарозы как важного питательного вещества (сахара) общеизвестно.
Полисахариды
Важнейшие углеводы группы полисахаридов: крахмал и клетчатка.
Крахмал является продуктом фотосинтеза, происходящего в зеленых растениях при участии зеленого пигмента растений — хлорофилла — и солнечной энергии. Крахмал в большом количестве содержится в клубнях картофеля (до 24%), в пшеничных зернах (64%), в зернах риса (до 75%), кукурузы (70%), из которых в промышленности и получают крахмал.
Крахмал — белый аморфный порошок, напоминающий муку (картофельная мука), не растворимый в холодной воде. В горячей воде набухает, образуя внешне однородный раствор крахмального клейстера. Состав крахмала выражается формулой
При действии кислот или энзимов (ферментов) крахмал подвергается гидролизу, в результате которого из молекулы крахмала образуется большое число (до 1000) молекул моносахарида — глюкозы
Отсюда и название углеводов этой группы — полисахариды, т. є. составленные из большого числа моносахаридов.
Остатки моносахаридов соединены в молекуле полисахарида — крахмала — за счет альдегидных групп. В молекуле крахмала поэтому нет свободных альдегидных групп, а вследствие этого для крахмала свойства альдегидов не характерны. Так, крахмал не вступает в реакцию образования серебряного зеркала. Для обнаружения крахмала используется цветная реакция его с йодом, сопровождающаяся ярким синим окрашиванием.
Крахмал играет чрезвычайно важную роль в жизни человека, являясь основным углеводом пищи — хлеба, круп, картофеля. Широко известно его применение в текстильной и полиграфической промышленностях, в медицине и др.
Широкое применение в технике и в быту находит другой распространенный в природе полисахарид — клетчатка, называемая также целлюлозой. Стенки растительных клеток почти целиком состоят из клетчатки. В древесине содержание клетчатки достигает 60%, а в волокнах хлопка 90%. Хлопчатобумажные волокна, бумага, вата почти нацело состоят из клетчатки.
Клетчатка не растворима в обычных растворителях. Растворителем для нее является аммиачный раствор гидрата окиси меди (реактив Швейцера). Клетчатка растворяется также в концентрированных кислотах (соляной и серной), но при этом происходит разрушение клетчатки, ее гидролиз, в результате которого образуется моносахарид—глюкоза. Гидролиз клетчатки происходит и при кипячении ее с разбавленной серной кислотой и при этом также образуется глюкоза. Следовательно, молекула клетчатки так же, как и крахмала, состоит из остатков глюкозы и характеризуется формулой
Процесс гидролиза выражается уравнением:
В клетчатке также отсутствуют альдегидные группы, и она не дает реакции «серебряного зеркала». Наличие же в молекуле клетчатки большого числа гидроксильных групп позволяет получать ее разнообразные производные — простые и сложные эфиры, которые находят самое широкое применение для изготовления искусственных материалов (ацетатный шелк), взрывчатых веществ, лаков и др.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.