Что бывает при поражении стриатума
Что бывает при поражении стриатума
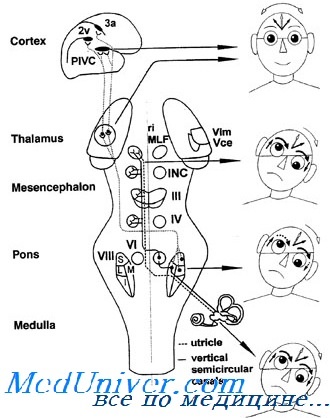
В последнее время много говорят и пишут о суправестибулярных центрах и путях. Речь идет, как известно, об образованиях, расположенных между зрительным бугром и полосатым телом. Считают, что серые узлы основания мозга играют определенную роль в вестибулярном аппарате. Экспериментальное разрушение бледного шара сопровождается насильственными манежными движениями в больную сторону и ка-тательными в здоровую.
Представление о зрительном бугре и полосатом теле как о суправестибулярных образованиях возникло на основании экспериментально-патофизиологических и клинических фактов. Существующие же анатомические данные в отношении связей ядер задней комиееуры с бледным шаром пока еще довольно скудны. Непосредственных связей между вестибулярными ядрами и стриарной системой нет. Возможно предположить, что связь вестибулярных ядер со зрительным бугром, а затем и с полосатым телом осуществляется через несколько нейронов. Эти анатомические связи весьма нечетко очерчены. Однако существует предположение, что связь между вестибулярными ядрами и стриарной системой может происходить через посредство ядра Даркшевича и также через иптерстициальпые ядра. Б. Н. Клосовский относится к возможности существования этих путей весьма скептически.
Кроме того, он считает ядро Даркшевича вегетативным образованием, а интерстициальное ядро соматическим.
Таким образом, в настоящее время нужно считать окончательно установленными вестибулярные пути прямой и перекрещенный от ядра Бехтерева и от треугольного ядра до глазодвигательных ядер. Дальнейшее же их протяжение через область задней спайки к серым узлам основания мозга предполагаемыми, принятыми лишь в качестве рабочей гипотезы, удачно объясняющей многие клинические факты.
Полосатое тело на основании особенностей гистологического строения, характера проводящих путей и на основании данных онто- и филогенеза делится на два образования: стриатум, т. е. хвостатое ядро и скорлупу и паллидум, т. е. бледный шар.
Стриатум в основном посылает свои волокна к паллидуму. От последнего идут волокна к зрительному бугру и к ядрам среднего мозга: к красному ядру, ядру Даркшевича и к интерстициальному ядру.
О функции отдельных частей полосатого тела, в частности, собственно стриатума и паллидума, имеется следующее представление. Паллидум является узловым аппаратом, где происходит интеграция двигательных актов, как произвольных, так и рефлекторных. Благодаря этому поражение паллидума дает акинез, т. е. выпадение рефлекторных движений и выпадение из произвольного двигательного акта сопутствующих не основных компонентов.
Стриатум же является образованием высшего порядка, которому паллидум подчинен. В основном функция его выражается в торможении паллидума. Вследствие этого при выпадении стриатума возникает гиперфункция паллидума, выражающаяся в избытке рефлекторных движений, что создает гиперкинезы. Надо учесть, что паллидум является филогенетически более древним образованием, а стриатум его надстройкой и филогенетически более молодым. Поэтому функционально паллидум является в полосатом теле основным аппаратом, определяющим роль полосатого тела в нервной системе. Стриатум как бы модифицирует его функцию. Еще проще можно формулировать функцию полосатого тела, говоря, что паллидум управляет явлениями первичного автоматизма, а стриатум обеспечивает вторичный автоматизм и играет, следовательно, роль в координации и торможении паллидарной деятельности.
Следует учесть, однако, что эти образования находятся под постоянным мощным воздействием коры головного мозга.
О более высоко по направлению к коре расположенных вестибулярных образованиях кое-что было уже сказано в статье о проводящих путях. Точные анатомически изученные пути пока еще неизвестны. Надо полагать, что связь вестибулярных ядер с корой осуществляется многими путями. Одним из таких путей может быть вестибулоталамический с дальнейшим протяжением в префронтальную кору. Известны также множественные волокна наряду со слуховыми, соединяющие заднее двухолмие с теменной и височной долями мозга.
Экспериментальные данные указывают, что после префронтального поражения возникает очень слабо выраженное манежное движение в больную сторону, атаксия на противоположной стороне. После вращения манежное движение возникает только в больную сторону, спонтанного нистагма не бывает, имеется ясная мышечная гипотония на противоположной стороне.
Следовательно, экспериментальное префронтальное поражение вызывает синдром, являющийся равнодействующим между гомолатеральным вестибулярным и контралатеральным мозжечковым синдромами.
Патофизиологические механизмы нарушения двигательного контроля при повреждении стриатума у человека
Акинезия и гиперактивность. Акинезия (снижение объема движений) наиболее часто встречается при паркинсонизме или у больных вторичным паркинсонизмом при хроническом приеме нейролептиков.
При патологоанатомическом анализе в этих случаях наблюдаются выпадение клеток черной субстанции и уменьшение концентрации дофамина в стриатуме.
Акинезию часто отмечают также при билатеральном повреждении гипоталамуса, что объясняют перерывом восходящих дофаминергических путей.
У экспериментальных животных акинезия является результатом билатеральной деструкции восходящих дофаминергических путей или применения веществ, которые эти пути блокируют (например, за счет блокирования синтеза или хранения дофамина в синаптических окончаниях).
У животных акинезия, вызванная фармакологическими веществами, сопровождается ригидностью, нарушением позы и тремором.
В противоположность этому блокада дофаминовых рецепторов или истощение запаса дофамина приводит к возрастанию моторной активности.
Этот эффект возникает у животных, которые получают вещества, способствующие высвобождению дофамина из депо (например, амфетамин), или специфические агонисты дофамина (например, апоморфины).
Клинические наблюдения указывают на важную роль дофаминовой системы переднего мозга в двигательном контроле: снижение активности дофаминергической системы приводит к снижению двигательной активности, а активация этой системы – к ее возрастанию. Это подтверждается и экспериментальными исследованиями.
Дискинез и стереотипное поведение. дискинез проявляется в виде непроизвольных движений отдельных частей тела.
Это наблюдается, например, при хорее (болезнь Гетингтона), гемибаллизме, атетозе. Основной признак: сходство таких движений с нормальными движениями или их фрагментами; все стереотипное поведение состоит из таких законченных единиц.
Ригидность. Считают, что это нарушение является следствием нарушения супраспинального двигательного контроля, который распространяется на гамма- и альфа-мотонейроны. После разрушения бледного шара или соответствующего эфферентного пути ригидность снижается.
Она также уменьшается после введения L-дофы (у больных паркинсонизмом). У людей и животных ригидность возможна при систематическом применении нейролептиков, блокирующих дофаминовые рецепторы (фенотиазин, бутерофенозин), или резерпина, который истощает содержание дофамина в синаптических окончаниях.
Таким образом, при стриарных повреждениях наиболее ярко проявляются три типа симптомов: дискинез, тремор и ригидность. В этих симптомах, кроме стриарных структур, участвуют и другие мозговые структуры.
Например, тремор экспериментально получают только при комбинированных повреждениях базальных ганглиев и мозжечковых связей.
Считают, что у таких больных также имеется комбинированное повреждение дофаминовых путей и рубро-оливо-мозжечково-рубральной петли и что ведущую роль в этих случаях играет зубчатое ядро мозжечка.
Для дискинеза характерна зависимость от разрушения двух структур, имеющих прямой выход на бледный шар, субталамическое ядро (тело Люиса) и полосатое тело.
Ригидность наиболее четко связана со стриарной системой, хотя у человека это заболевание является, как правило, результатом повреждения не только стриатума.
Можно предположить, что непроизвольные движения различного типа могли быть результатом патологии двух структур: субталамуса и стриатума, которые оказывают свое влияние на бледный шар через раздельные проекции.
Клиническими исследованиями установлено, что при разрушении в области бледного шара, а также таламуса (вентролатеральное ядро таламуса) прекращаются непроизвольные движения (дискинез, тремор), а также ригидность с более или менее сильным ухудшением произвольных движений. Эти явления можно интерпретировать следующим образом.
Несмотря на то что выход бледного шара, безусловно, вовлекается в патогенез этих непроизвольных движений, но он не играет ведущей роли. Поэтому когда патологический выход удаляют, деятельность оставшейся части моторной системы может компенсироваться адекватно.
Отсутствие грубых изменений произвольных движений при паллидальных нарушениях объясняют неполным прерыванием выхода из базальных ганглиев, а также тем, что остается незатронутой черное вещество.
Имеются некоторые доказательства того, что дискинез есть результат дисфункции в пределах стриатума (или нигростриарной дофаминовой системы), тогда как акинезия является результатом дисфункции в мезолимбической дофаминовой системе.
В клинике синдром поражения стриарной системы описывается как атетоз и хорея. При атетозе наблюдают медленные непрекращающиеся движения на фоне мышечного гипертонуса.
В них обычно вовлекаются руки, менее часто – губы и язык, достаточно редко – шея и ноги. При хорее движения происходят на фоне мышечного гипертонуса; они быстрые, отрывистые в виде перемежающихся нерегулярных движений в непредсказуемой последовательности.
Болезнь Гетингтона, при которой хорея является ведущим моторным симптомом, нейроанатомически характеризуется деструкцией выходных нейронов стриарной системы.
При билатеральном поражении субталамического ядра (тела Люиса) в непроизвольную моторную активность вовлекается дистальная мускулатура конечностей. Это так назывемый баллизм.
При повреждении субталамического ядра только одной стороны непроизвольные движения наблюдаются лишь на противоположной стороне тела (гемибаллизм).
Изолированное повреждение эфферентных нейронов внутреннего сегмента бледного шара и ретикулярной части черной субстанции у экспериментальных животных не вызывает заметных двигательных расстройств, за исключением того, что все движения замедляются (брадикинезия).
У человека дофаминовая нигростриарная система наиболее обширно повреждается при болезни Паркинсона. Основными моторными нарушениями при ней являются брадикинезия, ригидность и тремор.
Эти симптомы в полном объеме воспроизводятся у обезьян при разрушении дофаминовых нейронов мозга системным введением нейротоксина N-метил-4-фенил-1, 2, 3, 6-тетрагидропиридина (МФТП).
Ригидность мышц, которая очень характерна для болезни Паркинсона, объясняют тонической активностью альфа-мотонейронов. В пользу этого говорит усиление полисинаптического (но не моносинаптического) рефлекса на растяжение.
Синдром поражения стриатума
Поражение хвостатого ядра и скорлупы также вызывает тяжелые нарушения движений, но в отличие от паркинсонизма здесь на первый план выступают разнообразные гиперкинезы. Эти насильственные движения имеют диффузный характер, но иногда выражены только в какой-нибудь одной группе мышц.
Атетозный гиперкинез нередко распространяется на все тело и тогда больной не может ни сидеть, ни лежать спокойно. Мышцы лица также часто бывают охвачены медленными и самыми причудливыми насильственными движениями. Речь становится смазанной, непонятной, с выкриками. Эмоции, внешние раздражения и произвольные движения усиливают атетоз. Имеется основание предполагать, что в полосатом теле существует известная локализация. Так, при поражении орального отдела стриатума атетозный гиперкинез наблюдается в области головного конца тела (мимические, речевые и жевательные движения).
При поражении средней части гиперкинез проявляется преимущественно в руках и туловище. Поражение каудального отдела вызывает насильственные движения в ногах.
В то же время в ряде случаев появление тика, несомненно, отражает ограниченное поражение в области скорлупы или хвостатого тела. Топографическая близость стриарной системы с внутренней капсулой обусловливает комбинированные поражения, что и проявляется в клинике сочетанием спастического паралича с атетозом.
При односторонних поражениях полосатого тела выступает соответствующий гемисиндром в противоположной половине тела. Изложенное представляет собой только схематическое описание основных синдромов поражения стриопаллидарной системы, далеко не исчерпывающее всего многообразия клиники ее поражения.
Клинический случай выявления болезни Гентингтона
Болезнь Гентингтона — аутосомно-доминантное нейродегенеративное заболевание, которое характеризуется начинающимися в среднем возрасте прогрессирующим нарушением когнитивных функций, непроизвольными движениями и нарушением координации движений.
Джордж Гентингтон первым описал это состояние в 1872 году, изучив семейный случай заболевания у жителей Лонг-Айленда.
Хорея начинается исподволь. Первые признаки хореи Гентингтона проявляются в возрасте 25-50 лет, реже в детском возрасте. Мужчины болеют чаще, чем женщины; первыми симптомами могут быть неусидчивость, суетливость движений, что не расценивается больным и его родственниками как заболевание. Со временем, однако, двигательные нарушения нарастают и могут привести к инвалидности. Характерны частые, внезапные, неритмичные судорожные движения конечностей или туловища. Возможны спазмы лицевой мускулатуры, всхлипывания, нарушения артикуляции. Страдает координация движений при ходьбе: походка становится «танцующей» (хореической). Память остается сохранной вплоть до поздних стадий заболевания, однако внимание, мышление и исполнительные функции нарушаются уже в самом начале заболевания. Часто наблюдаются депрессия, апатия, отчужденность, раздражительность, периодическая расторможенность. В некоторых случаях развиваются бред и навязчивые состояния, в связи с чем сначала ошибочно диагностируется шизофрения.
Обычно хорея Гентингтона проявляется на 4-5-ом десятилетии жизни прогрессирующим хореоатетозом, который сопровождается выраженными психическими расстройствами ( деменцией, депрессией с нередкими суицидальными попытками, нарушениями эмоционального контроля с частыми вспышками раздражения и агрессии). Иногда проявляется в юношеском возрасте нарастающим акинетико-ригидным синдромом.
Диагноз подтверждают генетическим тестированием.
Ген болезни Гентингтона HD располагается в сегменте 4р16.3, содержит повторяющиеся тринуклеотидные повторы ЦАГ и кодирует белок, называемый гентингтином. Этот белок содержится в нейронах различных отделов головного мозга; функция его неизвестна. Инактивация гомологичного гена у мышей при гомозиготном состоянии вызывает гибель зародыша; гетерозиготные особи фенотипически не отличаются от нормы. У мышей, у которых в этом гене увеличено число тринуклеотидных повторов, развиваются прогрессирующие двигательные нарушения. Увеличение числа повторов ЦАГ приводит к тому, что в кодируемом этим геном белке появляется длинный полиглутаминовый участок, что и может быть причиной заболевания. Полагают, что длинный полиглутаминовый участок нарушает связывание белков, а также другие процессы в клетках, например активность митохондрий. Сообщалось о нарушении связывания гентингтина с глицеральдегидфосфатдегидрогеназой. Кроме того, имеются данные об усилении апоптоза нейронов при этой болезни.
Выявление увеличения числа тринуклеотидных повторов ЦАГ в гене HD лежит в основе генодиагностики болезни Гентингтона. Если число повторов ЦАГ составляет 38 или более, то заболевание с возрастом разовьется неминуемо. Вероятность наследования аномального гена и, следовательно, развития болезни Гентингтона у детей таких больных составляет 50%. Чем больше тринуклеотидных повторов содержит ген, тем раньше начинается заболевание. Однако в большинстве случаев число повторов составляет 40-49, а в этих пределах зависимости между числом повторов и возрастом начала заболевания нет. По неясным причинам риск значительного увеличения числа тринуклеотидных повторов и развития ювенильной формы болезни Гентингтона (форма антиципации) выше, если болен отец больного.
Кровным родственникам можно рекомендовать пройти генетическое тестирование. Прежде чем проводить анализ ДНК у здоровых лиц с высоким риском болезни Гентингтона, необходимо тщательное генетическое консультирование, поскольку положительные результаты анализа ДНК могут привести к тяжелой моральной травме.
Медико-генетическое консультирование и анализ ДНК используются не только при определении риска болезни Гентингтона, но и в дифференциальной диагностике этого заболевания. Так, мутантный ген HD иногда находят при спорадической «старческой» хорее. При заболеваниях, напоминающих болезнь Гентингтона, таких, как шизофрения, доброкачественная семейная хорея, наследственные атаксии, абеталипопротеидемия и семейная болезнь Альцгеймера, число тринуклеотидных повторов не увеличено.
Специфического лечения нет. Лечение преимущественно симптоматическое.
Клинический случай
Больная С., 57 лет, поступила на лечение во II неврологическое отделение 07.12.2014г. с жалобами на общую слабость, прогрессирующее снижение памяти, внимания, головокружение, шаткость при ходьбе, головные боли, неритмичные непроизвольные насильственные мышечные подергивания в туловище и во всех конечностях.
Из анамнеза известно, что в течение нескольких лет страдает гипертонической болезнью с умеренными цифрами АД, распространенным остеохондрозом позвоночника, дисциркуляторной энцефалопатией с вестибуло-атактическим синдромом.
Ухудшение состояния около 1,5 лет, когда в клинической картине появились неритмичные непроизвольные насильственные мышечные подергивания в туловище и во всех конечностях, стали отмечаться медленно прогрессирующие когнитивные нарушения.
В неврологическом статусе: В сознании, контактна, ориентирована. Эмоционально лабильна. Фон настроения снижен. Выраженно фиксирована на своих ощущениях, тревожна, ипохондрична. Менингеальных знаков нет. ЧМН: Глазные щели D=S. Зрачки D=S. Фотореакции живые. Движения глазных яблок не ограничены. Нарушений чувствительности на лице нет. Точки выхода тройничного нерва безболезненны. Лицо симметрично. Нистагма нет. Глоточный рефлекс сохранён. Глотание, фонация не нарушены. Язык по средней линии. Парезов нет. Сухожильные рефлексы оживлены, с расширенной зоной, S=D. Отмечаются маятникообразные подергивания ног при исследовании коленных рефлексов. Патологических стопных знаков не выявляется. Паравертебральные точки, остистые отростки в шейном, поясничном отделе безболезненны. Нарушений чувствительности не выявляется. В позе Ромберга пошатывается. Дисметрия при выполнении ПНП, ПКП с 2-х сторон. Мышечная дистония. Выявляются спонтанные неритмичные хореоатетоидные гиперкинезы во всех конечностях, туловище, мимических мышцах. Походка гиперкинетическая с элементами атаксии.
Учитывая жалобы больной, данные анамнеза заболевания и клиническую картину, дифференциальный диагноз проводился между дебютом болезни Гентингтона и малой хореей. Пациентке выполнена МРТ головного мозга, выявившая картину дисциркуляторной энцефалопатии, смешанной атрофической гидроцефалии; ЭЭГ: Основной ритм покоя недостаточно выражен, «уплощен», вероятно, как проявление дисфункции нижнестволовых структур мозга. Дуплексное ангиосканирование БЦА, выявившее нестенозирующий атеросклероз внечерепных отделов брахиоцефальных артерий; ревмопробы (С-реактивный белок, антистрептолизин-О, ревматоидный фактор) – в пределах нормы. На основании данных проведённого дообследования, диагноз малой хореи представлялся маловероятным.
Больная была направлена на консультацию в НИИ Неврологии РАМН. Диагноз болезни Гентингтона подтвержден результатами медико-генетического исследования.
Пациентке назначен экспериментальный препарат Придопирин, который она в настоящее время принимает с некоторым положительным эффектом (несколько улучшилась память, внимание, улучшились навыки самообслуживания – больная самостоятельно ходит в магазин, готовит пищу).
В декабре 2015г. пациентка проходила плановый курс сосудисто-метаболической терапии во II неврологическом отделении КБ № 1, выписана с улучшением, уменьшением выраженности вестибуло-атактических проявлений, стабилизацией фона настроения.
Нейронауки для всех. Детали: стриатум
Когда в очередной научной новости рассказывается о поведении человека, мотивации к деятельности или о том, как лучше обучаться, то почти всегда упоминается система вознаграждения. Об анатомической структуре мозга, которая как раз за это отвечает, и пойдёт речь.
Эта структура называется стриатум (corpus striatum) или полосатое тело. Она расположена в самом переднем отделе головного мозга. Стриатум – часть базальных ганглиев (причём считается самым большим из 5 клеточных компонентов базальных ганглиев), главная функция которых – сознательный контроль и управление движениями, а так же обучение этому.
Исторически считалось, что главная функция всего комплекса базальных ганглиев – воплощение движений. Например, замечали, что у пациентов с болезнью Паркинсона совместно с нарушением двигательной активности были и изменения в ганглиях. Довольно легко связать эти два наблюдения в одно целое. Затем в процессе накопления научных знаний стало известно, что базальные ганглии могут контролировать и движения глаз, и даже влиять на поведение. Их нарушения могут проводить к заболеваниям, в которых проявляется либо гипокинез (снижение двигательной активности), либо гиперкинез (чрезмерные, иногда «лишние» движения).
Анатомическое строение
Своё второе название на русском языке («полосатое тело») стриатум получил из-за того, что на его срезах видны чередующиеся светлые и тёмные полосы. На латыни это слово («striatum») точно так же означает «полосатый».
Обычно стриатум разделяют на две части – дорсальную (расположенную сверху), которая представлена хвостатым ядром (caudate nucleus), чечевицеобразным ядром (lentiform nucleus или lenticular nucleus) и скорлупой, и вентральную, которая содержит прилежащее ядро (nucleus accumbens).
Хвостатое и чечевицеобразное ядро. Илл: Wikimedia Commons
Структуры, называющиеся ядрами, представляют собой определённые участки в мозге, которые можно разделить или, наоборот, объединить с другими находящимися рядом нейронами по функции или по связанности. Нервные клетки одного ядра обычно выполняют одинаковую работу и связаны с одними и теми же целевыми участками. В мозге позвоночных находятся сотни ядер, которые очень разнятся по размерам и форме. Внутри них также выделяют «подъядра» (subnuclei) из-за того, что даже в таком малом образовании, как ядро, может происходить более аккуратное и тонкое разделение функций нейронов.
Дорсальная часть стриатума важна для процесса принятия решений и для выбора того, как реагировать на какое-либо событие, для выбора действий.
Прилежащее ядро связано с системами вознаграждения, подкрепления, и в зависимости от правильности его работы может происходить переход от простого выполнения действий, приносящих удовольствие, к постоянным нацеленным желаниям производить эти самые действия (аддикция).
Стриатум постоянно получает нервные импульсы от многих отделов коры головного мозга: моторных, сенсорных (за некоторым исключением), ассоциативных, лимбических и паралимбических. И каждая из этих областей проецируется на строго определённую зону в нём. В состав полосатого тела входят разнообразные клетки, но большинство (приблизительно 90%) – это средние по размеру шиловидные ГАМК-эргические проекционные нейроны. Такие нейроны собирают и анализируют информацию, которую получает стриатум, и передают её нейронам различных базальных ганглиев.
Делит стриатум на две части у человека и макаки тонкая полоска белого вещества, по сравнению с крысами и мышами, у которых хвостатое ядро и скорлупа не разделены. Это белое вещество образует внутреннюю капсулу, однако, между хвостатым ядром и скорлупой остаётся множество связей. По размеру мозг человека в 13-18 раз больше мозга макаки резус, но размер стриатума больше всего лишь в 6 раз. Кстати, в одном из исследованийучёные выяснили, что объём стриатума у людей с болезнью Паркинсона, как ни странно, больше (7.5 см3), чем у здоровых людей (6.3.см3).
Функции
Функций у стриатума великое множество. Это планирование и контроль движений, различные когнитивные процессы, которые нужны для выполнения различных действий. Стриатум вовлечён в процесс обучения, и для этого очень важны его взаимодействия с дофамин-содержащими нейронами в среднем мозге.
Стриатум на МРТ. Илл: Wikimedia Commons
Роль в принятии решений стриатум делит с префронтальной корой головного мозга. Они очень тесно взаимосвязаны друг с другом и зачастую могут даже взаимно активироваться. Поэтому некоторые учёные даже предлагают глубокую стимуляцию чего-то одного для того, чтобы опосредованно влиять на другое.
Полосатое тело важно в работе системы вознаграждения, и, более того, учёные показали, что можно получать удовольствие не только от прошлых и происходящих событий или действий, но и даже от простого ожидания самих событий.
Патология
Но как ведёт себя стриатум в патологии? Что вообще может в нём произойти?
Наиболее опасно прекращение выработки дофамина, который как раз нужен для корректных движений. За время старости число дофаминовых рецепторов уменьшается, да и вообще в целом снижается концентрация этого нейромедиатора.
Интересно, что не только физические изменения в стриатуме могут вести к отклонениям в его функционировании, но и играют роль генетические факторы. Например, слишком высокая экспрессия генов рецепторов дофамина D3 в стриатуме нарушает мотивацию и мотивационное поведение у мышей, но не затрагивает другие проявления их поведения.
Именно при проблемах с прилежащем ядром начинается аддикция – поведение, когда у людей есть навязчивая потребность в какой-то определённой деятельности. Это может выражаться в том, что человек привыкает к лекарственным средствам и ощущает постоянную потребность в них, либо это может быть, например, желание выполнять однообразные действия.
Генетически обусловленные факторы также влияют на атрофию стриатума и на функционирование всех базальных ганглиев в целом. При хорее Гентингтона в гене HTT, который кодирует белок хангтинтин, присутствуют повторы из трёх нуклеотидов CAG, и если число таких повторов больше 36, то изменяется пространственная структура белка. А у человека развивается хорея. В таком случае белок хангтинтин начинает образовывать агрегаты с другими белками, поэтому препятствует нормальному клеточному транспорту в нейронах и может вести к их гибели.
Текст: Надежда Потапова
Предыдущие материалы о нейроанатомии (серия «Детали»): таламус, гипоталамус, клетки Пуркинье.