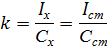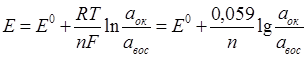что такое градуировочный график
Градуировочный график
16. Градуировочный график
Графическое выражение зависимости аналитического сигнала от концентрации (или количества) вредного вещества
Графическое изображение зависимости между значениями концентраций определяемого компонента и аналитического сигнала
Полезное
Смотреть что такое «Градуировочный график» в других словарях:
определение — 2.7 определение: Процесс выполнения серии операций, регламентированных в документе на метод испытаний, в результате выполнения которых получают единичное значение. Источник … Словарь-справочник терминов нормативно-технической документации
Обработка — 7. Обработка* Математический и (или) логический анализ результатов измерения Источник … Словарь-справочник терминов нормативно-технической документации
Обработка результатов — 3.5. Обработка результатов По результатам просеивания вычисляют: частный остаток на каждом сите (ai) в процентах по формуле (3) где mi масса остатка на данном сите, г; m масса… … Словарь-справочник терминов нормативно-технической документации
Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии — 4.2. Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии Спектральному методу предшествует перевод анализируемой пробы в пятиокись ниобия. Метод основан на измерении интенсивности линий… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 22898-78: Коксы нефтяные малосернистые. Технические условия — Терминология ГОСТ 22898 78: Коксы нефтяные малосернистые. Технические условия оригинал документа: 4.4.2.2. Определение водного числа пикнометра Перед определением водного числа пикнометры должны быть тщательно промыты хромовой смесью,… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 26252-84: Порошок ниобиевый. Технические условия — Терминология ГОСТ 26252 84: Порошок ниобиевый. Технические условия оригинал документа: 4.4. Определение удельной поверхности 4.4.1. Удельная поверхность ниобиевого порошка определяется на приборе АДП 1 или Т 3 методом воздухопроницаемости, при… … Словарь-справочник терминов нормативно-технической документации
Спектральный анализ — I Спектральный анализ физический метод качественного и количественного определения атомного и молекулярного состава вещества, основанный на исследовании его спектров. Физическая основа С. а. Спектроскопия атомов и молекул, его… … Большая советская энциклопедия
Научная электронная библиотека
Дорогова В Б, Игнатьева Л П,
3.2. Метод градуировочного графика
Для определения содержания вещества методом градуировочного графика готовят серию из 5–8 стандартных растворов разных концентраций и измеряют оптическую плотность каждого из растворов, делая не менее 3-х параллельных определений для каждой точки.
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
1) он должен охватывать область возможных изменений концентраций исследуемого раствора. Желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
Полученная кривая (рис. 3.1) называется градуировочной кривой или градуировочным графиком.
Периодически 1 раз в месяц или в квартал, при замене новой партии реактивов, либо после ремонта фотоколориметра градуировочную кривую проверяют по 2–3 свежеприготовленным стандартным растворам и реагентам.
В общем случае, когда свет поглощается не только определяемым соединением, но и реагентом, экспериментальные данные измерений оптической плотности могут быть представлены следующими вариантами:
3. Оптическую плотность растворов измеряют относительно растворителя. Результат холостой пробы и его погрешность рассчитывают методом линейного регрессионного анализа.
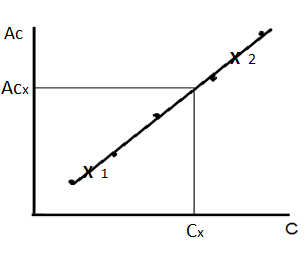
Определив оптическую плотность исследуемого раствора АХ, находят ее значение на оси координат, а затем на оси абсцисс – соответствующее ей значение концентрации СХ.
Этот метод применяют при выполнении серийных фотометрических анализов, он дает хорошие результаты при соблюдении основного закона светопоглощения.
угловой коэффициент линейного градуировочного графика и он равен
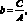
В дальнейшем, при расчете искомой концентрации СХ пользуются только градуировочным коэффициентом:
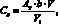
оптическая плотность анализируемого раствора;
Метод градуировочного графика
Метод градуировочного графика – это приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы с помощью градуировочного графика. В аналитических определениях чаще всего имеют дело с прямолинейной градуировочной зависимостью. Уравнение прямой имеет вид y = a + bx, где у – аналитический сигнал, х – концентрация (может быть логарифм концентрации), коэффициент а – отрезок, отсекаемый прямой на оси ординат, коэффициент b –тангенс угла наклона прямой.
На практике устанавливают градуировочную зависимость путем измерения аналитического сигнала в стандартных растворах. Для проведения анализа необходимо иметь исходный стандартный раствор, который готовят по точной навеске, растворённой в мерной колбе. Если стандартный раствор нельзя приготовить по точной навеске, готовят раствор приблизительной концентрации, а затем устанавливают его концентрацию другим методом анализа. Концентрацию исходного стандартного раствора рассчитывают с четырьмя значащими цифрами.
Из исходного стандартного раствора, то есть точно известной концентрации, путем разбавления приготавливают серию стандартных растворов. Во всех приготовленных стандартных растворах измеряют аналитический сигнал. Строят график зависимости аналитического сигнала Ас i от концентрации определяемого компонента С i.
Затем измеряют аналитический сигнал в анализируемой пробе, строго соблюдая те же условия определения и режим работы прибора, как в стандартных растворах. По градуировочному графику находят концентрацию определяемого компонента в анализируемом растворе (рисунок 1.1). Более точные результаты получают, если для линейного участка градуировочного графика выводят уравнение Ас = a + b С и по нему рассчитывают концентрацию определяемого компонента.
Если измеренный аналитический сигнал превышает верхний предел линейной области графика, то анализируемый раствор разбавляют и повторяют измерения. Необходимую степень разбавления анализируемого раствора выбирают таким образом, чтобы концентрация определяемого компонента в разбавленном растворе и, соответственно, аналитический сигнал попадали в линейную область.
Рисунок 1.1 – Метод градуировочного графика
Построение градуировочного графика Ас = f (С) на миллиметровой бумаге проводят в следующем порядке:
1. Выбирают масштаб с учетом ошибки измерения и отмечают на осях координат ряд чисел, характеризующих масштаб. Значения концентрации С откладывают на оси абсцисс, а значения аналитического сигнала Ас – на оси ординат, указывают единицы измерения физических величин. Экспериментальные значения величин на осях координат откладывать не следует.
2. В координатах Ас – C наносят экспериментальные точки, полученные после измерения Ас в стандартных растворах.
3. Рассчитывают значения коэффициентов a и b для уравнения графика y = a + bx и коэффициент корреляции r, используя данные измерений в стандартных растворах (y = Aci, x = Ci). Расчёт проводят методом наименьших квадратов на компьютере (например, в программе Exel) или по формулам [1, c.48]. Записывают уравнение Ас = a + b С, подставив найденные значения коэффициентов a и b.
Коэффициент корреляции r отражает корреляцию параметров Ас и С:
– если r близок к единице (r ≥ 0,99), то корреляция характеризует между Ас и С количественную зависимость;
– если r ≈ 0,95, то зависимость считается полуколичественной;
– если r ≈ 0,90 и ниже, то зависимость считается качественной.
Метод стандартов
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности.
Метод одного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст. Затем измеряют величины аналитического сигнала этого раствора (Iст ) и анализируемой пробы ( Ix ) в одинаковых условиях.
Из выражения для k выводим формулу для расчёта неизвестной концентрации:
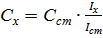
Метод двух стандартов (ограничивающих растворов)
Метод ограничивающих растворов используют в том случае, если концентрация определяемого компонента в анализируемом растворе приблизительно известна и попадает в интервал линейной зависимости показаний прибора (аналитический сигнал) от концентрации. Этим методом пользуются после установления линейности градуировочного графика в определенном диапазоне концентраций.
Результат анализа представляют в форме среднего значения из серии параллельных определений с рассчитанным доверительным интервалом:
Подробные рекомендации и примеры по проведению и оформлению расчетов приведены в пособии [3].
Округление результата определенияx ср ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
Погрешность результата определения δ принято записывать одной цифрой одной или двумя значащими цифрами:
– однойцифрой, если первая цифра погрешности равна 3 или более.
– двумяцифрами, если первая из них равна 1 или 2.
Результат определения x ср должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности. Например, 20,5 ± 0,4; 0,2236 ± 0, 0015; 10,00 ± 0,24.
Обработанные результаты определения представляют в виде таблицы 1.1.
2. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Потенциометрические методы анализа основаны на измерении разности потенциалов (ЭДС) между двумя электродами, опущенными в анализируемый раствор. Один электрод является индикаторным, его потенциал зависит от концентрации (активности) определяемого иона. Потенциал другого электрода, который называется электродом сравнения, не зависит от концентрации определяемого иона и в процессе определения остается постоянным. Зависимость равновесного потенциала индикаторного электрода от активности иона в растворе описывается уравнением Нернста:
В потенциометрии используют два вида индикаторных электродов.
1. Электроды, на поверхности которых или в приэлектродном слое протекают электронообменные процессы. К ним относятся инертные электроды (платиновый, золотой) и металлические электроды 1-го рода (серебряный, медный и др.).
2. Электроды, у которых на межфазных границах (мембрана – раствор) протекают ионообменные процессы – ионоселективные (мембранные) электроды (ИСЭ).
В качестве электрода сравнения в лабораторной практике чаще всего используют электрод 2-го рода – хлоридсеребряный.
Потенциометрические методы разделяют на две группы: методы прямой потенциометрии (ионометрия) и методы косвенной потенциометрии (потенциометрическое титрование).
Основным условием выполнения определения потенциометрическим методом является правильный выбор индикаторного электрода. В прямой потенциометрии используют ионоселективные электроды. При потенциометрическом титровании выбор индикаторного электрода зависит от природы определяемого иона и типа химической реакции при титровании.
Техническая гальванопластика
Гальванопластика — направление прикладной электрохимии, направленное на создание изделий путем электрохимического осаждения металлов и сплавов на различные носители формы (формообразующие элементы) в жидких средах.
Принцип формирования металлического осадка на поверхности модели, такой же как и при гальваническом нанесении покрытий, но в отличии от классической гальваники (гальваностегии) – толщина формируемых металлических осадков может достигать нескольких сантиметров.
В первой половине 20 века применение гальванопластики с целью получения технических изделий превратилось в полноценную промышленную технологию получения сложных и точных изделий.
Правила построения градуировочного графика при фотометрическом анализе
Фотометрический анализ при контроле гальванических электролитов применяется для определения малых концентраций добавок и примесей, титриметрический анализ которых затруднён или нецелесообразен.
Распространёнными фотометрическими измерениями являются определения:
• солей хрома III в электролите хромирования и растворе хромитирования,
• общего кобальта и никеля в электролитах твёрдого золочения, серебрения и нанесения сплава «Никель-Кобальт»,
• висмута в электролите нанесения сплава «Олово-Висмут»,
• определение палладия в активаторе для металлизации диэлектриков,
• определение примесей меди, железа и никеля в различных электролитах,
• а также турбидиметрическое определение сульфатов в электролите хромирования и в сульфаматных электролитах для определения степени гидролиза сульфаматов и пр.
Физико-химические методы анализа основаны на взаимосвязи между составом системы и ее физическими и физико-химическими свойствами. Функциональная зависимость между численным значением данного физического или физико-химического свойства и содержанием анализируемого вещества может быть выражена графиком или формулой.
Основой для построения градуировочного графика является приготовление стандартных растворов.
Стандартные растворы необходимо готовить из аттестованных государственных образцов (ГСО). Если таковых не имеется, необходимо четко придерживаться основных требований к точности приготовления стандартных растворов:
• следует применять соединения квалификации не ниже ч.д.а;
• использование реактивов с просроченным сроком годности недопустимо;
• для приготовления стандартных растворов использовать только гостированную мерную посуду.
Особое внимание обратить на условия и сроки хранения растворов с содержанием вещества 1 мг/см3 хранят 1 год, 0,1 мг/см3 – 3 месяца (если нет других указаний, а также если нет помутнения, хлопьев, осадка), растворы с меньшим содержанием применяются свежеприготовленными. Стандартные растворы фильтровать не допускается.
Для определения содержания вещества методом градуировочного графика готовят 3 серии шкал стандартов. Указания по приготовлению шкалы стандартов конкретно оговорены в каждой методике.
При приготовлении параллельных шкал рабочие растворы готовят соответствующим разбавлением основного стандартного раствора, который готовится из одной взятой навески или ГСО.
Градуировочный график строят на миллиметровой бумаге или в электронной форме при помощи Excel, откладывая на оси абсцисс, указанную в методике определения концентрацию, а по оси ординат – измеренные значения оптической плотности.
Количественное значение оптической плотности для каждой точки градуировочного графика определяется как среднее арифметическое результатов параллельных измерений 3-х шкал.
С целью уменьшения погрешности графического измерения, необходимо подобрать такой масштаб графика, чтобы угол его наклона приблизительно равнялся 45º.
Градуировочный график должен нести следующую информацию:
• НД на метод проведения исследования;
• марка КФК, его заводской номер;
• длина рабочей грани кюветы;
• раствор сравнения (растворитель, нулевой раствор и т.д.), т.е. относительно чего снимались показания испытуемого раствора;
• на графике должны присутствовать данные 3-х параллельных измерений и среднее арифметическое значение (в виде таблицы).
Градуировочный график строится один раз в год и после ремонта прибора. Поверка графика должна проводиться 1 раз в квартал (если нет других указаний в методике определения), а также после приготовления реактивов из новой партии, поверки прибора. Поверка проводится по 3-м точкам графика наиболее часто встречающихся в работе концентраций. Данные поверки заносятся в журнал поверок градуировочных графиков или наносятся на обратную сторону графика в виде таблицы.
Несмотря на простоту и удобство, практическое использование градуировочных графиков в ряде случаев вносит дополнительную погрешность при определении концентрации растворов как за счет субъективного построения графической зависимости, так и за счет несоответствия графичеких (масштабных) погрешностей и погрешностей измерения оптических плотностей. Поэтому для получения более объективных результатов в фотометрическом анализе целесообразно построение градуировочного графика методом регрессивного анализа (уравнение регрессии).
Описание метода наименьших квадратов и пример построение уточнённого градуировочного графика на примере фотометрического определения железа – здесь.
Дополнение для приборов, имеющих стрелочное регистрирующее устройство:
На многих предприятиях до сих пор в эксплуатации находятся приборы, при работе на которых значение измеренного пропускания отсчитывают по стрелочному прибору. Эти устройства являются обычным источником погрешности именно при отсчитывании показаний. Для правильно сконструированного стрелочного прибора погрешность при отсчёте будет постоянной и, возможно, равной толщине стрелки, которая соответствует определённому отсчёту по шкале прибора. При допущении, что отсчёты пропускания, полученные каждым таким устройством, имеют постоянную недостоверность (обусловленную изменением мощности источника света, характеристиками детектора, электрическими шумами, положением кюветы, и обычно приводящую к суммарной погрешности от 0,2 до 1%), можно рассчитать погрешность, которую вызовет ненадёжность при регистрации концентрации определяемых частиц.
Для расчёта концентрационной погрешности необходимо изучить влияние недостоверности измерения пропускания на вычисленное значение концентрации. Для этого запишем закон Бера в форме, которая показывает, что зависимость от концентрации является экспоненциальной:
T = P/P0 = 10-abC, где (1)
b– толщина поглощающего слоя раствора в кювете,
С – концентрация оптически активного вещества,
а – удельная поглощательная способность, зависящая от природы вещества.
Из графика этой зависимости на рисунке можно определить, какое влияние на рассчитанное значение С окажет постоянная погрешность в пропускании.
Сначала рассмотрим спектрофотометрическое измерение раствора с низкой концентрацией (С1) определяемых частиц. Согласно рисунку этот раствор будет иметь высокое значение пропускание (Т1). Допуская, что недостоверность при отсчёте стрелочного прибора соответствует постоянной абсолютной погрешности в Т, можно определить из рисунка результирующую погрешность в определение С. Из экстраполирования линии видно, что абсолютная погрешность в концентрации (ΔС1) мала, когда раствор имеет высокое пропускание. Однако поскольку сама концентрация (С1) мала, относительная погрешность в концентрации (ΔС1/С1) довольно велика.
Теперь рассмотрим случай, когда имеется высокая концентрация (С2) определяемого вещества. Этот раствор будет иметь относительно низкое значение пропускания (Т2). Если снова допустить наличие постоянной погрешности в Т, то получим большую абсолютную погрешность (ΔС2) в концентрации, и хотя концентрация велика, относительная погрешность (ΔС2/С2) также будет велика.
Эти результаты свидетельствуют, что где-то между экстремальными значениями концентрации в пробах, имеющих высокие и низкие пропускания, должно существовать значение пропускания, для которого относительная погрешность в концентрации (ΔС/С) минимальна. В действительности относительная погрешность минимальна при 36,8%-ном пропускании. К этому выводу можно прийти и расчётным путём, вспомнив определение понятия поглощения:
А = lg (1/T) = 1/2,303 ln(1/T) = 0,434 ln (1/T) (2)
Если это уравнение продифференцировать относительно Т, то получим
Для того чтобы оценить относительную погрешность в значении поглощения и тем самым в концентрации, необходимо разделить каждую часть уравнения (3) на поглощение (А). Тогда
dA/А = (-0,434/TА) dT= (0,434/TlgT) dT (4)
Чтобы найти относительную погрешность в концентрации, заменим в этом уравнении А соответствующей величиной согласно закону Ламберта-Бера (1):
d(abC)/abC = (ab)dC/abC = dC/C = (0,434/T lgT) dT (5)
Уравнение (5) показывает, что относительная погрешность в концентрации (dC/C) непосредственно зависит от абсолютной недостоверности в пропускании (dT), а также от обратной величины произведения (TlgT), включающего значение самого пропускания. Графическая зависимость этого уравнения, показывающая относительную погрешность в концентрации (dC/C) как функцию пропускания (в %) при постоянной погрешности в отсчёте (dT), равной 1%, показана на рисунке:
Из рисунка видно, что относительная погрешность в концентрации достаточно низка при пропусканиях между 20 и 70%, но при переходе к очень низким или высоким значениям пропускания погрешность резко возрастает. Можно найти минимальную относительную погрешность в концентрации путём дифференцирования уравнения (5) и приравнивая выражения к нулю. Как указано ранее, минимальная погрешность имеет месть при 36,8%-ном пропускании или при поглощении, равном 0,434. Поэтому для спектрофотометров, имеющих стрелочное регистрирующее устройство, можно проводить измерение с наименьшей погрешностью, если отсчёты по шкале ограничены пределом от 20% до 70% пропускания (или от 0,7 до 0,2 единиц поглощения), а в оптимальном случае эти расчёты приближаются к значениям 36,8% пропускания или к 0,434 единиц поглощения. Обычно можно соблюдать эти ограничения путём соответствующего выбора толщины поглощающего слоя пробы (b) или путём разбавления раствора пробы, взятого для анализа.
Приведённые выше рассуждения применимы только к измерениям на спектрофотометрах, имеющих постоянную погрешность, связанную с отсчётом пропускания. Современные приборы обладают цифровой регистрацией, погрешность отсчёта не является для них фактором, лимитирующим правильность.
1) Переярченко П.В., Афанасьева О.Л., Замковая Л.А., Махоня Т.В., Гольнева Л.Н. Информационное письмо о правилах построения градуировочных графиков при фотоколориметрических методах исследования.
2) Петерс Д., Хайес Дж., Хифтье Г. Химическое разделение и измерение. Теория и практика аналитической химии. – М.: «Химия», 1978. – 816 с.
3) Булатов М.И., Малинкин И.П. Практическое руководство по фотометрическим методам анализа, Ленинград, Химия, 1986;
4) Справочник по физико-химическим методам исследования объектов окружающей среды под редакцией Арановича Г.И., Ленинград, Судостроение, 1979;
5) Новиков Ю.В., Ласточкина К.О., Болдина З.Н. Методы исследования качества воды водоемов, Москва, Медицина, 1990;
6) ГОСТ 4212–76 «Реактивы. Методика приготовления растворов для колориметрического, нефелометрического и других видов анализа».
Метод градуировочного графика



Метод градуировочного графика – это графический приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы (Iх).
Для проведения анализа готовят серию стандартных растворов, измеряют величины АС этих растворов и строят градуировочный график I = f(C) (рис.6).
Рис. 6. Определение неизвестной концентрации методом градуировочного графика.
Затем в точно таких же условиях измеряют аналитический сигнал пробы Iх и по графику определяют концентрацию анализируемого вещества в пробе Сх.
Метод стандартов (метод молярного свойства)
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности (рис. 5).
1. Метододного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст, затем измеряют величины АС этого раствора (Iст) и пробы (Iх) в одинаковых условиях.
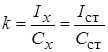
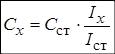
2. Метод двух стандартов (ограничивающих растворов). Для проведения анализа готовят серию стандартных растворов и измеряют величины АС этих растворов и пробы в одинаковых условиях. Затем выбирают два стандартных раствора – «ограничивающие растворы» – так, чтобы С1