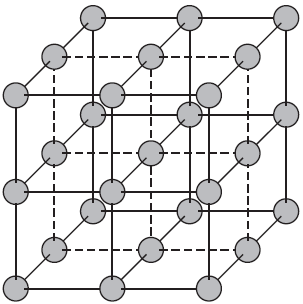
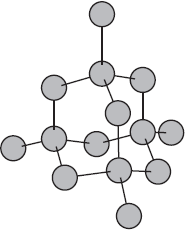
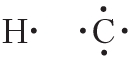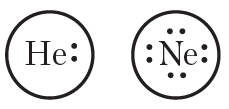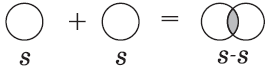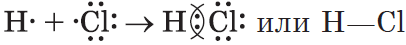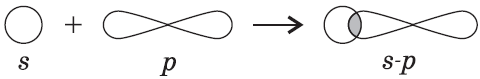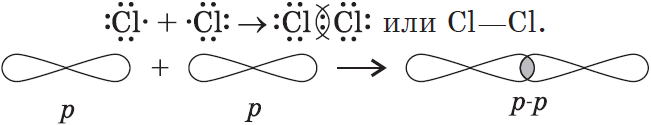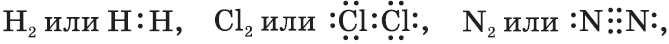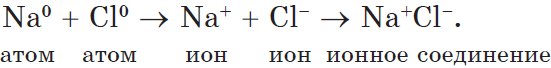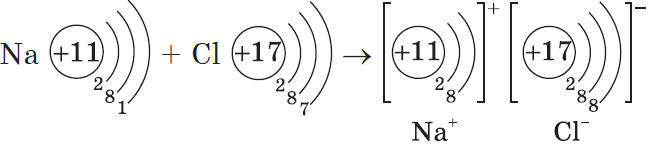Что взаимодействие связывает в химической связи в молекулы и кристаллы
Химия. 10 класс
§ 3. Типы химической связи
Типы химической связи
Из курса химии 7–9-го классов вы знаете, что при обычных условиях атомы большинства химических элементов в свободном виде (по отдельности) не существуют. Даже в простых веществах атомы связаны друг с другом химическими связями. Исключением являются лишь благородные газы.
Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: 
| Химическая связь — взаимодействие, связывающее отдельные атомы в химические соединения (молекулы или кристаллы). |
Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешнего энергетического уровня. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают символ химического элемента. Такие формулы называются электронными формулами.
электронные формулы атомов водорода и углерода
Окружность вокруг электронной формулы указывает на завершённость внешнего слоя. То есть атом гелия имеет завершённую двухэлектронную, а атом неона — восьмиэлектронную внешнюю оболочку. Отсюда следует важный вывод — атомы будут стремиться сформировать стабильные завершённые электронные оболочки за счёт отдачи, присоединения либо обобществления электронов. При этом образуются химические связи.
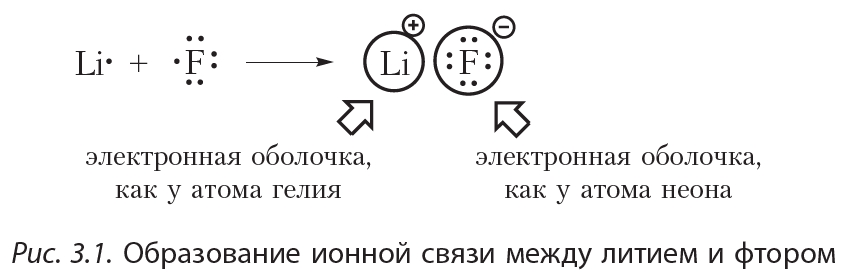
Пример 1. Образование ионной связи между литием и фтором.
На внешнем электронном слое атома лития находится один электрон, поэтому атом лития легко отдаёт этот электрон, приобретая завершённую электронную оболочку, как у ближайшего благородного газа — гелия. На внешнем слое атома фтора располагается семь электронов, поэтому фтор, наоборот, легко присоединяет один электрон, приобретая завершённую восьмиэлектронную внешнюю оболочку, как у атома неона:
Разноимённо заряженные ионы притягиваются друг к другу. Такая связь называется ионной. Ионная связь образуется между атомами металла и неметалла. Ионная связь имеется в солях (NaCl, KF), оксидах металлов (Na2O, K2O), гидроксидах металлов (NaOH, KOH).
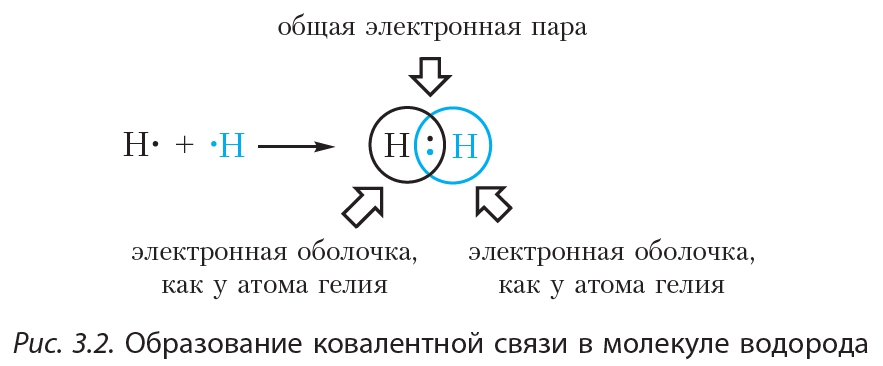
Пример 2. Образование ковалентной связи в молекуле водорода H2.
На внешнем слое атома водорода имеется один неспаренный электрон. Поскольку при образовании молекулы водорода между собой взаимодействуют одинаковые атомы, электрон не будет переходить от одного атома к другому и разноимённо заряженные ионы образовываться не будут. Вместо этого неспаренные электроны двух атомов водорода образуют общую электронную пару. При этом каждый атом водорода приобретает завершённую электронную оболочку, как у атома гелия:
Связь, образованную посредством общих электронных пар, называют ковалентной. В формулах ковалентную связь (общую электронную пару) обозначают чёрточкой. Например, формулу молекулы водорода можно записать 
Ковалентная связь образуется между атомами неметаллов. Ковалентная связь имеется в простых веществах неметаллов (H2, Cl2, O2, N2), оксидах неметаллов (CO2, SO2), кислотах (HCl, H2SO4).
Мы рассмотрели два типа химической связи — ковалентную и ионную. Ковалентная связь образуется между атомами неметаллов. Посредством ионной связи соединяются металлы с неметаллами.
При взаимодействии атомов металлов друг с другом возникает третий тип химической связи — металлическая связь. Подробно с этим типом связи вы знакомились в курсе химии 9-го класса. Напомним, что металлическая связь имеется в простых веществах, образованных металлами, например Na, K, Fe, и в металлических сплавах.
Существует три типа химической связи: ковалентная, ионная и металлическая.
Ковалентная связь образуется между атомами неметаллов в простых веществах ( H 2, F2, O 2 ), оксидах неметаллов ( H 2O, CO 2 ), кислотах ( HF, HCl, H 2SO4, HNO 3 ).
Ионная связь образуется между атомами металла и неметалла в солях ( NaCl, KF ), оксидах металлов ( K 2 O, BaO ), гидроксидах металлов ( NaOH, KOH ).
Металлическая связь образуется между атомами металлов в простых веществах ( Na, K, Cu ) и металлических сплавах.
Строение молекул. Химическая связь: ковалентная(полярная и неполярная), ионная, металлическая
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Различные типы связей могут содержаться в одних и тех же веществах, например:
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
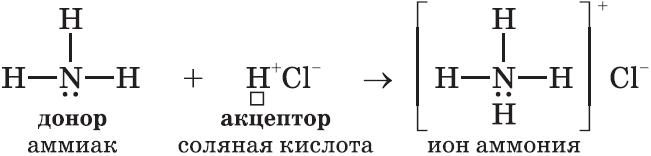
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
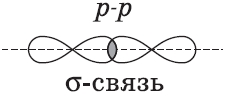
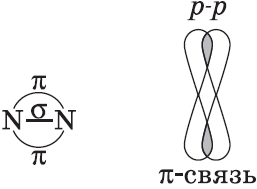
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
$p-$Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
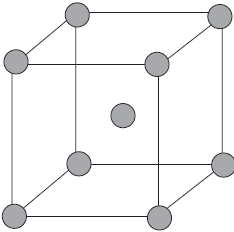
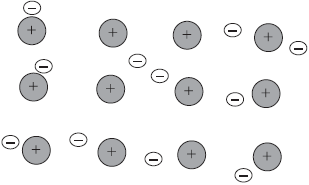
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Характеристики химических связей. Зависимость свойств веществ от их состава и строения
Теория к заданию 4 из ЕГЭ по химии
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Различные типы связей могут содержаться в одних и тех же веществах, например:
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
$p-$Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.