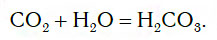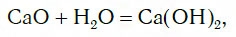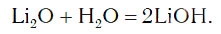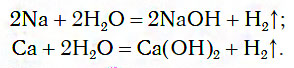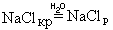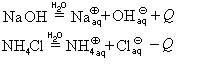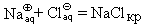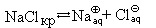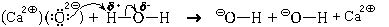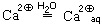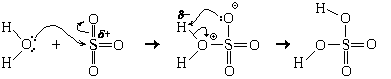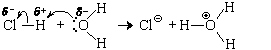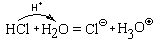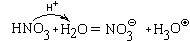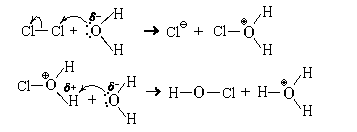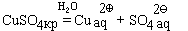Что взаимодействует с водой
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Урок №31. Физические и химические свойства воды. Применение воды
ВОДА
Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104,5°.
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения с молекулярной формулой Н 2 О.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочноземельными металлами. Вода образует соединения – кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H 2 O электрический ток = 2H 2 ↑+ O 2 ↑
I. Взаимодействие воды с металлами
Щелочные металлы – это I(А) группа – Li, Na, K, Rb, Cs, Fr
Щелочноземельные металлы – это II(А) – Ca, Sr, Ba, Ra (Be, Mg не относятся)
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Например, бериллий с водой образует амфотерный оксид: Be + H 2 O = BeO + H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие воды c неметаллами
Cl 2 + H 2 O = HCl + HClO
C + H 2 O = t°С = CO + H 2
Si + 2H 2 O = t°С = SiO 2 + 2H 2
III. Взаимодействие с оксидами металлов
1). Взаимодействие с основными оксидами
Реакция соединения протекает при обычных условиях, при этом образуется растворимое основание – щёлочь.
H 2 O + ОКСИД МЕТАЛЛА = Ме(ОН) n (р. соединения)
Na 2 O + H 2 O = 2NaOH
BaO + H 2 O = Ba(OH) 2
Al 2 O 3 + H 2 O ≠ нет реакции
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
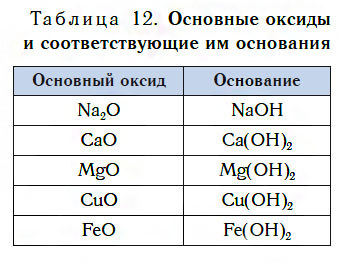
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
в) по катиону и по аниону соли
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)
Что взаимодействует с водой
11.1. Физическое растворение
При попадании какого-либо вещества в воду оно может:
а) раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
б) вступить с водой в химическую реакцию;
в) не раствориться и не прореагировать.
От чего же зависит результат взаимодействия вещества с водой? Естественно, от характеристик вещества и от характеристик воды.
Начнем с растворения и рассмотрим, какие характеристики воды и взаимодействующих с ней веществ имеют наибольшее значение в этих процессах.
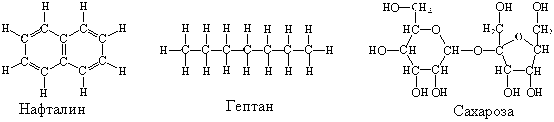
Поместим в две пробирки по небольшой порции нафталина С10Н8. Нальем в одну из пробирок воду, а в другую – гептан С7Н16 (можно вместо чистого гептана использовать бензин). Нафталин в гептане растворится, а в воде – нет. Проверим, действительно ли нафталин растворился в гептане или прореагировал с ним. Для этого поместим несколько капель раствора на стекло и подождем, пока гептан испарится – на стекле образуются бесцветные пластинчатые кристаллики. В том, что это нафталин, можно убедиться по характерному запаху.
Одно из отличий гептана от воды в том, что его молекулы неполярны, а молекулы воды полярны. Кроме того, между молекулами воды есть водородные связи, а между молекулами гептана их нет.
Для растворения нафталина в гептане требуется разорвать слабые межмолекулярные связи между молекулами нафталина и слабые межмолекулярные связи между молекулами гептана. При растворении образуются столь же слабые межмолекулярные связи между молекулами нафталина и гептана. Тепловой эффект такого процесса практически равен нулю.
За счет чего же нафталин растворяется в гептане? Только за счет энтропийного фактора (растет беспорядок в системе нафталин – гептан).
Для растворения нафталина в воде необходимо, кроме слабых связей между его молекулами, разорвать водородные связи между молекулами воды. При этом водородные связи между молекулами нафталина и воды не образуются. Процесс получается эндотермическим и настолько энергетически невыгодным, что энтропийный фактор здесь помочь не в силах.
А если вместо нафталина взять другое вещество, молекулы которого способны образовывать водородные связи с молекулами воды, то будет ли такое вещество растворяться в воде?
Если нет других препятствий, то будет. Например, вы знаете, что сахар (сахароза С12Н22О11) прекрасно растворим в воде. Посмотрев на структурную формулу сахарозы, вы увидите, что в ее молекуле есть группы –О–Н, способные образовывать водородные связи с молекулами воды.
Убедитесь экспериментально, что сахароза малорастворима в гептане, и попробуйте самостоятельно объяснить, почему так различаются свойства нафталина и сахарозы.
Растворение нафталина в гептане и сахарозы в воде называют физическим растворением.
| Физическое растворение – растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). |
Физически растворяться могут только молекулярные вещества.
| Растворитель – вещество, которое до образования раствора находилось в том же агрегатном состоянии, что и образовавшийся раствор. |
Другие компоненты раствора называются растворенными веществами.
Выявленные нами закономерности относятся и к случаям растворения в воде (да и в большинстве других растворителей) жидких и газообразных веществ. Если все вещества, образующие раствор, до растворения находились в одном агрегатном состоянии, то растворителем обычно называют то вещество, которого в растворе больше. Исключение из этого правила – вода: ее обычно называют растворителем, даже если ее меньше, чем растворенного вещества.
Причиной физического растворения вещества в воде может быть не только образование водородных связей между молекулами растворяемого вещества и воды, но и образование других видов межмолекулярных связей. Так бывает прежде всего в случае растворения в воде газообразных веществ (например, углекислого газа или хлора), в которых молекулы вообще не связаны друг с другом, а также некоторых жидкостей с очень слабыми межмолекулярными связями (например, брома). Выигрыш в энергии достигается здесь за счет ориентации диполей (молекул воды) вокруг полярных молекул или полярных связей в растворяемом веществе, а в случае хлора или брома –вызван склонностью к присоединению электронов атомов хлора и брома, сохраняющейся и в молекулах этих простых веществ (подробнее –в § 11.4).
Во всех этих случаях вещества значительно хуже растворяются в воде, чем при образовании водородных связей.
Если из раствора удалить растворитель (например так, как вы это делали в случае раствора нафталина в гептане), то растворенное вещество выделится в химически неизменном виде.

2.Подскажите знак теплового эффекта растворения в воде этилового спирта (этанола).
3.Почему аммиак хорошо растворим в воде, а кислород – плохо?
4.Какое вещество лучше растворимо в воде – аммиак или фосфин (PH3)?
5.Объясните причину лучшей растворимости в воде озона, чем кислорода.
6.Определите массовую долю глюкозы (виноградного сахара, С6Н12О6) в водном растворе, если для его приготовления использовали 120 мл воды и 30 г глюкозы (плотность воды примите равной 1 г/мл). Какова концентрация глюкозы в этом растворе, если плотность раствора равна 1,15 г/мл?
7.Сколько сахара (сахарозы) можно выделить из 250 г сиропа с массовой долей воды, равной 35 %?.
2. Приготовление растворов.
В первом параграфе мы рассмотрели случаи растворения веществ, при которых химические связи оставались неизменными. Но так бывает далеко не всегда.
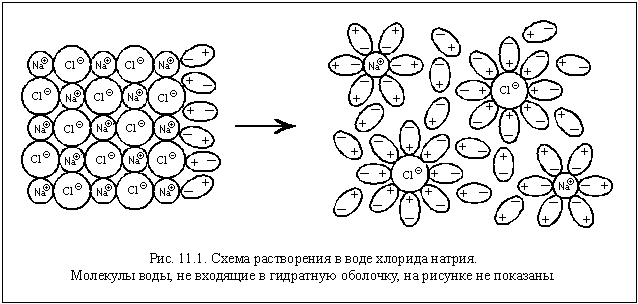
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество немолекулярное. Кристалл NaCl состоит из ионов Na 
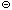
| Гидратная оболочка – окружение иона, состоящее из одного или нескольких слоев определенным образом ориентированных молекул воды. |
В виде уравнения реакции это можно записать так:
NaClкр + (n + m)H2O = [Na(H2O)n] 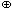
или сокращенно 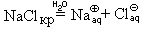
Можно записать и «молекулярное» уравнение этого процесса:(такое название сохранилось с тех пор, когда предполагалось, что все вещества состоят из молекул)
Гидратация – процесс образования гидратной оболочки.
Гидратированные ионы слабее притягиваются друг к другу, и энергии теплового движения оказывается достаточно для того, чтобы эти ионы не слипались в кристалл.
Практически наличие ионов в растворе легко подтвердить, изучив электропроводность хлорида натрия, воды и получившегося раствора. Вы уже знаете, что кристаллы хлорида натрия электрический ток не проводят, потому что в них хоть и есть заряженные частицы – ионы, но они » закреплены» в кристалле и не могут двигаться. Вода проводит электрический ток очень плохо, потому что в ней хоть и образуются за счет автопротолиза ионы оксония и гидроксид-ионы, но их очень мало. Раствор хлорида натрия, наоборот, хорошо проводит электрический ток, потому что в нем много ионов, и они могут свободно двигаться, в том числе под действием электрического напряжения.
Для разрыва ионных связей в кристалле и водородных связей в воде необходимо затратить энергию. При гидратации ионов энергия выделяется. Если затраты энергии на разрыв связей превышают энергию, выделяющуюся при гидратации ионов, то растворение эндотермическое, а если наоборот, то – экзотермическое.
Хлорид натрия растворяется в воде с практически нулевым тепловым эффектом, следовательно, растворение этой соли происходит только за счет увеличения энтропии. Но обычно растворение сопровождается заметным выделением теплоты (Na2CO3, CaCl2, NaOH и др.) или ее поглощением (KNO3, NH4Cl и др.), например:
При выпаривании воды из растворов, получившихся при химическом растворении, из них вновь выделяются растворенные вещества в химически неизменном виде.
| Химическое растворение – растворение, при котором происходит разрыв химических связей. |
И при физическом, и при химическом растворении образуется раствор того вещества, которое мы растворяли, например, раствор сахара в воде или раствор хлорида натрия в воде. Иными словами, растворенное вещество может быть выделено из раствора при удалении воды.
Любая порция помещенного в воду хлорида натрия (или другого подобного вещества) всегда растворялась бы полностью, если бы кроме процесса растворения
не протекал бы обратный процесс – процесс кристаллизации исходного вещества из раствора:
В момент помещения кристалла в воду скорость процесса кристаллизации равна нулю, но, по мере увеличения концентрации ионов в растворе, она увеличивается и в какой-то момент становится равной скорости растворения. Наступает состояние равновесия:
образовавшийся при этом раствор называется насыщенным.
| Насыщенный раствор – раствор, находящийся в равновесии с растворяемым веществом. |
| Растворимость вещества (в данном растворителе) – характеристика состава насыщенного раствора этого вещества. |

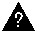
2.Определите массовую долю нитрата калия в насыщенном при 20 °С водном растворе этой соли, если при приготовлении такого раствора к 200 г воды прибавили 100 г нитрата калия, и при этом после окончания приготовления раствора 36,8 г нитрата калия не растворилось.
3.Можно ли при 20 °С приготовить водный раствор хромата калия K2CrO4 с массовой долей растворенного вещества, равной 45 %, если при этой температуре в 100 г воды растворяется не более 63,9 г этой соли.
4.Массовая доля бромида калия в насыщенном водном растворе при 0 °С равна 34,5 %, а при 80 °С – 48,8 %. Определите массу бромида калия, выделившегося при охлаждении до 0 °С 250 г насыщенного при 80°С водного раствора этой соли.
5.Массовая доля гидроксида кальция в насыщенном водном растворе при 20 °С равна 0,12 %. Сколько литров насыщенного при этой температуре раствора гидроксида кальция (известковой воды) можно получить, имея в своем распоряжении 100 г гидроксида кальция? Плотность раствора примите равной 1 г/мл.
6.При 25 °C массовая доля сульфата бария в насыщенном водном растворе составляет 2,33·10 –2 %. Определите минимальный объем воды, необходимой для полного растворения 1 г этой соли.
Многие вещества при соприкосновении с водой вступают с ней в химические реакции. В результате такого взаимодействия при избытке воды, как и при растворении, получается раствор. Но если из этого раствора удалить воду, исходного вещества мы не получим.
Какие продукты образуются при химической реакции вещества с водой? Это зависит от типа химической связи в веществе; если связи ковалентные, то от степени полярности этих связей. Кроме этого, влияние оказывают и другие факторы, с некоторыми из которых мы познакомимся.
а) Соединения с ионной связью
Большинство ионных соединений либо химически растворяются в воде, либо не растворяются. Особняком стоят ионные гидриды и оксиды, то есть соединения, содержащие те же элементы, что и сама вода, и некоторые другие вещества. Поведение ионных оксидов при контакте с водой рассмотрим на примере оксида кальция.
Оксид кальция, будучи ионным веществом, мог бы химически растворяться в воде. При этом в раствор переходили бы ионы кальция и оксид-ионы. Но двухзарядный анион – не самое устойчивое валентное состояние атома кислорода (хотя бы потому, что энергия сродства ко второму электрону всегда отрицательна, да и радиус оксид-иона сравнительно мал). Поэтому атомы кислорода стремятся понизить свой формальный заряд. В присутствии воды это оказывается возможным. Оказавшиеся на поверхности кристалла оксид-ионы взаимодействуют с молекулами воды. Эту реакцию можно представить в виде схемы, показывающей ее механизм (схемы механизма).
Для лучшего понимания происходящего условно разделим этот процесс на этапы:
1. Молекула воды поворачивается к оксидному иону атомом водорода (противоположно заряжены).
2. Оксид-ион делится с атомом водорода неподеленной парой электронов; между ними образуется ковалентная связь (образуется по донорно-акцепторному механизму).
3. У атома водорода на единственной валентной орбитали (1s) оказывается четыре электрона (два «старых» и два «новых»), что противоречит принципу Паули. Поэтому атом водорода отдает пару электронов связи («старых» электронов) атому кислорода, входящему в состав молекулы воды, тем более что эта пара электронов и так была в значительной степени смещена к атому кислорода. Связь между атомом водорода и атомом кислорода разрывается.
4. За счет образования связи по донорно-акцепторному механизму формальный заряд на бывшем оксидном ионе становится равным –1 е; на атоме кислорода, входившем прежде в состав молекулы воды, появляется заряд, также равный –1 е. Таким образом образуются два гидроксидных иона.
5. Не связанные теперь ионной связью с оксид-ионами ионы кальция переходят в раствор и гидратируются:
Положительный заряд ионов кальция как бы «размывается» по всему гидратированному иону.
6. Образовавшиеся гидроксид-ионы тоже гидратируются:
Отрицательный заряд гидроксид-иона при этом тоже «размывается».
Суммарное ионное уравнение реакции оксида кальция с водой
CaOкр + H2O 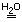
aq + 2OH
В растворе появляются ионы кальция и гидроксид-ионы в соотношении 1:2. То же самое получилось бы при растворении в воде гидроксида кальция. И действительно, выпарив воду и высушив остаток, мы можем получить из этого раствора кристаллический гидроксид кальция (но отнюдь не оксид!). Поэтому часто уравнение этой реакции записывают так:
и называют » молекулярным » уравнением этой реакции. И в тех, и в других уравнениях буквенные индексы иногда не приводят, что часто сильно затрудняет понимание происходящих процессов, а то и просто вводит в заблуждение. Вместе с тем, отсутствие буквенных индексов в уравнениях допустимо, например, при решении расчетных задач
Кроме оксида кальция, точно также взаимодействуют с водой следующие оксиды: Li2O, Na2O, K2O, Rb2O, Cs2O, SrO, BaO – то есть оксиды тех металлов, которые и сами реагируют с водой. Все эти оксиды относятся к основным оксидам. Остальные ионные оксиды с водой не реагируют.
Совершенно аналогично реагируют с водой и ионные гидриды, например, гидрид натрия NaH. Ион натрия только гидратируется, а гидрид-ион реагирует с молекулой воды:
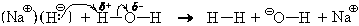
В результате в растворе остается гидроксид натрия.
Ионное уравнение этой реакции
NaHкр + H2O = Na 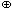
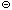
,
а » молекулярное» уравнение – NaHкр + H2O = NaOHр + H2 .
б) Вещества с металлической связью
В качестве примера рассмотрим взаимодействие с водой натрия.
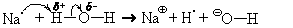
На схемах кривая полустрелка означает передачу или перемещение о д н о г о э л е к т р о н а
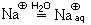
так же, как и ион натрия, гидратируется гидроксид-ион 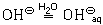
Из-за неполярности своих молекул водород в воде практически нерастворим и выделяется из раствора в виде газа. Ионное уравнение этой реакции
2Naкр + 2H2O = 2Na 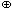
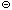
2Naкр + 2H2O = 2NaOHр + H2
Так же, как натрий, при комнатной температуре с водой бурно реагируют Li, К, Rb, Cs, Ca, Sr, Ba. При нагревании с ней реагирует и Mg, а также некоторые другие металлы.
в) Вещества с ковалентными связями
Аналогично, но несколько более сложно с водой реагирует N2O5, P4O10 и некоторые другие молекулярные оксиды. Все они – кислотные оксиды.
N2O5 + H2O = 2HNO3;
P4O10 + 6H2O = 4H3PO4.
Во всех этих реакциях образуются кислоты, которые при наличии избытка воды с ней реагируют. Но, прежде чем рассмотреть механизм этих реакций, посмотрим, как реагирует с водой хлороводород – молекулярное вещество с сильно полярными ковалентными связями между атомами водорода и хлора:
HClг + H2O = H3O 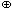
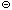
При низких температурах из такого раствора может быть выделен кристаллический хлорид оксония (H3O)Cl (tпл = –15 °С).
Взаимодействие HCl и H2O можно представить себе и по-другому:
то есть как результат передачи протона от молекулы хлороводорода к молекуле воды. Следовательно, это кислотно-основная реакция.
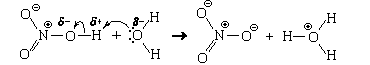
Аналогично происходит взаимодействие с водой азотной кислоты
что тоже можно представит как передачу протона:
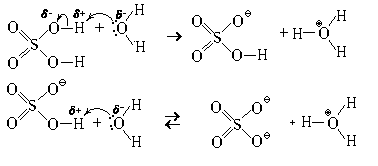
Кислоты, в молекулах которых несколько гидроксилов (OH-групп), реагируют с водой в несколько стадий (ступенчато). Пример – серная кислота.
Второй протон отщепляется значительно труднее, чем первый, поэтому вторая стадия этого процесса обратима. Сравнив величину и распределение зарядов в молекуле серной кислоты и в гидросульфат-ионе, попробуйте самостоятельно объяснить это явление.
При охлаждении из растворов серной кислоты могут быть выделены индивидуальные вещества: (H3O)HSO4 (tпл = 8,5 °С) и (H3O)2SO4 (tпл = – 40 °С).
Анионы, образующиеся из молекул кислот после отрыва одного или нескольких протонов, называются кислотными остатками.
Из молекулярных простых веществ с водой при обычных условиях реагируют только F2, Cl2, Br2 и, в крайне незначительной степени, I2. Фтор бурно реагирует с водой, полностью ее окисляя:
При этом протекают также и другие реакции.
Значительно важнее реакция хлора с водой. Обладая высокой склонностью к присоединению электронов (молярная энергия сродства к электрону атома хлора равна 349 кДж/моль), атомы хлора частично сохраняют ее и в молекуле (молярная энергия сродства к электрону молекулы хлора равна 230 кДж/моль). Поэтому, растворяясь, молекулы хлора гидратируются, притягивая к себе атомы кислорода молекул воды. У некоторых из этих атомов кислорода атомы хлора могут акцептировать неподеленную пару электронов. Дальнейшее показано на схеме механизма:
Суммарное уравнение этой реакции
Cl2 + 2H2O = HClO + H3O 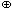
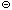
Но реакция обратима, поэтому устанавливается равновесие:
Cl2 + 2H2O 
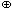
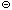
Cl2 + H2O 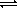
Аналогично с водой реагирует бром, только равновесие в этом случае сильно смещено влево. Йод же с водой практически не реагирует.
Чтобы представить себе, в какой степени хлор и бром физически растворяются в воде, а в какой – реагируют с ней, используем количественные характеристики растворимости и химического равновесия.
Мольная доля хлора в насыщенном при 20°С и атмосферном давлении водном растворе равна 0,0018, то есть на каждую 1000 молекул воды приходится примерно 2 молекулы хлора. Для сравнения, в насыщенном при тех же условиях растворе азота мольная доля азота равна 0,000012, то есть одна молекула азота приходится примерно на 100000 молекул воды. А для получения насыщенного при тех же условиях раствора хлороводорода на каждые 100 молекул воды нужно взять около 35 молекул хлороводорода. Отсюда можно сделать вывод, что хлор хоть и растворим в воде, но незначительно. Растворимость брома несколько больше – примерно 4 молекулы на 1000 молекул воды.
Константа равновесия обратимой химической реакции хлора с водой
Cl2 + 2H2O 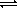

2.Изобразите схему, иллюстрирующую механизм взаимодействия с водой кальция.
3.Почему металлы IА группы бурно реагируют с водой, а медь, железо, хром или свинец практически не реагируют?
4.Составьте ионные и » молекулярные» уравнения реакций с водой оксидов натрия, стронция и бария. Для реакции с водой оксида лития приведите схему, иллюстрирующую ее механизм.
5.Приведите уравнения реакций, позволяющих осуществить следующие превращения:
а) Li Li2O
LiOH; б) Ca
CaO
Ca(OH)2.
6.Составьте уравнения реакций, по которым можно получить а) хромовую кислоту (H2CrO4) из оксида хрома(VI), б) йодноватую кислоту (HIO3) из оксида йода(V), в) селеновую кислоту (H2SeO4) из оксида селена (VI).
7.Приведите уравнения реакций, позволяющих осуществить следующие превращения:
а) S SO2
SO3
H2SO4 ;
б) P P4O10
H3PO4.
8.Что происходит при » растворении» в воде бромоводорода? Ответ проиллюстрируйте уравнениями реакций.
9.Запишите уравнение обратимой реакции брома с водой и составьте схемы механизмов прямой и обратной реакций.
При химическом растворении ионных веществ происходит гидратация переходящих в раствор ионов. Гидратируются как катионы, так и анионы. Как правило, гидратированные катионы прочнее, чем анионы, а гидратированные простые катионы — прочнее, чем сложные. Это связано с тем, что у простых катионов есть свободные валентные орбитали, которые могут частично акцептировать неподеленные электронные пары атомов кислорода, входящих в молекулы воды.
При попытке выделить исходное вещество из раствора, удаляя воду, получить его часто не удается. Например, если мы растворим в воде бесцветный сульфат меди CuSO4, то получим раствор голубого цвета, который придают ему гидратированные ионы меди:
После упаривания раствора (удаления воды) и охлаждения из него выделятся кристаллы синего цвета, имеющие состав CuSO4· 5H2O (точка между формулами сульфата меди и воды означает, что на каждую формульную единицу сульфата меди приходится указанное в формуле число молекул воды). Исходный сульфат меди можно получить из этого соединения, нагрев его до 250 ° С. При этом происходит реакция:
CuSO4· 5H2O = CuSO4 + 5H2O .
| Кристаллогидраты — вещества, включающие в себя обособленные частицы H2O, в которых атомы кислорода связаны с двумя атомами водорода ковалентными связями, а частицы Н2О в целом связаны с другими атомами либо химическими, либо межмолекулярными связями. |
При образовании кристаллогидратов из исходных веществ и воды в молекулах воды не происходит разрыва связей О—Н.
Если кристаллизационная вода удерживается в кристаллогидрате слабыми межмолекулярными связями, то она легко удаляется при нагревании:
Na2CO3· 10H2O = Na2CO3 + 10H2O (при 120 ° С);
K2SO3· 2H2O = K2SO3 + 2H2O (при 200 ° С);
CaCl2· 6H2O = CaCl2 + 6H2O (при 250 ° С).
Если же в кристаллогидрате связи между молекулами воды и другими частицами близки к химическим, то такой кристаллогидрат или дегидратируется (теряет воду) при более высокой температуре, например:
Al2(SO4)3· 18H2O = Al2(SO4)3 + 18H2O (при 420 ° С);
СoSO4· 7H2O = CoSO4 + 7H2O (при 410 ° С);
или при нагревании разлагается с образованием других химических веществ, например:
2
2
Таким образом, взаимодействие с водой безводных веществ, образующих кристаллогидраты, может быть как химическим растворением, так и химической реакцией.

2.Определите состав кристаллогидрата сульфата магния, если массовая доля воды в нем равна 51,2%. 3.Какова масса воды, выделившейся при прокаливании декагидрата сульфата натрия (Na2SO4· 10H2O) массой 644 г?
4.Сколько безводного хлорида кальция можно получить, прокаливая 329 г гексагидрата хлорида кальция?
5.Дигидрат сульфата кальция CaSO4· 2H2О при нагревании до 150° С теряет 3/4 своей воды. Составьте формулу образующегося кристаллогидрата (алебастра) и запишите уравнение превращения гипса в алебастр.
6.Определите массу медного купороса и воды, которые необходимо взять для приготовления 10 кг 5 %-го раствора сульфата меди.
7.Определите массовую долю сульфата железа(II) в растворе, полученном при смешении 100 г железного купороса (FeSO4· 7H2O) с 9900 г воды. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору