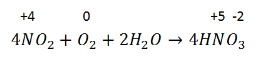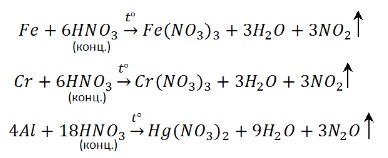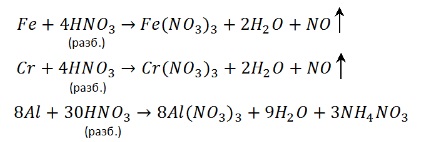что значит концентрированная серная кислота
Химия, Биология, подготовка к ГИА и ЕГЭ
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
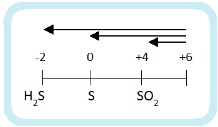
Раз сера – окислитель, то она будет восстанавливаться:
Глубина восстановления серы зависит от активности восстановителя:
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:
2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:
3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:
А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
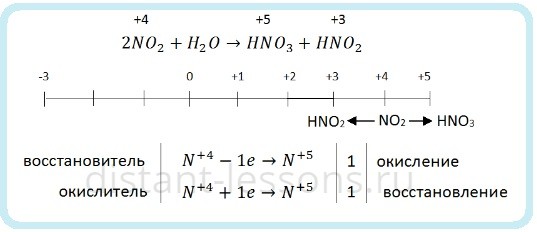
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:
Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Серная кислота. Свойства, добыча, применение и цена серной кислоты
В городе Ревда с рельсов сошли 15 вагонов с серной кислотой. Груз принадлежал Среднеуральскому медеплавильному заводу.
ЧП произошло на ведомственных железнодорожных путях в 2013-ом году. Кислота разлилась на площади в 1000 квадратных километров.
Это указывает на масштабы потребности промышленников в реагенте. В Средние века, к примеру, в год требовались лишь десятки литров серной кислоты.
В 21-ом же веке мировая выработка вещества в год – десятки миллионов тонн. По объему производства и применения судят о развитии химических отраслей стран. Так что, реагент достоин внимания. Описание начнем со свойств вещества.
Свойства серной кислоты
Внешне 100-процентная серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
Это значит, что вещество поглощает из атмосферы пары воды. При этом, кислота выделяет тепло.
Поэтому, к концентрированной форме вещества воду добавляют малыми дозами. Влей много и быстро, полетят брызги кислоты.
Учитывая ее свойство разъедать материи, в том числе, и живые ткани, ситуация опасна.
Раствор серной кислоты до 40% — неконцентрированный, химически проявляет себя иначе. Воду в него доливать можно достаточно быстро.
Насыщенное же вещество взаимодействует и с неактивными. Исключение – благородные металлы. Почему же концентрат не «трогает» железо, медь?
Причина в их пассивации. Так называют процесс покрытия металлов защитной пленкой оксидов.
Она-то и препятствует растворению поверхностей, правда, лишь в обычных условиях. При нагреве реакция возможна.
Разбавленная серная кислота больше похожа на воду, нежели масло. Концентрат же, отличим не только по тягучести и плотности, но и дыму, исходящему от вещества на воздухе.
К сожалению, в Мертвом озере на Сицилии содержание кислоты меньше 40%. По внешнему виду водоема не скажешь, что он опасен.
Учитывая разъедающую способность водоема, местные преступники взялись сбрасывать в него трупы. Несколько дней, и от органики не остается и следа.
Качество горючего получаемого из обработанной органики низкое. Кислота в реакции является окислителем, хотя, может быть и восстановителем.
В последней роли вещество выступает, к примеру, взаимодействуя с галогенами. Это элементы 17-ой группы таблицы Менделеева.
Все эти вещества сами не являются сильными восстановителями. Если же кислота встречается с таковыми, выступает лишь в роли окислителя.
Пример: — реакция с сероводородом. А какие реакции дают саму серную кислоту, как ее добывают и производят?
Добыча серной кислоты
В прошлые века реагент добывали не только из железной руды, называемой пиритом, но и из железного купороса, а так же, квасцов.
В принципе, все перечисленные минералы являются серосодержащим сырьем, поэтому, могут применяться для производства серной кислоты и в современности.
Минеральная основа бывает разной, но итог ее обработки один – серный ангидрит с формулой SO2. Образуется при реакции серы с кислородом. Получается, нужно сжечь основу.
В обычных условиях сернистый ангидрид с ним взаимодействует медленно. Поэтому, промышленники окисляют сырье на катализаторах.
Однако, за последний метод «голосуют» лишь 20% промышленников. Основная же масса серной кислоты получается по контактной схеме.
Если подсчитать практику человечества по получению серной кислоты, «накапает» более 1000 лет.
Первые упоминания о реагенте и его добыче содержит труд, датируемый 940-ым годом.
Это записи одного из персидских алхимиков по имени Абубекер аль-Рази. Однако, о кислых газах, получаемых путем прокаливания квасцов, говорил и Джафар аль-Суфи.
Этот арабский алхимик жил еще в 8-ом веке. Однако, судя по записям, в чистом виде серную кислоту не получил.
Применение серной кислоты
Более 40% кислоты идут на производство минеральных удобрений. В ходу суперфосфат, сульфат аммония, аммофос.
Все это комплексные подкормки, на которые делают ставки фермеры и крупные производители.
В удобрения добавляют моногидрат. Это чистая, 100-процентная кислота. Кристаллизуется уже при 10 градусах Цельсия.
На производство всего одной тонны удобрения уходят 600 кило концентрата кислоты.
Около 30% серной кислоты тратятся на очистку углеводородов. Реагент улучшает качество смазочных масел, керосина, парафина.
К ним примыкают минеральные масла и жиры. Их тоже очищают с помощью серного концентрата.
Способность реагента растворять металлы применяется при переработке руд. Их разложение столь же бюджетно, как и сама кислота.
В главе «Свойства» указывалось, что при нагреве серная кислота справляется с оксидными пленками на латуни, меди, железе.
Поэтому, горячий реагент используют для их травления. Так именуют очистку металлических поверхностей. После обработки, сплавы и изделия из них выглядят как новые.
Способность кислоты поглощать воду из атмосферы, делает реагент отличным осушителем.
Если воздействовать на воздух 95-процентным раствором, остаточная влажность составит всего 0,003 миллиграмма паров воды на литр осушаемого газа. Метод применяют в лабораториях и на промышленных производствах.
Стоит отметить роль не только чистого вещества, но и его соединений. Они пригождаются, в основном, в медицине.
Бариевая каша, к примеру, задерживает рентгеновское излучение. Врачи заполняют веществом полые органы, облегчая исследования рентгенологов. Формула бариевой каши: — BaSO4.
Необходим минерал и строителям, использующим его в качестве связующего, скрепляющего материала, а так же, для декоративной отделки.
Цена серной кислоты
Цена на реагент – одна из причин его популярности. Килограмм технической серной кислоты можно приобрести всего за 7 рублей.
Столько за свою продукцию просят, к примеру, менеджеры одного из предприятий Ростова на Дону. Разливают канистрами по 37 кило.
Это стандартный объем тары. Встречаются, так же, канистры в 35 и 36 килограммов.
Купить серную кислоту специализированного плана, к примеру, аккумуляторную, немногим дороже.
За 36-килограммовую канистру просят, как правило, от 2000 рублей. Вот, кстати, еще одна сфера применения реагента.
Не секрет, что разбавленная дистиллированной водой кислота – это электролит. Он нужен не только для обычных батареек, но и машинных аккумуляторов.
Разряжаются они, поскольку серная кислота расходуется, при этом, выделяется более легкая вода. Падает плотность электролита, а значит, и его эффективность.
Серная кислота – полное руководство
Определение
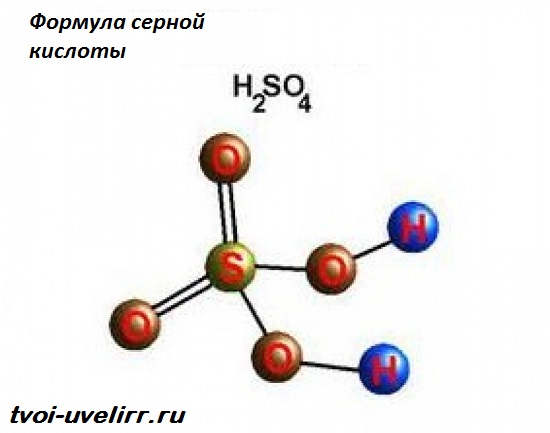
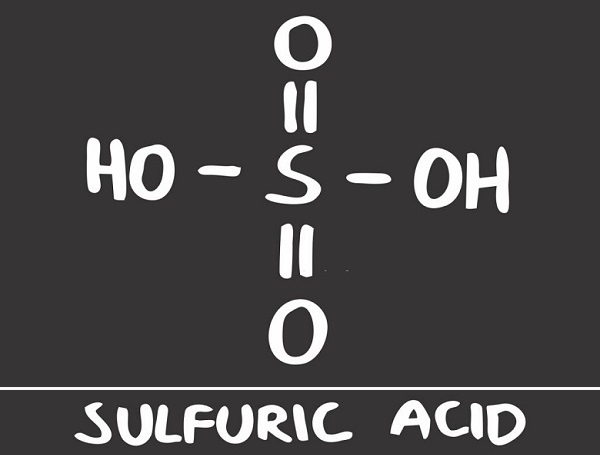
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.
Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу, почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности, Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Серная кислота в лаборатории
В лаборатории серная кислота используется в качестве осушающего агента и в количественном анализе, где концентрация решение рассчитывается с использованием метода, известного как титрование. Всякий раз, когда к кислоте добавляют воду (остерегайтесь реакции с серной кислотой и всегда добавляйте кислоту в воду, а не наоборот), положительно заряженные ионы водорода высвобождаются из кислоты путем донорства протонов. Основания или щелочи, такие как гидроксид натрия, производят отрицательно заряженные гидроксид-ионы в присутствии воды из-за принятия протонов. В зависимости от количества кислоты или щелочи в растворе, можно рассчитать его концентрацию, сложив противоположные и выяснив, когда отрицательные и положительные заряды нейтрализуют друг друга и объединяются, образуя воду молекула, Например, когда серная кислота и гидроксид натрия (NaOH) смешиваются, они реагируют и образуют молекулы воды. Однако такой металл, как натрий, в присутствии серы и воды будет дополнительно производить сульфат натрия (Na2SO4) и воду.
Примером использования титрования может быть определение концентрации раствора серной кислоты. Титрование кислоты требует известной концентрации щелочного реагента (титранта) – в данном случае гидроксида натрия. Добавляя небольшие известные количества основания к кислоте и проверяя реакцию нейтрализации с помощью индикатора pH, можно определить, сколько молей NaOH требуется для реакции с H2SO4, и таким образом рассчитать концентрацию в молях на литр.
Серная кислота в автомобильной промышленности
Серная кислота является электролитом; электролит – это раствор, в котором присутствуют ионы. Свинцово-кислотные аккумуляторы в автомобилях состоят из наборов положительно заряженных пластин из оксида свинца, погруженных в электролит, и отрицательно заряженных пластин из чистого свинца, погруженных аналогичным образом. Этот электролит представляет собой разбавленную серную кислоту (примерно 33%). Вот почему серная кислота часто упоминается как аккумуляторная кислота,
Автомобильные аккумуляторы накапливают химическую энергию и преобразуют ее в электрическую энергию посредством реакций водорода, кислорода, свинца и серы друг с другом. Присутствие дистиллированной (чистой) воды в серной кислоте производит водород и сульфат. Отпущенные отрицательные электроны перемещаются от отрицательной к положительной пластине, в то время как сульфат-ионы замещают эту потерю в отрицательно заряженной пластине (электроде), впоследствии реагируя со свинцом с образованием сульфата свинца. Серная кислота идеально подходит для этой реакции, поскольку она является дипротоновой кислотой, способной высвобождать два своих протона одновременно.
Эта реакция также происходит в положительной пластине, где связи оксида свинца разрываются, и атомы кислорода растворяются в растворе серной кислоты, оставляя атомы свинца в пластине для связи с сульфатом. Присутствие кислорода и водорода в растворе приводит к образованию воды, понижающей концентрацию серной кислоты. Когда эта концентрация слишком низкая, батарею необходимо заменить или перезарядить.
Перезарядка является противоположностью вышеописанного процесса, возвращая аккумулятор в исходное состояние положительной пластины сульфата свинца, отрицательной пластины чистого свинца и исходной концентрации сернокислого электролита; Однако, ионы медленно теряются со временем Именно поэтому срок службы батареи, даже когда она перезаряжаемая, ограничен.
Что касается энергетики, серная кислота также является компонентом литий-серно-хлоридных (Li-SO2Cl2) и литий-серно-диоксидных батарей (Li-SO2). Литий-серные батареи в настоящее время вызывают большой интерес, поскольку теоретически они могут хранить значительно больше энергии, чем литий-ионные альтернативы; Тем не менее, много исследований еще предстоит сделать.
Серная кислота в пищевой промышленности
Серная кислота часто используется в пищевой промышленности для обезвоживания некоторых пищевых продуктов, таких как фрукты, или для остановки роста бактерий и других вредных микробов, которые ускоряют процесс распада. Используется в форме спрея для сохранения мяса или птицы. Серная кислота также является пищевой добавкой общего назначения, используемой в алкогольных напитках и сыре.
Для сушки фруктов высоко ценится способность серной кислоты удалять воду. В присутствии воды серная кислота вступает в реакцию с образованием H3O + (гидроний) и HSO4– (сероводород). Последующая реакция объединяет сероводород с водой для получения большего количества H3O + и SO42- или сульфата. В виде реакция гидратации серной кислоты не требует энергии – это термодинамически выгодно – и так как в нем много атомов водорода (протонов), которые она с радостью жертвует, серная кислота быстро снижает pH любой ткани, с которой она вступает в контакт. Однако, в процессах сушки фруктов концентрированная серная кислота не находится в прямом контакте с фруктами но вместо этого используется для сушки воздуха вокруг него, удаляя влагу и тем самым помогая и ускоряя процесс обезвоживания.
Серная кислота в организме человека
В организме человека только аминокислоты цистеин (необязательно) и метионин (обязательно) содержат серу. Это означает, что многие белки, содержащие их, способны производить небольшое количество серной кислоты при метаболизме. Когда эта нелетучая (метаболическая) серная кислота не расщепляется и не используется, она выводится через почки.
Сера является одним из самых распространенных минералов в организме человека. и легко доступны в пищевых источниках от чеснока до мяса. Большинство волос и кожа Лечение, диетические добавки и совместное лечение фармацевтическими препаратами содержат большое количество этого элемента.
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + CO2
Производство CO2 позволяет организму быстро регулировать pH посредством вентиляции легких, в то время как почки регулируют ионы водорода и бикарбоната посредством экскреция и реабсорбция в более неторопливом темпе.
Кислотные ожоги являются результатом обезвоживания тканей, Коррозионные характеристики сильного раствора серной кислоты обусловлены его способностью отдавать ионы водорода, вызывая мощную реакцию окисления. Кожа содержит большое количество воды, и взаимодействие H2SO4 с H20 приводит к образованию положительно заряженных ионов гидрония (H3O +) и отрицательно заряженного сероводорода (HSO4–), что соответствует реакции, описанной в разделе, описывающем дегидратацию плодов. Когда эта реакция происходит, она также генерирует тепло, которое увеличивает любой ущерб.
Приток серной кислоты в кожу связан с немедленной диссоциацией ее ионов водорода; рН пораженной ткани быстро падает. В этой сильно кислой среде окружающие клетки погибают, что приводит к некрозу коагуляции, образованию капилляров и образованию тромба и тромбов в капиллярах и более крупных размерах. кровь сосуды при ожогах второй и третьей степени.
Добавление воды к концентрированному сжиганию серной кислоты или даже раствора, превышающего 20%, не только добавляет дополнительный ингредиент, с которым может реагировать серная кислота, но и последующая реакция генерирует еще больше тепла и, таким образом, больше ущерба. Полоскание под проточной водой должно производиться только сразу после контакта смыть кислоту с кожи но это не лечение или терапия. Прежде чем проводить какое-либо лечение, кислоту необходимо нейтрализовать. Вот почему иногда рекомендуется мыть немедленно с мылом, поскольку большинство мыл являются щелочными. При сжигании серной кислоты время имеет большое значение. Старая информация об упаковке, изображенная ниже, говорит вам, чтобы вы использовали много мыла, а затем покрыли магнезией или пищевой содой. Все эти вещества являются щелочными. Для приема серной кислоты в этих инструкциях рекомендуется пить мел, мыло или даже настенную штукатурку, еще раз щелочи, которые будут принимать диссоциированные протоны. В обоих случаях несчастному человеку рекомендуется обратиться за медицинской помощью.
Структура серной кислоты
Структура серной кислоты состоит из одного атома серы, связанного с двумя атомами кислорода посредством двойных связей, и двух гидроксильные группы (ОН) присоединяется через одинарные связи. Это хорошо видно на изображении ниже.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.
Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Серная кислота и автопротолиз
Чистая H2SO4 или безводная H2SO4 является очень полярной жидкостью, что означает, что она содержит молекулы, в которых полярные связи – связи между двумя атомами, которые распределены неравномерно – имеют очень слегка отрицательный и положительный заряд на противоположных концах. Эти заряженные концы могут притягивать или отталкивать противоположно заряженные почти соприкасающиеся молекулы посредством очень слабых диполь-дипольные силы, Серная кислота полностью ионизируется в присутствии воды на ионы гидрония (H30 +) и ионы сероводорода (HSO4–). Однако, без воды серная кислота ионизирует сама с собойгде две молекулы серной кислоты автопротолизуются с образованием одного протонированного иона серной кислоты H3SO4 + и одного иона сероводорода (HSO4–), как видно из уравнения ниже:
2 H2SO4 ⇌ H3SO4 + + HSO4-
Этот высокий уровень ионизации делает серную кислоту превосходной растворитель для широкого спектра реакций и хорошо превосходит свойства растворителя воды.
Серная кислота в нашей среде
Серная кислота является составной частью кислотный дождь и образуется в результате атмосферного окисления газообразного диоксида серы в присутствии влаги. Поскольку диоксид серы образуется, когда ископаемое топливо сжигается либо на производственных предприятиях, для производства электроэнергии и отопления, либо на транспортных средствах, кислотные дожди – это прежде всего антропогенное явление. Сухое осаждение в форме кислых частиц означает, что кислоты могут оседать, а затем вымываться дождевыми осадками, принося кислую воду в пресноводные и морские экосистемы, а также в наземную среду. Это может нанести вред жизни растений и животных.
Результирующие потоки кислой воды, вызванные кислотными дождями, могут привести к дренажу кислых пород (ARD). ARD на самом деле является результатом образования разбавленной серной кислоты в результате минеральных реакций в породе, которые несут значительный ущерб окружающей среде. Регулирующие органы пытаются ограничить воздействие ОРЗ, не допуская попадания воды в промышленные отходы серы, добавляя щелочи в сточные воды и следя за тем, чтобы сточные воды очищались до того, как они попадут в природные источники воды. Кислая вода растворяет различные металлы, присутствующие в сульфидных рудах, и производит яркие, но очень токсичные потоки.