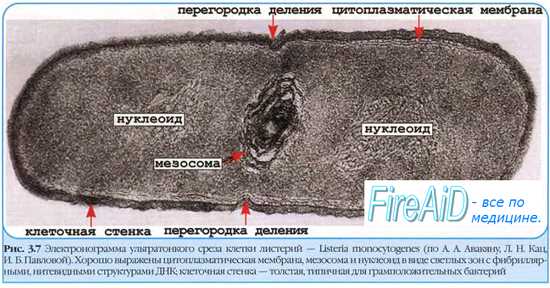
что значит латентная форма болезни
Что значит латентная форма болезни
В подавляющем большинстве случаев патогенные микроорганизмы попадают в неблагоприятные условия различных областей организма, где погибают либо подвергаются действию защитных механизмов или элиминируются чисто механически. В некоторых случаях возбудитель задерживается в организме, но подвергается такому «сдерживающему» давлению, что не проявляет патогенных свойств и не вызывает развития клинических проявлений (абортивные, скрытые, «дремлющие» инфекции).
• Абортивная инфекция [от лат. aborto, не вынашивать, в данном контексте — не реализовывать патогенный потенциал] — одна из наиболее распространённых форм бессимптомных поражений. Такие процессы могут возникать при видовой или внутривидовой, естественной либо искусственной невосприимчивости (поэтому человек не болеет многими болезнями других животных). Механизмы невосприимчивости эффективно блокируют жизнедеятельность микроорганизмов, возбудитель не размножается в организме, инфекционный цикл возбудителя прерывается, он погибает и удаляется из макроорганизма.
• Латентная, или скрытая, инфекция [от лат. latentis, спрятанный] — ограниченный процесс с длительной и циклической циркуляцией возбудителя, аналогичной наблюдаемой при явных формах инфекционного процесса. Возбудитель размножается в организме; вызывает развитие защитных реакций, выводится из организма, но никаких клинических проявлений не наблюдают. Подобные состояния также известны как инаппарантные инфекции (от англ. inapparent, неявный, неразличимый). Так, нередко в латентной форме протекают вирусные гепатиты, полиомиелит, герпетические инфекции и т.д. Лица с латентными инфекционными поражениями представляют эпидемическую опасность для окружающих.
• Дремлющие инфекции могут быть разновидностью латентных инфекций или состояниями после перенесённого и клинически выраженного заболевания. Обычно при этом устанавливается клинически не проявляемый баланс между патогенными потенциями возбудителя и защитными системами организма. Однако под влиянием различных факторов, понижающих резистентность (стрессы, переохлаждения, нарушения питания и т.д.), микроорганизмы приобретают возможность оказывать патогенное действие. Таким образом, лица, переносящие дремлющие инфекции, — резервуар и источник патогена.
• Микробоносительство. Как следствие латентной инфекции или после перенесённого заболевания возбудитель «задерживается» в организме, но подвергается такому «сдерживающему давлению», что не проявляет патогенных свойств и не вызывает развития клинических проявлений. Такое состояние называется микробоносительство. Подобные субъекты выделяют патогенные микроорганизмы в окружающую среду и представляют большую опасность для окружающих лиц. Выделяют острое (до 3 мес), затяжное (до 6 мес) и хроническое (более б мес) микробоносительство. Носители играют большую роль в эпидемиологии многих кишечных инфекций — брюшного тифа, дизентерии, холеры и др.
Коронавирус без симптомов: в чем опасность?
Нередко коронавирусная инфекция может протекать бессимптомно. Почему так происходит и для кого это представляет опасность разберемся в этой статье.
По словам профессора Сергея Авдеева, заведующего кафедрой пульмонологии Сеченовского университета частота бессимптомных случаев может составлять 25%-50%.
Как протекает вирус
Входными воротами для инфекции становятся слизистые оболочки дыхательной системы, глаз. Вирус прикрепляется к ним, начинает размножаться и только потом начинает циркулировать в крови. Можно выделить 3 варианта развития событий.
Первый, самый благоприятный. У лиц молодого возраста, детей и остальных людей с сильной иммунной системой вирус может присутствовать в организме, но защитных сил будет хватать для его сдерживания и нейтрализации. Поэтому даже в период борьбы с болезнью может не быть никаких симптомов. Изменений на КТ в легких также не будет.
Второй вариант течения COVID-19 — бессимптомная пневмония. Человек также не имеет типичных симптомов, как кашель, повышение температуры, одышки, но на снимках компьютерной томографии (КТ) у таких людей можно выявить очаги уплотнения легочной ткани с эффектом “матового стекла”, характерные для пневмонии при коронавирусе. В этом случае могут беспокоить легкие симптомы недомогания, слабости и другие слабовыраженные изменения.
О частоте такой формы течения инфекции можно судить по ситуации случившейся на круизном лайнере “Diamond Princess”. Оказалось, что бессимптомно переболели 73% пассажиров. При этом у 54% из них были выявлены изменения в легких, характерные для COVID-19. Даже при таком бессимптомном варианте возможны изменения в легких, которые дадут о себе знать позже. Но такой статистики пока нет, так как времени прошло еще не так много.
Третий вариант — это отсутствие проявлений в инкубационный период. Он может длиться до 2 недель. В течение этого времени человек будет считать себя полностью здоровым, но затем появятся первые симптомы ОРВИ как температура, кашель, ломота в теле, слабость. Возможно снижение насыщения крови кислородом и одышка. Здесь развитие болезни может идти по классическому сценарию.
В инкубационный период проявлений симптомов коронавируса нет.
Как понять, что заболел
Для подтверждения диагноза используют методы, которые выявляют либо вирусную РНК в образцах (в слюне), либо иммуноглобулины (циркулируют в крови), которые вырабатываются в ответ на вирус. Но тесты не дают 100% точности, поэтому их могут делать несколько раз. Также дополнительные методы визуализации (КТ, рентген легких) помогают поставить точный диагноз.
Заподозрить бессимптомное течение можно у членов семьи, где есть хотя бы один заразившийся и все остальные имеют с ним плотный контакт. Но точно подтвердить это могут только анализы, если никаких симптомов не было.
Последствия
При бессимптомном типе болезни, когда иммунитет справляется сам и нет пневмонии или других скрытых повреждений никаких негативных последствий, скорее всего, не будет.
Если есть изменения в легких (фиброз), то они могут проявиться как сейчас, так и дать негативные последствия в будущем. Точно сказать это нельзя, так как статистики пока нет и времени прошло не так много.
Кто в опасности
Независимо от причины отсутствия симптомов у зараженного человека опасности подвергаются все окружающие его люди, особенно из групп риска. Разберем на примере.
Даже если у зараженного нет симптомов, то все равно опасности подвергаются все окружающие его люди.
Молодой мужчина “подцепил” вирус на работе и принес его домой. Его дети могут переболеть в легкой/бессимптомной форме, а вот пожилые родители, родственники с хроническими заболеваниями, особенно диабетом, ожирением, болезнями сердца и сосудов имеют все шансы получить развернутую картину болезни с серьезными последствиями.
Заражение может произойти, даже если старшее поколение живет отдельно. Им просто привезли внуков на выходные. С виду дети полностью здоровы, поэтому бабушка с дедушкой ничего не подозревают, что во время объятий, игры дети выделяют в воздух со слюной вирусные частицы.
Поэтому так важно помнить, что инкубационный период длится 2-3 недели. При бессимптомном течении выделение вируса из организма при разговоре, кашле, чихании также может продолжаться до нескольких недель.
Важно соблюдать правила ношения маски, мытью рук даже с виду здоровым людям. Так они заботятся в первую очередь не только о себе, но и об окружающих.
Группы риска
В группу риска по заражению попадают люди имеющие множество контактов без средств индивидуальной защиты (очки, экраны, маски). Также работа в стесненных, непроветриваемых помещениях, с несоблюдением норм расстояния между работниками. Посещение людных мест — магазинов, общественного транспорта, почты.
В группе риска сразу оказываются те, кто контактировал с зараженным человеком.
Что делать
Если вы подозреваете у себя наличие коронавируса, контактировали с заболевшим, необходимо самоизолироваться на 2 недели. При необходимости сдать тесты на COVID-19. Главное в этот период ограничить свои контакты с окружающими и не подвергать их ненужному риску. Если появятся симптомы — обратиться к врачу.
Если вы подозреваете у себя наличие коронавируса, контактировали с заболевшим, необходимо самоизолироваться на 2 недели.
Профилактика
Никаких “специальных” препаратов для профилактики заражения коронавирусом не существует. Нужно снизить риск встречи с вирусом, для этого достаточно соблюдать простые правила:
Необходимы сознательные усилия каждого человека для профилактики распространения COVID-19, в том числе и полностью здоровых людей. Потому что нельзя гарантировать, что завтра вы не станете бессимптомным носителем инфекции.
PsyAndNeuro.ru
Латентный токсоплазмоз и биполярное аффективное расстройство
Наиболее распространенной формой заболевания, вызванного внутриклеточным паразитом Toxoplasma gondii (T. gondii), является латентный токсоплазмоз, обусловленный образованием тканевых кист в различных органах, например, в головном мозге. В литературе накоплено большое количество противоречивых данных о том, что латентный токсоплазмоз является фактором риска развития некоторых психических расстройств. Поведенческие изменения после заражения могут быть обусловлены иммунным ответом хозяина, жизнедеятельностью паразита, воспалением в центральной нервной системе, а также изменениями в гормональных и нейромедиаторных взаимоотношениях ( Nayeri T et al). Prandovszky E et al. установили, что T. gondii вызывает значительное увеличение метаболизма дофамина в нейронах, что соответствует патофизиологии некоторых психических расстройств ( Prandovszky E et al ).
Представители семейства кошачьих являются окончательными хозяевами T. gondii и выделяют высокоустойчивые ооцисты. Практически все теплокровные животные могут выступать в качестве промежуточных хозяев. Два основных пути передачи инфекции человеку: употребление в пищу мяса, содержащего тканевые цисты и не прошедшего необходимую термическую обработку, и использование пищи или воды, загрязненных ооцистами, выделенными инфицированными кошками ( Dubey JP et al ).
Данные иммунологических исследований
Del Grande C et al в обзоре, посвященном описанию влияния иммунных реакций организма и роли Toxoplasma gondii в этиологии и патогенезе психиатрических симптомов, пишут, что инфекция T. gondii может способствовать возникновению и прогрессированию течения биполярного аффективного расстройства (БАР), взаимодействуя с генетическими факторами риска, а также влияя на нейромедиаторные системы и иммунные реакции. Инфекции, аутоиммунные процессы, периферические и центральные воспалительные реакции имеют большое значение в патогенезе в определенных подгруппах пациентов с БАР (Del Grande C et al).
Hamdani N et al. в своем исследовании изучали иммунологические механизмы при латентной инфекции Toxoplasma Gondii при БАР или шизофрении. Пациенты и здоровый контроль были включены в исследование гуморального иммунитета путем определения общего количества иммуноглобулинов (IgG, A и M) и подклассов IgG (IgG1, IgG2, IgG3, IgG4) и их связи с латентной инфекцией Toxoplasma gondii. В общей сложности 94 (76,2%) пациента с БАР и 79 из группы контроля (58,2%) были серопозитивны по IgG к T. gondii со значительной разницей между БАР и группой контроля. Hamdani N et al обнаружили, что самые высокие уровни антител к инфекции T. gondii при БАР были связаны с самыми низкими уровнями IgG3 (3,1 ± 1,8 против 2,6 ± 1,8, p = 0,03) и IgG4 (3,1 ± 1,8 против 2,6 ± 1,8, p = 0,04) по сравнению с контролем. Таким образом, пациенты с БАР и латентной инфекцией T. gondii могут быть более уязвимы к изменениям в иммуновоспалительных процессах, чем контрольная группа с аналогичной латентной инфекцией ( Hamdani N et al ).
Влияние психотропных препаратов
Более того, разные авторы сообщали, что стабилизаторы настроения и антипсихотики, используемые при лечении БАР, могут подавлять репликацию T. gondii in vitro. Известно, что T. gondii имеет три стадии развития: тахизоиты, брадизоиты и ооцисты, а развитие латентного и хронического токсоплазмоза обусловлено образованием тканевых кист, содержащих брадизоиты. Недавно опубликованное исследование Enshaeieh M et al. было посвящено определения количества копий BAG1 (брадизоит-специфического белка), ДНК REP529 (повторяющегося фрагмента ДНК паразита) и SAG1 (высоко экспрессируемого тахизоит-специфического поверхностного белка) методом количественной ПЦР в реальном времени в мозге мышей с хронической инфекцией T. gondii, получавших вальпроевую кислоту. Лечение снизило количество копий BAG1, SAG1 и REP529 в мозге мышей (P вальпроевая кислота ингибирует хроническую токсоплазменную инфекцию и связанное с ней воспаление мозга у мышей, что может помочь в разработке более эффективных препаратов против Toxoplasma ( Enshaeieh M et al ).
Данные систематических обзоров и метаанализов
Fernandes SM et al. провели систематический обзор для оценки ассоциации между контактом с токсоплазмой и некоторыми психическими расстройствами. Компьютеризированный поиск литературы проводился с использованием MEDLINE/PubMed, SciELO и PsycINFO, объединяющих ключевые термины с 1994 года по 27 октября 2019 года. Включались исследования, изучающие частоту контакта с токсоплазмозом у взрослых (≥ 18 лет) обоих полов с установленным диагнозом шизофрении, БАР или рекуррентным депрессивным расстройством (РДР) и сравнивающие частоту контакта с токсоплазмозом у психиатрических пациентов со здоровым контролем.
Всего в анализ было включено 31 исследование, и в большинстве из них была обнаружена связь между контактом с токсоплазмозом и шизофренией или БАР (58,3 и 54,5% включенных работ, соответственно). 24 из включенных статей проводились на выборке пациентов шизофренией, 14 из них (58,3%) подтверждали и 10 (41,6%) опровергли гипотезу об ассоциации. 11 работ, включенных в данный обзор, касались БАР. Из них 6 (54,5%) подтвердили гипотезу об ассоциации и 5 (45,4%) опровергли ее. После поправки на такие ковариаты, как возраст и наличие коинфекции, серораспространенность в группе БАР была значительно выше, чем в группе здорового контроля. В других исследованиях связь между БАР и серораспространенностью T. gondii была обнаружена после исключения пациентов, коинфицированных другими нейротропными патогенами или имеющих семейную историю психических расстройств. 4 исследования, касающиеся РДР, опровергли гипотезу о связи контакта с токсоплазмозом и РДР, что согласуется с данными предыдущей литературы. Авторы не обнаружили существенной разницы в средних баллах качества между исследованиями, подтверждающими и опровергающими гипотезу об ассоциации шизофрении или биполярного расстройства. Все включенные работы были признаны как минимум удовлетворительными по шкале Ньюкасла-Оттавы (общая оценка ≥ 6 баллов из 9).
Таким образом, результаты систематического обзора свидетельствуют о наличии связи между серораспространенностью токсоплазмоза с БАР и шизофренией и отсутствии таковой с РДР. Данный систематический обзор обозначил противоречия в литературе относительно связи между контактом с токсоплазмозом и психическими расстройствами. Fernandes SM et al. предлагают включить в будущие исследования новые переменные: статус лечения и уровень антител к T. gondii в сыворотке крови; серораспространенность других нейротропных патогенов (например, ВИЧ 1 и 2, цитомегаловирус, HSV 1 и 2, гепатиты A, B и C); подробное описание выборки в отношении типов и различных фаз заболевания; а также нейтрализацию других ограничивающих факторов, таких как возраст, пол, происхождение пациентов и штамм T. gondii.
Результаты в когорте БАР (n = 2 364 пациента с БАР, n = 5 101 контроль) и последующий метаанализ показали отсутствие связи между воздействием герпесвирусов и БАР. Snijders GJLJ et al. при анализе 11 исследований не обнаружили связи между БАР и титром T. gondii или серораспространенностью [скорректированное отношение шансов (ОШ) 1,018, 95% ДИ 0,672-1,542]. Общее ОШ не было значимым для T. gondii [ОШ: 1,4, 95% ДИ 0,95-1,90, p = 0,09], но анализ подгрупп показал, что в возрастной группе до 40 лет есть значимо более высокая серораспространенность T. gondii IgG [ОШ: 1,8 (95% ДИ 1,10-2,89, p = 0,021]. В группе в возрасте > 40 лет существенных различий не было обнаружено, а общее ОШ составило 1,1 (95% ДИ 0,70-1,76, Q (4) = 21,8, p = 0,64, I2 = 82%). Различия в ОШ между двумя возрастными группами не были значительными (p = 0,174). По результатам метаанализа заражение T. gondii может быть фактором риска развития БАР в определенных субпопуляциях.
В заключение следует отметить, что данные, представленные в этом исследовании по IgG T. gondii свидетельствуют об отсутствии связи между воздействием этого патогена и БАР. Однако необходимы дополнительные исследования среди пациентов с ранним манифестом БАР и анализ конкретных штаммов, чтобы определить, является ли воздействие T. gondii внешнесредовым фактором риска БАР. Дальнейшее выяснение этой потенциальной ассоциации имеет большое значение, поскольку связь между T. gondii и БАР не только интересна для понимания патогенеза БАР, но и может стать мишенью для лечения.
Более ранний систематический обзор и метаанализ de Barros JLVM et al., посвященные суммарной оценке силы связи между инфекцией T. gondii и БАР, подтверждают тот факт, что серораспространенность T. gondii у пациентов с БАР выше, чем у контрольной группы. Ранняя инфекция T. gondii может предрасполагать к развитию БАР и приобретает клиническое значение при психических расстройствах.
Заключение
Таким образом, результаты нескольких систематических обзоров и метаанализов последних лет доказывают наличие связи между токсоплазмозом и БАР, но необходимы дальнейшие исследования с большим вниманием к клиническим деталям для уточнения природы и характера этих связей. Интерес представляют исследования с использованием более крупных выборок, продуманным дизайном относительно аффективных фаз, фиксации информации об используемом психофармакологическом лечении. Представляется важным учитывать, что выявление, профилактика и лечение таких инфекций, как токсоплазмоз, могут иметь большое значение для течения психических расстройств в общем и БАР в частности.
Автор перевода: Долина А.А.
Источники:
de Barros JLVM, Barbosa IG, Salem H, Rocha NP, Kummer A, Okusaga OO, Soares JC, Teixeira AL. Is there any association between Toxoplasma gondii infection and bipolar disorder? A systematic review and meta-analysis. J Affect Disord. 2017 Feb;209:59-65. doi: 10.1016/j.jad.2016.11.016. Epub 2016 Nov 17. PMID: 27889597.
Dubey JP, Murata FHA, Cerqueira-Cézar CK, Kwok OCH, Yang YR. Public Health Significance of Toxoplasma gondii Infections in Cattle: 2009-2020. J Parasitol. 2020 Nov 12;106(6):772-788. doi: 10.1645/20-82. PMID: 33326588.
Enshaeieh M, Saadatnia G, Babaie J, Golkar M, Choopani S, Sayyah M. Valproic Acid Inhibits Chronic Toxoplasma Infection and Associated Brain Inflammation in Mice. Antimicrob Agents Chemother. 2021 Sep 17;65(10):e0100321. doi: 10.1128/AAC.01003-21. Epub 2021 Aug 2. PMID: 34339265; PMCID: PMC8448128.
Fernandes SM, Dias AR, Miranda-Scippa Â. Association between exposure to toxoplasmosis and major psychiatric disorders: a systematic review. Braz J Psychiatry. 2021 Jul-Aug;43(4):438-445. doi: 10.1590/1516-4446-2020-0904. PMID: 32965430; PMCID: PMC8352736;
Hamdani N, Bengoufa D, Godin O, Doukhan R, Le Guen E, Daban-Huard C, Bennabi M, Delavest M, Lépine JP, Boukouaci W, Laouamri H, Houenou J, Jamain S, Richard JR, Lecorvosier P, Yolken R, Rajagopal K, Leboyer M, Tamouza R. Immunoglobulin sub-class distribution in bipolar disorder and schizophrenia: potential relationship with latent Toxoplasma Gondii infection. BMC Psychiatry. 2018 Jul 27;18(1):239. doi: 10.1186/s12888-018-1821-9. PMID: 30053866; PMCID: PMC6062947.
Nayeri T, Sarvi S, Daryani A. Toxoplasmosis: Targeting neurotransmitter systems in psychiatric disorders. Metab Brain Dis. 2021 Sep 3. doi: 10.1007/s11011-021-00824-2. Epub ahead of print. PMID: 34476718.
Prandovszky E, Gaskell E, Martin H, Dubey JP, Webster JP, McConkey GA. The neurotropic parasite Toxoplasma gondii increases dopamine metabolism. PLoS One. 2011;6(9):e23866. doi: 10.1371/journal.pone.0023866. Epub 2011 Sep 21. PMID: 21957440; PMCID: PMC3177840.
Snijders GJLJ, van Mierlo HC, Boks MP, Begemann MJH, Sutterland AL, Litjens M, Ophoff RA, Kahn RS, de Witte LD. The association between antibodies to neurotropic pathogens and bipolar disorder : A study in the Dutch Bipolar (DB) Cohort and meta-analysis. Transl Psychiatry. 2019 Nov 20;9(1):311. doi: 10.1038/s41398-019-0636-x. PMID: 31748521; PMCID: PMC6868237.
Что значит латентная форма болезни
Цель работы – провести анализ взаимовлияния коронавирусной инфекции и латентной туберкулезной инфекции.
Нам проведен поиск в электронных базах данных PubMed, MEDLINE, Scopus, Google Scholar на предмет исследований, опубликованных за период до августа 2021 г.
По данным Всемирной организации здравоохранения (ВОЗ) за 2019 г., в мире туберкулезом заболели 10 млн чел., включая 5,6 млн мужчин, 3,2 млн женщин и 1,2 млн детей. По расчетам ежегодно в мире 1 млн детей заболевает туберкулезом. Снижение уровня заболеваемости в период с 2015 по 2019 г. составило 9 %, а глобальная цель на 2030 г. составляет 80 % [1].
Латентная туберкулезная инфекция – состояние стойкого иммунного ответа, вызванного присутствием в организме антигенов Mycobacterium tuberculosis, при отсутствии клинических проявлений активной формы ТБ. Не существует «золотого стандарта» диагностики, позволяющего прямым методом выявлять у людей инфекцию, вызванную Mycobacterium tuberculosis. У подавляющего большинства инфицированных лиц нет признаков или симптомов туберкулеза, но есть риск развития его активной формы [2]. ЛТИ имеет 10 % вероятность прогрессирования в активное заболевание туберкулезом, 5 % в течение первых двух лет приобретения инфекции и 5 % в течение остальной части жизни человека. Из математических моделей было сообщено, что примерно 30 % населения во всем мире являются носителями ЛТИ [3]. Выявление лиц с ЛТИ и постановка лиц, подверженных риску развития активного туберкулеза, на профилактическое лечение имеет решающее значение для устранения заболевания [4].
С конца 2019 г. пандемия коронавирусной инфекции 2019 (COVID-19) вызвала колоссальные последствия в области здравоохранения и в социально-экономической сфере. Даже после того, как некоторые из них будут сглажены или нивелированы, будут по-прежнему ощущаться среднесрочные и долгосрочные последствия. В контексте глобальной эпидемии туберкулеза пандемия COVID-19 угрожает свести на нет достигнутый за последнее время прогресс в выполнении глобальных задач в области борьбы с туберкулезом [5].
Во всем мире, по состоянию на 16:50 по центральноевропейскому летнему времени 1 сентября 2021 г. в ВОЗ был зарегистрирован 217 558 771 подтвержденный случай COVID-19, включая 4 517 240 случаев смерти. По состоянию на 1 сентября 2021 г. введено 5 272 630 490 доз вакцины.
Результаты исследования, проведенного в 2020 г., показали, что если в глобальном масштабе пандемия COVID-19 приведет к снижению на 25 % ожидаемых уровней выявления туберкулеза в течение 6 месяцев, то можно ожидать роста смертности от туберкулеза на 26 %, что вернет нас к уровням показателей смертности от туберкулеза среди населения земного шара, которые наблюдались в 2012 г. [6].
Официальные данные ВОЗ с начала пандемии показывают, что во многих странах с тяжелым бременем туберкулеза количество уведомлений о туберкулезе существенно сократилось в течение нескольких месяцев в 2020 г. Негативные последствия пандемии для основных услуг по борьбе с туберкулезом включают перераспределение человеческих, финансовых и других ресурсов из противотуберкулезных служб на борьбу с COVID-19. В Индии, Индонезии, Филиппинах и Южной Африке – четырех странах, на долю которых приходится 44 % глобального бремени туберкулеза, – с января по июнь 2020 г. наблюдалось резкое сокращение уведомлений о новых случаях туберкулеза. По сравнению с аналогичным шестимесячным периодом 2019 г., в Индии, Индонезии и Филиппинах этот показатель снизился на 25–30 %. Моделирование дает основание полагать, что в период с 2020 по 2025 г. заболеваемость туберкулезом может вырасти более чем на 1 млн новых случаев в год и от туберкулеза умрут еще 1,4 млн чел., что будет прямым следствием пандемии COVID-19. Кроме этого, ухудшение финансового положения людей из-за потери доходов или работы может привести к повышению доли больных туберкулезом и их семей, столкнувшихся с катастрофическими расходами [7]. В 2020 г. лечение по поводу туберкулеза получили примерно 1,4 млн чел., на 21 % меньше, чем в 2019 г. [8, 9].
Международная рабочая группа по моделированию COVID / TB и другие специалисты (2021) в своем обзоре данных отразили различные результаты математического моделирования влияния пандемии COVID-19 на бремя туберкулеза, и ими обобщены эпидемиологические, клинические, организационные материалы при сочетанной патологии, а также определены общие механизмы, с помощью которых COVID-19 может изменить бремя туберкулеза и меры по смягчению его последствий. Группой определены данные о влиянии COVID-19 как на доступность, так и на потребности в ресурсах для борьбы с туберкулезом и выделены пробелы в системе здравоохранения стран мира, которым следует уделять первоочередное внимание [10].
В настоящее время в мировой литературе растет количество научных публикаций и данных о взаимосвязи между туберкулезом и COVID-19. В недавнем обзоре мировой литературы по данной проблеме представлена имеющаяся информация о взаимодействии этих двух инфекций. Обсуждаются различия и сходства туберкулеза и COVID-19, их иммунологические особенности, диагностика, эпидемиологические и клинические характеристики и последствия для общественного здравоохранения. Основываясь на задействованном иммунологическом механизме, была обнаружена общая дисрегуляция иммунных реакций при COVID-19 и туберкулезе, что предполагает двойной риск, связанный с коинфекцией, ухудшающей тяжесть COVID-19 и способствующей прогрессированию заболевания туберкулезом [11].
Имеющиеся данные по клиническим аспектам свидетельствуют о том, что развитие COVID-19 происходит независимо от периода наступления инфицирования микобактериями туберкулеза, возникновения и развития туберкулеза, инфицирование вирусом наступает до развития активного туберкулеза (латентная туберкулезная инфекция), на фоне активного заболевания или после клинического выздоровления от туберкулеза. Требуется больше доказательств, чтобы определить, может ли COVID-19 вызвать реактивацию или утяжелять клиническое течения или прогрессировать заболевание туберкулезом.
В настоящее время проводится глобальное исследование сочетания туберкулеза и COVID, которое координируется Глобальной сетью по борьбе с туберкулезом и поддерживается Всемирной организацией здравоохранения, для четкого понимания взаимодействия между двумя заболеваниями. При этом Глобальная сеть по борьбе с туберкулезом предложила ответить на несколько приоритетных исследовательских вопросов, включая проблемы, касающиеся взаимовлияния этих двух болезней друг на друга, с помощью этого глобального исследования и других разработок. Были подняты вопросы относительно коинфекции туберкулеза/COVID-19 [8–10].
1) может ли COVID-19 увеличить риск развития активного туберкулеза у пациентов, ранее подвергшихся воздействию Mycobacterium tuberculosis;
2) увеличивает ли COVID-19 риск смертности от туберкулеза;
3) увеличивают ли иммунодепрессанты, используемые для лечения COVID-19, риск реактивации туберкулеза;
4) имеют ли пациенты с посттуберкулезными последствиями более высокий риск приобретения COVID-19;
5) препятствует ли легочный фиброз, вторичный по отношению к инфекции COVID-19, лечению туберкулеза?
Поскольку COVID-19 является недавним заболеванием, научные данные остаются скудными, и нам, вероятно, придется ждать годы, прежде чем на эти вопросы будут даны ответы [12].
Пандемия COVID-19 оказывает глубокое и длительное влияние на диагностику и борьбу с туберкулезом, потенциально приводя к дополнительным 6,3 млн новых случаев туберкулеза в период между 2020 и 2025 гг. и дополнительным 1,4 млн смертей от туберкулеза за это время. Необходимо срочно разработать новые подходы к решению глобальной проблемы, иначе цели по борьбе с туберкулезом никогда не будут достигнуты и могут быть отложены на 5–8 лет [11].
Согласно собранным международной рабочей группой COVID/ТB данным, COVID-19 заметно повлияла на глобальную уязвимость или восприимчивость к туберкулезу за счет общего сокращения доступа к медицинской помощи, роста бедности и потенциальной возможности развития заболеваний легких после вирусной инфекции. Эти факторы могут способствовать прогрессированию туберкулеза у лиц ЛТИ, а также ухудшать результаты лечения активного туберкулеза. Данные математического моделирования в целом предполагают, что на фоне пандемии восприимчивость организма к туберкулезу увеличивается [13–15], однако пока убедительных научных доказательных данных мало.
В литературе появляется все больше доказательств того, что ЛТИ или активный туберкулезный процесс или состояние после перенесенного заболевания тесно связаны с неблагоприятными исходами COVID-19 [16–19], включая примерно двух- или трехкратное увеличение летальности больных, причем она наступает очень быстро, и снижение показателей выздоровления на 25 %, которые наступают относительно в долгий срок [20–23]. Во многих случаях у больных туберкулезом легких развиваются выраженные остаточные посттуберкулезные изменения в легких или площадь поражения специфической патологии может быть довольно обширной, эти случаи приводят к более высокому риску неблагоприятного исхода.
Ряд исследователей отмечают, что легкие, пораженные вследствие COVID-19, даже после выздоровления остаются уязвимыми к ТБ и это является серьезной проблемой. В настоящее время проводится исследование для изучения данного вопроса [24–28].
В то же время сокращение объема и ухудшение качества медицинских услуг, аналогичное описанному выше, могут значительно повлиять на восприимчивость к ТБ, такие заболевания, как ВИЧ и сахарный диабет [29].
Ожидается, что бедность населения, возрастет из-за COVID-19, включая больных туберкулезом, и увеличится неравенство [30]. Ухудшение условий жизни, недоедание также могут способствовать росту заболеваемости туберкулезом. Доказано, что 30–50 % случаев заболевания ТБ связаны с недоеданием. Очень важно изучить долгосрочные последствия этого экономического воздействия на эпидемию туберкулеза [31–34].
В настоящее время нам еще не понятны механизмы передачи микобактерии туберкулеза, мы не знаем, каким образом COVID-19 повлиял на передачу M. tuberculosis и какие меры будут приняты для снижения передачи COVID-19. Уменьшение числа контактов в обществе и медицинских учреждениях, массовое использование масок могут снизить передачу M. tuberculosis [35]. Однако потенциальное увеличение числа контактов в домашних условиях и большая продолжительность ЛТИ и заболевания ТБ по сравнению с COVID-19 могут увеличить передачу инфекции в этих условиях. Такое положение может усугубиться при уменьшении доступа к услугам здравоохранения в связи с туберкулезом, на фоне которого увеличивается продолжительность заразности туберкулеза, а повышение уязвимости ведет к большему риску заболевания туберкулезом или реактивации ЛТИ.
С момента публикации первого когортного исследования о сочетании туберкулеза и COVID-19 [19] остается неясным, может ли COVID-19 увеличить риск развития активного туберкулеза у лиц, ранее инфицированных Mycobacterium tuberculosis (ЛТИ), и в какой степени. По мнению многих исследователей, связь между туберкулезом и COVID-19, вероятно, будет двунаправленной. Иммуносупрессия, вызванная туберкулезом, может повысить восприимчивость пациентов к COVID-19, а COVID может, в свою очередь, также повысить восприимчивость к туберкулезу [36, 37].
COVID-19 также может оказывать негативное влияние на ЛТИ. Нарушение регуляции иммунитета, вызванное COVID-19, может повлиять на диагностику и лечение ЛТИ. В этом смысле многие вопросы остаются открытыми. Неизвестно, например, есть ли необходимость в обследовании пациентов с тяжелой формой COVID-19 с помощью туберкулиновой кожной пробы / анализа высвобождения IFN-γ перед назначением иммунодепрессантов и, в случае положительного результата туберкулиновой кожной пробы / Анализ высвобождения IFN-γ, следует ли прекратить применение иммунодепрессантов, применяемых в настоящее время. Также необходимы дополнительные исследования, чтобы понять роль COVID-19 в прогрессировании от ЛТИ до активного туберкулеза и спланировать последующее наблюдение за такими пациентами после COVID-19 [38].
Кроме того, применение иммуносупрессивных препаратов у тяжелых и критических пациентов с COVID-19, хотя лечение проводится в течение короткого времени, может привести к увеличению вероятности развития активного туберкулеза в результате перехода ЛТИ в болезнь или реактивации остаточных посттуберкулёзных изменений или появление новой туберкулезной инфекции [39], на основании систематического обзора и метаанализа мировой литературы утверждают о том, что есть доказательства повышенного риска смертности у больных туберкулезом, одновременно инфицированных COVID-19, и по их данным у больных туберкулезом в сочетании с инфекцией COVID-19 смертность увеличивается примерно в два раза [40]. Другие исследователи также сообщают о высоком уровне показателя летальности у больных туберкулезом с сочетанной инфекцией – 12,3–11,6 % [19, 41].
Inoue K., Kashima S. отметили, что высокий уровень заболеваемости и смертности от COVID-19 наблюдается в странах с более низкими показателями прошлой эпидемии туберкулезной инфекции. По их мнению, тренированный иммунитет потенциально способствует снижению восприимчивости людей к COVID-19 в азиатских странах и высокой восприимчивости в странах Европы и Америки, а это может сыграть важную роль в предотвращении обострения туберкулеза и смерти людей, подвергшихся воздействию COVID-19. Учитывая вышеизложенное, предложено дальнейшее изучение стратификации рисков и превентивных мер в политике борьбы с туберкулезом в условиях пандемии COVID-19 [42]. Подобное исследование проводила группа авторов из Пакистана, оно было направлено на определение взаимосвязи между перенесенным в прошлом туберкулезом легких и пневмонией COVID-19. Пациенты были распределены на 2 группы: 1-я группа пациентов, которые прошли полное клиническое, лабораторное и рентгенологическое исследование в период до начала эпидемии COVID-19 («до COVID-19»); 2-я группа – пациенты, которые также прошли комплексное обследование в период пандемии («COVID-19»). О перенесенном туберкулезе легких свидетельствовали анамнез заболевания, прием противотуберкулезных препаратов и результаты рентгенограмм органов грудной клетки. Во второй группе «COVID-19» у 4,9 % пациентов в прошлом был туберкулез легких, а в группе «до COVID-19» у 9,8 % пациентов были установлены признаки перенесенного туберкулеза легких с подтвержденным клиническим анамнезом (разница показателей статистически достоверна: p = 0,001). На основании полученных данных авторы утверждают, что перенесенный туберкулез легких может оказывать защитное действие против пневмонии COVID-19, которое может быть обусловлено выработкой антител в результате предыдущего воздействия болезни, или ЛТИ, или вакцинации. Более того, в группе «COVID-19» не было случаев активного туберкулеза, что решительно отвергает широко распространённые мнения о повышенной восприимчивости к COVID-19 больных туберкулезом [43].
Только в одном исследовании, проводимом в Италии, отражено доброкачественное течение вирусной инфекции с летальным исходом в 5 % случаев на фоне активного туберкулеза A. Rajamanickam и соавт. (2020) изучали влияние ЛТИ на гуморальный и врожденный иммунные ответы у пациентов бессимптомных лиц с COVID-19. Получены интересные результаты. У лиц с ЛТИ на фоне серопозитивного состояния по SARS-CoV-2 без клинических проявлений заболевания (бессимптомное течение) было обнаружено повышение уровня титра антител IgM, IgG и IgA к SARS-CoV-2 и усиление нейтрализующей активности антител по сравнению с показателями у лиц, неинфицированных микобактериями туберкулеза. Лица ЛТИ в сочетании с коинфекцией демонстрировали значительно повышенные уровни цитокинов, хемокинов в плазме и острофазных белковых показателей по сравнению с пациентами с ЛТИ без инфицирования SARS-CoV-2. По мнению авторов, повышенные уровни связывающих и нейтрализующих антител в сочетании с повышенными уровнями защитных цитокинов и хемокинов потенциально могут способствовать снижению восприимчивости к заболеванию и смертности от COVID-19. В заключение исследователи посчитали, что дальнейшее изучение влияния ЛТИ на пациентов COVID-19 с легкой, средней и тяжелой формой заболевания должно пролить больше света на взаимодействие между этими двумя основными инфекциями [44]. S. Borekci и соавт. (2021) изучали взаимосвязь между результатами теста на высвобождение гамма-интерферона (IGRA), проведенного в течение 12 месяцев до пандемии COVID-19, частотой и тяжестью инфекций COVID-19 в зависимости от результатов теста – положительная (51,14 %), отрицательная (78,3 %) и неопределенная (28, 7,7 %) группы сравнивались. Частота заражения COVID-19 в неопределенной группе была значительно выше, чем в группах с положительной и отрицательной реакциями. По мнению авторов, неопределенные результаты теста IGRA могут служить ориентиром с точки зрения стратификации риска в группах риска COVID-19 и результаты теста могут быть косвенными индикаторами функций иммунных Т-клеток через Т-клетки памяти. Хотя основной целью теста IGRA является обнаружение ЛТИ [45].
Исследование, проведенное в Италии, показало, что тесты IGRA могут использоваться для прогнозирования смертности у пациентов с тяжелой формой COVID-19 [46]. Примерно 2–11 % тестов IGRA дают неопределенные результаты. Пациенты с неопределенным ответом – это пациенты с хроническим заболеванием или с ослабленным иммунитетом, у которых не формируется адекватный иммунный ответ против миогенного контроля [47, 48].
Также низкое количество лимфоцитов может привести к ложноотрицательным или неопределенным результатам из-за недостаточного иммунного ответа [49, 50].
Туберкулезная инфекция может играть роль в развитии COVID-19-инфекции и тяжелого течения заболевания [51].
Недавний обновленный метаанализ и обзоры литературных данных еще раз продемонстрировали, что туберкулез (или латентный туберкулез) в значительной степени утяжеляет клиническое течение и повышает риск развития смертности среди пациентов с вирусной инфекцией COVID-19, хотя это требует подтверждения в более крупном исследовании. [41, 44]. Рекомендовано принять ряд профилактических мер для защиты больных туберкулезом от вирусной инфекции, и больным туберкулезом в сочетании с COVID-19 следует назначить соответствующий клинический уход, лечение и социальную поддержку для предотвращения прогрессирования заболевания [45, 52].
Результаты исследования, проведенного по транскриптомной оценке сигнатур цельной крови, мононуклеарных клеток периферической крови и жидкости бронхоальвеолярного лаважа, свидетельствуют о том, что субклинический и активный туберкулез повышает риск тяжелого заболевания COVID-19 из-за повышенного обилия циркулирующих миелоидных субпопуляций, которые также обнаруживаются в легких у пациентов с COVID-19 с тяжелым течением [53, 54].
Повышенная продукция интерферона (ИФН) и сигнатуры ответов ИФН I и III типов значительно повышаются при тяжелом течения COVID-19 и могут привести к прогрессированию заболевания и тяжелым/смертельным исходам [55].
5 мая 2021 г. в рамках Глобальной программы ВОЗ по борьбе с туберкулезом совместно с региональными и страновыми офисами и в сотрудничестве с заинтересованными сторонами была разработана информационная записка. Эта записка призвана помочь национальным программам по борьбе с туберкулезом и медицинскому персоналу в срочном порядке обеспечить непрерывность оказания основных услуг больным туберкулезом во время пандемии COVID-19, используя социально ориентированные инновационные подходы, учитывающие потребности людей и максимально усилив совместно оказываемую поддержку в борьбе с обоими заболеваниями. Важно, чтобы пандемия COVID-19 не свела на нет все, что было достигнуто в области профилактики и лечения туберкулеза. Выявление больных туберкулезом и оказание им помощи остаются основополагающими принципами профилактики и лечения туберкулеза, и они требуют постоянного внимания.
Заключение
Учитывая, что значительная часть населения мира имеет ЛТИ, пандемия COVID-19 может привести к всплеску заболеваемости активным туберкулезом. Раннее выявление пациентов с туберкулезом и последующее отслеживание контактов имеет большое значение для борьбы с распространением туберкулеза. Однако анализ литературных данных свидетельствует о том, что на сегодняшний день убедительные научные данные о взаимном влиянии туберкулеза и COVID-19 ограничены и отдельные результаты исследований противоречивы. Полученные данные говорят о существенных сбоях в работе противотуберкулезных служб на фоне пандемии COVID-19 и повышении уязвимости населения к туберкулезной инфекции. Изучение влияния ЛТИ на развитие, течение и исходы COVID-19 и, наоборот, влияния вирусной инфекции на состояние ЛТИ и эпидемиологию туберкулеза требует проведения фундаментальных научных исследований.