что значит мутация l858r в гене egfr
Мутации гена EGFR
Роль рецептора EGFR и мутаций гена EGFR в патогенезе немелкоклеточного рака легкого
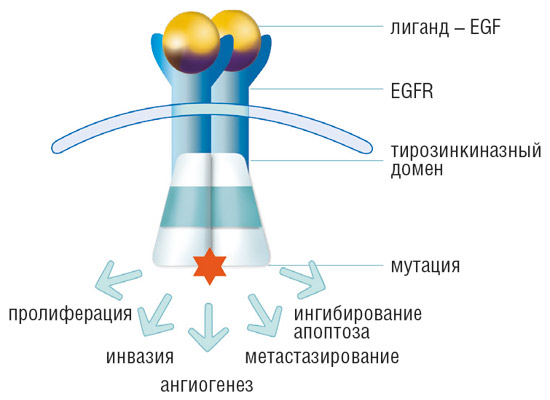
Многочисленные биологические исследования выявили повышенную активность рецептора EGFR и каскада, запускающегося при активации этого рецептора, у больных немелкоклеточным раком легкого.
Что такое EGFR?
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора роста, что обусловлено наличием мутации в соответствующем гене. В клетках с мутацией происходит активация сигнального пути EGFR, что, в свою очередь, инициирует процессы злокачественной трансформации в большинстве опухолей. Сигнальные пути контролируют процессы пролиферации, апоптоза – одного из механизмов клеточной гибели, утраты способности клеток к дифференцировке, процессы ангиогенеза и метастазирования.
Зачем определять статус мутации гена EGFR?
Тест на мутацию гена EGFR предназначен для отбора больных местно-распространенным или метастатическим немелкоклеточным раком легкого на терапию низкомолекулярными ингибиторами EGFR (ингибиторами тирозинкиназы).
Наличие мутаций гена EGFR позволяет выделить группу пациентов с наибольшей вероятностью выраженного ответа на терапию ингибиторами тирозинкиназы (гефитиниб).
Известны активирующие мутации гена EGFR, связанные с чувствительностью либо устойчивостью к ингибиторам тирозинкиназы. Подавляющее большинство мутаций, связанных с чувствительностью (
90%), – это делеции в 19 экзоне (Del19) или замена L858R в 21 экзоне. Опухоли с мутациями Del19 или L858R наиболее чувствительны к терапии ингибиторами тирозинкиназы EGFR. Прочие мутации, связанные с чувствительностью (G719X, L861Q, S768I и некоторые другие), составляют в сумме
5% мутантных случаев.
Инсерции 20 экзона связаны с устойчивостью к ингибиторам тирозинкиназы и составляют
3% опухолей с мутациями. Еще одна мутация, связанная с устойчивостью, – T790M. Частота выявления этой мутации после проведения химиотерапии ингибиторами тирозинкиназы составляет примерно 50%, однако в 1-3% случаев мутация может возникать de novo. Мутация T790M в гене EGFR является наиболее частой причиной возникновения резистентности к проводимой таргетной терапии. Своевременное выявление этой мутации позволяет выяснить причину резистентности и принять решение о смене терапии у пациента. Поэтому для назначения эффективной таргетной терапии всем больным немелкоклеточным раком легкого необходим анализ как на наличие мутаций чувствительности, так и на наличие/отсутствие мутаций устойчивости к ингибиторам тирозинкиназы.
Определение статуса мутации гена EGFR и персонализированный подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволят сделать лечение немелкоклеточного рака легкого более эффективным и приблизиться к международным тенденциям клинической практики.
Какие биоматериалы могут быть отправлены на EGFR-тестирование?
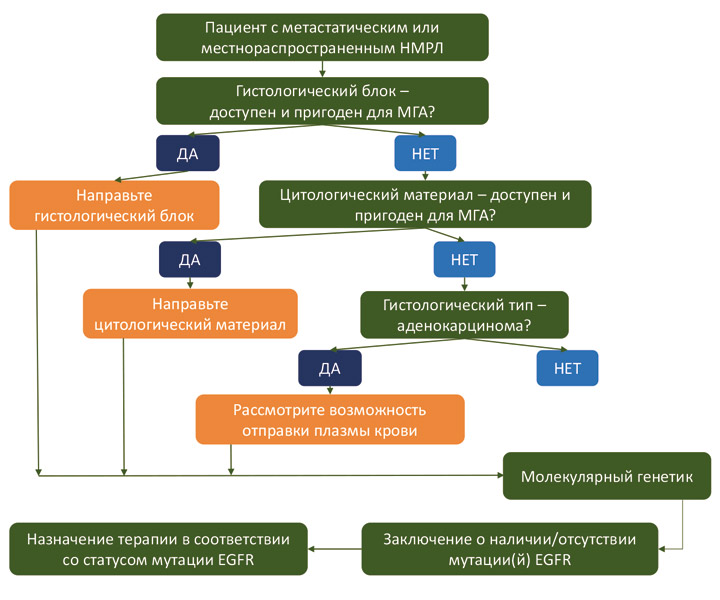
Анализ можно выполнить с использованием гистологического материала, цитологического материала или образца плазмы крови. Предпочтительна отправка гистологического материала, так как именно в этом случае достигается максимальная чувствительность анализа. Результативность тестирования по цитологическому материалу сопоставима с результатами, полученными для гистологических блоков. Если у пациента есть цитологический материал, то (в отсутствие гистологического) он представляет собой приемлемую альтернативу для EGFR-тестирования. В случаях, когда у пациента с аденокарциномой легкого отсутствует материал опухоли, следует рассмотреть возможность отправки плазмы крови на EGFR-тест. Несмотря на относительно низкую чувствительность и высокую трудоемкость анализа по плазме крови, он может быть единственной опцией для пациентов, чей опухолевый материал (гистологический или цитологический) утрачен или полностью израсходован на другие исследования.
Алгоритм выбора биоматериала для выполнения EGFR-тестирования приведен на схеме ниже:
Видеоинструкция по получению плазмы крови для EGFR-тестирования:
О Программе тестирования мутаций гена EGFR у пациентов с немелкоклеточным раком легкого
Каким пациентам необходимо молекулярно-генетическое тестирование на наличие мутации гена EGFR?
Пациентам с распространенным (местно-распространенным или метастатическим) немелкоклеточным раком лёгкого (в частности: аденокарцинома легкого, крупноклеточный рак, плоскоклеточный и аденоплоскоклеточный рак и др.).
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Что значит мутация l858r в гене egfr
Продолжительность жизни больных распространенным EGFR-позитивным НМРЛ, получавших осимертиниб
Осимертиниб является необратимым ингибитором третьего поколения тирозинкиназы рецептора эпидермального фактора роста (EGFR). Препарат избирательно воздействует на клетки немелкоклеточного рака легкого (НМРЛ) с сенсибилизирующими мутациями EGFR, а также резистентной мутацией T790M.
В исследовании 3 фазы FLAURA осимертиниб сравнивался с другими ингибиторами EGFR в первой линии терапии EGFR-положительного НМРЛ. Так, 556 пациентов с мутациями в экзоне 19 или мутацией L858R были рандомизированы в группу осимертиниба или в группу гефитиниба/эрлотиниба. Ранее сообщалось, что в исследовании была достигнута главная цель – риск прогрессирования болезни снижался на 54% у больных, получавших осимертиниб. Данные окончательного анализа общей выживаемости были представлены только сейчас.
Медиана общей выживаемости составила 38,6 месяца в группе осимертиниба и 31,8 месяца в группе ингибиторов EGFR первого поколения. Относительный риск смерти (HR) был 0,8 (95,05% ДИ 0,64-1,00; P=0,046). Через 3 года 28% больных продолжили получать осимертиниб и только 9% – ингибиторы EGFR первого поколения. Медиана продолжительности терапии составила 20,7 месяца и 11,5 месяца в этих группах соответственно. 3-летняя общая выживаемость была 54% и 44%. Согласно подгрупповому анализу, отличий в выживаемости у пациентов азиатской расы не было (HR=1,00), при этом они составляли большую половину популяции (N=347). С другой стороны, эффект осимертиниба на продолжительность жизни у пациентов неазиатской расы был более выраженным, чем в общей группе (HR=0,54). Интересно, что в этом подгрупповом анализе осимертиниб не имел преимуществ по сравнению с ингибиторами первого поколения у пациентов с хорошим статусом по критериям ВОЗ (0) и у пациентов с мутацией L858R.
Частота нежелательных явлений 3 степени и выше была 42% при лечении осимертинибом и 47% – гефитинибом/эрлотинибом.
Авторы сделали вывод, что среди пациентов с ранее нелеченным, распространенным, EGFR-положительным НМРЛ более длительную общую выживаемость имели больные, которые получали осимертиниб. Профиль безопасности для осимертиниба был аналогичен профилю ингибиторов первого поколения, несмотря на большую продолжительность использования препарата.
Источник: Ramalingam SS, et al. N Engl J Med. 2020.
Интервью с экспертом
– Елена Владимировна, какое у Вас общее впечатление от результатов исследования FLAURA?
– Осимертиниб продемонстрировал значительное преимущество по сравнению с ингибиторами тирозинкиназы (ИТК) первого поколения как в отношении выживаемости без прогрессирования и длительности ответа, так и в отношении общей выживаемости. Это первое рандомизированное исследование ИТК EGFR, в котором удалось добиться достоверного увеличения общей выживаемости, ни один из препаратов ИТК прошлых поколений не смог показать таких результатов.
– Считаете ли Вы различия в общей выживаемости между группами статистически значимыми, учитывая цифры относительного риска смерти (HR) 0,8 и различия P=0,046?
– Важно помнить, что первичной конечной точкой исследования была выживаемость без прогрессирования – параметр, который позволяет оценить прямой эффект терапии, в то время как на общую выживаемость влияет не только выбор первой линии терапии, но и все последующие события и стратегия ведения пациента после прогрессирования.
В отношении выживаемости без прогрессирования было продемонстрировано впечатляющее увеличение медианы в группе осимертиниба по сравнению с ИТК первого поколения, кривые выживаемости без прогрессирования начинают расходиться уже при первой оценке эффективности терапии.
Полученные результаты по общей выживаемости демонстрируют, что преимущество по выживаемости без прогрессирования транслируется в увеличение общей выживаемости, несмотря на то, что дизайн исследования предполагал кросс-овер (перекрест) и большое количество пациентов из контрольной группы получили осимертиниб после прогрессирования на ИТК первого поколения. Статистическая мощность исследования закладывалась в первую очередь для оценки именно выживаемости без прогрессирования, однако различия общей выживаемости также достигли статистической значимости, поскольку дизайном исследования значение р для подтверждения статистической значимости при финальном анализе общей выживаемости было определено равным 0,0495.
Медиана общей выживаемости в группе осимертиниба превысила 3 года, а разница между группами составила 6,8 мес. Согласно мнению рабочей группы экспертов Американского общества клинической онкологии (ASCO), клинически значимым улучшением может считаться относительное увеличение медианы общей выживаемости на 20% и более и/или относительный риск (HR) ≤0,8 (что соответствует приросту медианы на 2,5-6 месяцев). Таким образом, можно заключить, что осимертиниб продемонстрировал не только статистически, но и клинически значимое увеличение общей выживаемости.
– Как можно объяснить отсутствие различий по общей выживаемости у больных азиатской расы? А у больных с мутацией L858R?
– Как и при оценке выживаемости без прогрессирования, для общей выживаемости во всех подгруппах пациентов HR составил
Резистентность к ингибиторам тирозинкиназы EGFR:
проблема и пути ее решения
Рак легкого был и остается самой частой причиной смерти от злокачественных заболеваний в мире, при этом немелкоклеточный рак легкого (НМРЛ) регистрируется в 85% случаев [1]. Химиотерапия, составляющая основу лечения НМРЛ, не всегда демонстрирует достаточную эффективность в отношении данного заболевания [2]. Препараты нового класса, ингибиторы тирозинкиназы (ИТК) EGFR, целью которых являются рецепторы эпидермального фактора роста (EGFR), в частности, препарат гефитиниб, и в клинических испытаниях, и на практике показали многообещающие результаты [3]. Чувствительность к ним определяется наличием в опухолевых клетках соматических мутаций в гене EGFR, представляющих собой небольшие делеции аминокислот 747-750 или точечные мутации (наиболее часто в виде замены лейцина на аргинин в кодоне 858 (L858R)) [4]. Было показано, что применение ИТК у пациентов с подтвержденной мутацией в гене EGFR ассоциируется с увеличением частоты объективных ответов, а также способствует повышению продолжительности жизни без прогрессирования [5]. Тем не менее, успех терапии ИТК НМРЛ с мутацией в гене EGFR в подавляющем большинстве случаев носит временный характер: как правило, после года терапии заболевание начинает прогрессировать [6].
Понятие первичной и приобретенной резистентности
Устойчивость, или резистентность к воздействию химиотерапевтических лекарственных средств, является одним из основных ограничений для лечения онкологических заболеваний, в том числе и немелкоклеточного рака легких (НМРЛ). Опухоли могут демонстрировать как резистентность de novo, то есть первичную, так и вторичную, приобретенную устойчивость.
Первичная резистентность имеет место в случаях, когда некоторые присущие раковым клеткам первичные характеристики обусловливают ее устойчивость к данному классу лекарственных препаратов.
Так, около 25% пациентов с НМРЛ с мутациями EGFR в опухолевых клетках не отвечают на терапию ИТК (по сравнению с 90% среди всех больных НМРЛ) [6]. Известно, что некоторые мутации EGFR, расположенные в экзонах 18-21, ассоциируются с первичной резистентностью к ИТК. Например, небольшие инсерции или дупликации в экзоне 20 (такие как D770_N771, NPG, SVQ и другие), которые наблюдаются в 5% случаев НМРЛ, менее чувствительны к ИТК, чем опухоли с мутациями в экзоне 19 и L858R [7].
Первичная резистентность к ИТК может также быть результатом и более редких мутаций в EGFR, которые встречаются наряду с мутациями, ответственными за чувствительность к лекарственным препаратам.
Приобретенная резистентность возникает в случаях, когда первично чувствительные к лекарственному препарату опухолевые клетки становятся устойчивыми к терапии уже во время лечения [8].
Причины приобретенной резистентности к ИТК EGFR
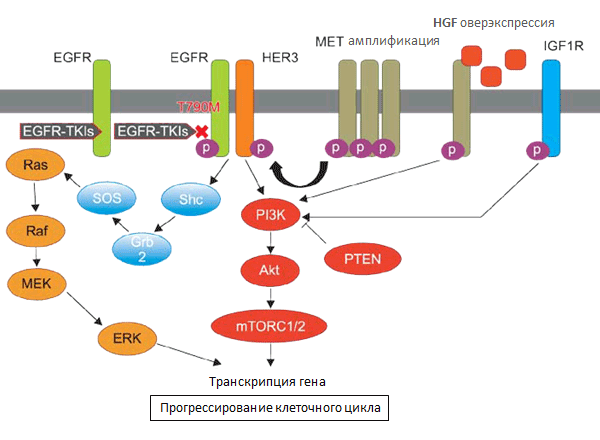
Одной из наиболее распространенных причин приобретенной устойчивости к ИТК является вторичная мутация в экзоне 20, которая заключается в замещении метионина на треонин в положении 790 (Т790М) в домене киназы. Мутации Т790М в EGFR регистрируются более чем в 50% опухолей с приобретенной резистентностью к ИТК [9]. Наряду с Т790М приобретенная устойчивость может быть ассоциирована с другими вторичными мутациями, в том числе L747S (экзон 19) [10], D761Y (экзон 19) [11] и Т854А (экзон 21 в петле активации) [12].
Примерно в 20% случаев вторичной устойчивости к терапии ИТК ее причиной является амплификация онкогена МЕТ, при этом не имеет значения, существует ли мутация Т790М, или нет [13]. Рецептор тирозинкиназы МЕТ мутирует или избыточно экспрессируется при многих опухолях, в том числе НМРЛ. МЕТ образуется главным образом на клетках эпителиального происхождения и активируется его лигандом, фактором роста гепатоцитов (HGF), отвечая за запуск ряда внутриклеточных сигнальных каскадов [14]. МЕТ и HGF необходимы для эмбрионального развития, так как они участвуют в обнаружении дефектов в эпителиально-мезенхимальном переходе во время органогенеза [15]. Кроме того, они играют важную роль в клеточной пролиферации, ангиогенезе, миграции и инвазии клеток, а также морфогенной дифференциации и тканевой организации.
Функция МЕТ в опухолях человека может быть повышена за счет амплификации этого рецептора, что приводит к серьезным изменениям, в том числе, пролиферации опухолевых клеток, снижению апоптоза, ангиогенезу, изменению функции цитоскелета и метастазированию, а также развитию устойчивости к ИТК.
Опухоли примерно 40% пациентов с приобретенной резистентностью к ИТК не имеют вторичной мутации Т790М или амплификации МЕТ. Существуют данные, подтверждающие роль тирозиновой протеинкиназы EGFR/ErbB, которая кодируется геном ERBB2, HER2 в развитии резистентности к ИТК. Так, в работе Ken Takezawa [16] продемонстрировано, что в 12% случаев приобретенной устойчивости была зафиксирована амплификация HER2 (по сравнению с 1% у пациентов с нелеченной аденокарциномой легких).
Известны случаи, когда у больных с изначально диагностированной аденокарциномой с мутацией EGFR и развившейся приобретенной резистентностью к ИТК во время рецидива был выявлен мелкоклеточный рак легкого (МРЛ) [17]. До сих пор остается неизвестным, вызвана ли трансформация НМРЛ в МРЛ наличием в первичной опухоли компонента мелкоклеточного рака, или процесс ассоциирован с трансдифференциацией аденокарциномы.
In vitro была показана связь между эпителиально-мезенхемальным переходом (ЕМП) и устойчивостью к ИТК EGFR [18]. Более того, данные исследований свидетельствуют, что ЕМП можно выявить и в опухоли пациента [19]. С приобретенной резистентностью может быть ассоциировано и усиление сигнализации от рецептора инсулин-подобного фактора роста (IGF1R), хотя эта связь была продемонстрирована только в модели in vitro с использованием линии клеток, экспрессирующей высокий уровни «дикого» типа EGFR [20]. Следует подчеркнуть, что в механизме развития приобретенной резистентности к ИТК EGFR остается немало белых пятен, и активные исследовательские работы в этой области продолжаются. Одним из наиболее изученных на сегодняшний день механизмов формирования резистентности является самый распространенный – вторичная мутация Т790М.
Сегодня известны по крайней мере два молекулярных механизма, объясняющие, каким образом мутация Т790М придает опухоли лекарственную устойчивость. Во-первых, замена метионина на треонин в положении 790 приводит к изменению связывания препарата в кармане АТФ EGFR. Во-вторых, мутация Т790М значительно увеличивает афинность АТФ к EGFR-L858R, практически восстанавливая сродство АТФ до уровня «дикого» типа EGFR. Это восстановление закрывает терапевтическое окно, возникающее вследствие сниженной афинности АТФ к онкогенным мутациям, которые обычно более легко ингибируются по сравнению с диким EGFR [21]. Развитие приобретенной устойчивости вследствие мутации Т790М может происходить двумя путями. В первом случае замещение метионина на треонин в Т790М в опухолевых клетках отсутствует изначально и развивается de novo в одной или более клональной популяции на фоне лечения ИТК EGFR. Во второй модели замещение существует в cis вследствие первичной активирующей мутации у небольшой популяции и «проявляется» в присутствии ИТК EGFR.
Биохимические исследования свойств Т790М показали, что у пациентов с приобретенной резистентностью на фоне вторичной мутации усиливается активность киназы к первично активированным аллелям EGFR, что, возможно, способствует повышению онкогенности [22]. Однако, несмотря на это, больные с мутацией Т790М могут демонстрировать достаточно медленные темпы прогрессирования заболевания [23]. Более того, даже после прекращения терапии ИТК в некоторых случаях регистрируется положительная динамика в развитии заболевания [24]. Это указывает на то, что часть опухолевых клеток все-таки остается чувствительной к ингибированию EGFR. В подтверждение этой теории сообщается о множественных повторных ответах на терапию ИТК после короткого перерыва в таргетной терапии [24]. Добавим, что точный механизм подобного явления до сих пор остается невыясненным.
Возможности лечения НМРЛ у пациентов с приобретенной резистентностью
Учитывая актуальность проблемы резистентности к ИТК, альтернативная длительная стратегия терапии НМРЛ с мутацией EGFR должна учитывать необходимость предотвращения или хотя бы увеличения времени до развития устойчивости. Один из подходов к рационализации терапии заключается в изучении влияния различных стратегий дозирования с использованием уже существующих ИТК. В его пользу говорит недостаточно углубленное изучение оптимальных режимов дозирования для опухолей с мутацией EGFR. Математическое моделирование показывает, что различные схемы дозировки могут положительно влиять на развитие устойчивости (пролонгировать резистентность) без ущерба для эффективности [25].
При уже имеющейся вторичной резистентности к ИТК целесообразно назначение дополнительной терапии, ориентированной на подавление механизма лекарственной устойчивости.
Как минимум две возможности комбинирования терапии ИТК предложены на сегодняшний день, и в первую очередь, при помощи препаратов группы ингибиторов сигнальной трансдукции. Эта схема может применяться при лечении опухолей с подтвержденной мутацией EGFR наряду с избыточной экспрессией и/или аномальной активацией другого фактора роста или рецепторной системы (например, IGFR-I). В таких случаях комбинация ИТК с ингибиторами сигнальной трансдукции (например, PI3K) может обеспечить более длительный ответ на терапию. Практическая проблема состоит в том, что ингибиторы PI3K имеют целый ряд токсических побочных эффектов из-за существенной роли PI3K в физиологических процессах.
Вторая возможность преодолеть или пролонгировать развитие приобретенной резистентности к ИТК состоит в их комбинации с таргетными антиангиогенными препаратами. Этот способ представляется перспективным как минимум по двум причинам. В первую очередь, его применение сопряжено с феноменом «двойного удара», при котором выживаемость пациентов обусловлена элиминацией эндотелиальных клеток в дополнение к непосредственной антиопухолевой активности ИТК. К тому же снижение порога выживаемости опухолевых клеток вследствие ингибирования EGFR может способствовать повышению восприимчивости опухоли к антиангиогенной терапии [26]. Таким образом, комбинирование ИТК и антиангиогенных препаратов может повышать эффективность терапии, уменьшая вероятность выживания и экспансии резистентных популяций опухолевых клеток.
Успех комплексной терапии резистентности к ИТК зависит от возможности быстро определить механизм устойчивости. С этой целью пациенты с НМРЛ и мутацией EGFR в опухолевых клетках, у которых терапия ИТК была эффективной, при развитии лекарственной резистентности должны подвергнуться повторной биопсии или определению циркулирующей опухолевой ДНК в плазме с целью точного анализа механизма устойчивости.
Проведение повторных биопсий затруднено вследствие инвазивности процедуры, а также вероятности внутриопухолевой гетерогенности, которая может привести к получению некорректного результата [27]. Исследования показывают, что геномные изменения в солидных опухолях могут быть охарактеризованы с помощью массивного параллельного секвенирования циркулирующих внеопухолевых молекул ДНК, высвобожденных из опухолевых клеток. Этот сравнительно экономичный и быстрый метод, получивший название неинвазивной жидкостной биопсии, может значительно облегчить анализ механизма резистентности [28].
Неинвазивным методом – выделением опухолевой ДНК [29], а также циркулирующих опухолевых клеток из плазмы [30] – может быть успешно выявлена мутация Т790М. Неинвазивный анализ приобретенной резистентности путем выделения ДНК в плазме результативен и при других механизмах развития резистентности [31].
Молекулярно-генетическое тестирование в плазме, с помощью которого можно определить и качественное, и количественное содержание мутаций, сопряженных с резистентностью к ИТК, позволяет дать оценку эффективности терапии ИТК и течению заболевания. Так, в российском исследовании Д.Д. Сакаевой и М.Г. Гордиева [32], анализировавшем динамику мутаций в гене EGFR в цоДНК при распространенном немелкоклеточном раке легкого на фоне терапии гефитинибом, было показано, что объективный ответ на терапию коррелировал с исчезновением активирующих мутаций EGFR в плазме. Повторное же появление в плазме крови активирующих мутаций EGFR и/или Т790М являлось одним из предикторов прогрессии НМРЛ.
Осимертиниб: таргетная терапия Т790М-позитивного НМРЛ
Высокая частота активирующих мутаций, сопряженных с резистентностью к ИТК EGFR, обусловила активизацию поиска новых таргетных препаратов, которые помогли бы решить проблему устойчивости. Определенно самым значимым достижением в терапии Т790М-позитивного НМРЛ последних лет стало создание первого ИТК третьего поколения, действующего как на активирующую мутацию, так и на мутацию вторичной резистентности Т790М в гене EGFR, – осимертиниба. Осенью 2017 года препарат Тагриссо ® (осимертиниб) был зарегистрирован в РФ для терапии местнораспространенного или метастатического НМРЛ с мутацией Т790М в гене EGFR.
Осимертиниб представляет собой необратимый ингибитор ТК EGFR, эффективный при наличии сенсибилизирующих мутаций гена EGFR и мутации Т790М, связанной с развитием резистентности к ИТК [33]. Препарат селективно действует на клетки как с активирующими мутациями гена EGFR (мутация L858R в 21-м экзоне, делеции в 19 экзоне), так и с мутацией резистентности Т790М, являющейся основной причиной резистентности к ИТК EGFR 1-2 поколений.
Осимертиниб отличается высокой активностью и ингибирующим действием в отношении EGFR во всех клинически значимых линиях НМРЛ, несущих сенсибилизирующие мутации EGFR и мутацию резистентности Т790М, что приводит к подавлению клеточного роста [33]. При этом препарат демонстрирует низкую активность в отношении клеточных линий, имеющих дикий тип EGFR (IC50 461-650 наномоль для различных клеточных линий).
По сути, появление нового эффективного таргетного препарата для пациентов с прогрессирующим НМРЛ означает изменения в алгоритмах диагностики и терапии заболевания. Пациентам с прогрессированием на фоне терапии ИТК EGFR показано проведение повторного молекулярно-генетического тестирования для определения молекулярного профиля опухоли и выбора дальнейшей тактики терапии. Так, в руководстве Европейского общества медицинской онкологии (ESMO) и Всеобщей национальной онкологической сети (NCCN) по диагностике, лечению и наблюдению больных раком легкого указано, что для пациентов с клиническим прогрессированием на фоне предыдущего лечения ингибиторами тирозинкиназ EGFR 1-2 поколений и подтвержденной мутацией Т790М должно быть предложено лечение осимертинибом в дозе 80 мг в сутки [35, 36].
Отечественные клинические рекомендации и руководства по лекарственному лечению злокачественных опухолей АОР рекомендуют проведение таргетной терапии осимертинибом до прогрессирования в качестве 2-й линии НМРЛ после прогрессирования на фоне приема ингибитора тирозинкиназы EGFR в случае выявления мутации Т790М в гене рецептора эпидермального фактора роста (EGFR) [37].
Вывод
Ингибиторы ТК, как препараты молекулярной таргетной терапии, открыли новые перспективы в лечении НМРЛ с активирующими мутациями EGFR. Однако генетическая нестабильность опухолевых клеток приводит к развитию приобретенной резистентности к ИТК. Преодоление устойчивости опухоли – серьезный вызов, который стоит перед современными учеными. Определенные положительные результаты в борьбе с лекарственной устойчивостью, которые продемонстрировали новые стратегии дозирования, а также комбинированная терапия, позволяют смотреть в будущее с некоторой долей оптимизма.