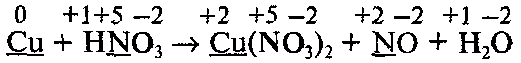что значит реакция окислительно восстановительная
Окислительно-восстановительные реакции (ОВР)
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn +7 + 5ē = Mn +2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
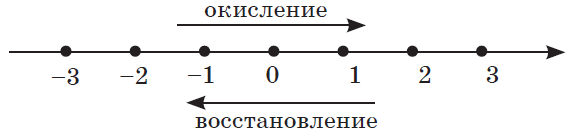
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:
Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):
В последнюю очередь уравниваем числа атомов водорода и кислорода:
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:
Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:
В заключение уравняем числа атомов водорода и кислорода:
Урок №67-68. Окислительно-восстановительные реакции
ОКИСЛИТЕЛЬ-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
ОВР – это реакции, в ходе которых атомы изменяют свои степени окисления.
Основные положения теории ОВ реакций
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
При восстановлении степень окисления понижается.
F +9 ) 2 ) 7
F 0 + 1ē → F -1 в осстанавливается (окислитель)
В зял – В осстановился – Понизил СО
Na +11 ) 2 ) 8 ) 1
Na 0 – 1ē → Na +1 о кисляется (восстановитель)
О тдал – О кислился – Повысил СО
Задания для закрепления
№3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде:
А) Zn + HCl = H 2 + ZnCl 2
Б) Fe + CuSO 4 = FeSO 4 + Cu
№4. Даны схемы уравнений реакций:
СuS + HNO 3 (разб.) = Cu(NO 3 ) 2 + S + NO + H 2 O
K + H 2 O = KOH + H 2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
№5. Расставьте коэффициенты в ОВР методом электронного баланса, укажите окислитель и восстановитель
MnO 2 + HCl = MnCl 2 + Cl 2 + H 2 O
H 2 S + KMnO 4 + H 2 SO 4 =S + MnSO 4 + K 2 SO 4 + H 2 O
Реакции окислительно-восстановительные (часть С)
Теория к заданию 30 из ЕГЭ по химии
Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее
Признаки окислительно-восстановительных реакций
Многообразие классификаций химических реакций по различным признакам (числу и характеру реагирующих и образовавшихся веществ, направлению, фазовому составу, тепловому эффекту, использованию катализатора) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
Например, в реакции
степени окисления атомов химических элементов после реакции не изменились. А вот в реакции взаимодействия соляной кислоты с цинком
а каждый атом цинка отдал два электрона:
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Окислитель и восстановитель. Окисление и восстановление
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
Отдавать свои электроны могут отрицательные ионы:
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
Метод электронного баланса
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакция взаимодействия алюминия с хлоридом меди (II) описывается схемой:
а электронные уравнения будут иметь вид:
Молекулярное уравнение этой реакции:
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Известно, что первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространяется на концентрированную серную кислоту и азотную кислоту любой концентрации.
Подчеркнем знаки химических элементов, изменивших свои степени окисления:
Составим электронные уравнения, т.е. отразим процессы отдачи и присоединения электронов:
и уравняем число атомов водорода:
Коррозия металлов
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто повторяем слова «ржавчина», «ржавление», видя коричнево-желтый налет на изделиях из железа и его сплавов. Ржавление — это частный случай коррозии.
Коррозия — это процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т.д.
Коррозия металлов бывает сплошной и местной.
Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов — точечная. Она заключается в образовании сквозных поражений, т.е. точечных полостей — питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений.
Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования.
Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличивать расход металла, что требует дополнительных экономических затрат.
Из всего сказанного следует, что очень важной проблемой является изыскание способов защиты металлов и сплавов от коррозии. Они весьма разнообразны. Но для их выбора необходимо знать и учитывать химическую сущность процессов коррозии.
По химической природе коррозия — это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями-неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах.
II. Электрохимическая коррозия происходит в токопроводящей среде (в электролите с возникновением внутри системы электрического тока). Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Рассмотрим разрушение железного образца в присутствии примеси олова.
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
Итак, электрохимическая коррозия — окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл).
На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение).
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и, конечно же, хорошо из вестные вам электролиты — растворы солей, щелочей, кислот.
Вы, очевидно, помните, что зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия, иногда хлорид кальция). Образующиеся растворы стекают в канализационные трубопроводы, создавая тем самым благоприятную среду для электрохимической коррозии подземных коммуникаций.
Способы защиты от коррозии
Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии:
1. Шлифование поверхности изделий, чтобы на них не задерживалась влага.
3. Нанесение защитных покрытий. Рассмотрим их виды.
А. Неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы.
В. Металлические — это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т.д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты.
А. Протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк.
Б. Катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая кон струкция.
А. Введение веществ-ингибиторов, замедляющих коррозию.
Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись только окалина и ржавчина. Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Б. Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.