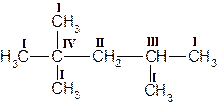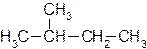что значит третичный атом углерода
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
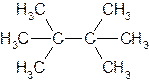
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Большая Энциклопедия Нефти и Газа
Третичный атом углерода связан в молекуле с тремя углеродными атомами. [2]
Третичные атомы углерода инертны в реакциях SN2, однако было установлено, что / г-нитрокумилхлорид легко реагирует с рядом нуклеофилов. [3]
Все третичные атомы углерода в цепи имеют одинаковую пространственную конфигурацию, а вся цепь имеет спиральную структуру. [4]
Если третичный атом углерода не экранирован или если в молекуле два и более третичных атома, то в этом случае углеводород нестабилен и экранирование длинной цепью или четвертичным атомом не меняет положение. [5]
Наличие третичного атома углерода и, особенно, кратных связей ОС ( как концевых, так и внутренних) в составе макромолекул оказывает существенное влияние на протекание термокаталитической деструкции полиолефинов. Соотношение РП / Р П уменьшается лишь при глубоких степенях превращения. Не исключена возможность инициирования деградации макромолекул и по концевым винильным группам. [7]
Наличие третичного атома углерода в молекуле гексана облегчает протекание реакции дейтероводородного обмена. [8]
Свойства третичного атома углерода как характеристического структурного элемента выражены значительно слабее, чем у четвертичного атома углерода. Таким образом, линии в этой области спектра не являются характеристическими для третичного атома углерода. [9]
При третичном атоме углерода разрыв связи С-С с образованием кетонов невозможен. [10]
Каждый из третичных атомов углерода в соединениях 15 является асимметрическим центром. Ла их синтез ( по 1мг) не хватит уже всех нуклонов во всей наблюдаемой Все-лепной. Так, от абстрактной математической бесконечности мы приходим к вполне реальной, истинной неисчерпаемости многообразия возможных органических соединений. [12]
При наличии третичных атомов углерода в цепи полимера химическая стойкость будет выше у тех из них, у которых третичный атом углерода частично или полностью экранирован объемными заместителями. [13]
Вследствие наличия третичных атомов углерода полипропилен чувствителен к действию кислорода, особенно при повышенных температурах, что обусловливает его большую склонность к старению по сравнению с полиэтиленом и сополимерами этилена с пропиленом. Поэтому в процессе переработки в полипропилен добавляют стабилизаторы. [14]
Атом углерода: характеристики, строение, гибридизация
Содержание:
В атом углерода это, пожалуй, самый важный и символичный из всех элементов, потому что благодаря ему возможно существование жизни. Он включает в себя не только несколько электронов или ядро с протонами и нейтронами, но и звездную пыль, которая в конечном итоге объединяется и образует живые существа.
Кроме того, атомы углерода находятся в земной коре, хотя их содержание не сопоставимо с металлическими элементами, такими как железо, карбонаты, углекислый газ, нефть, алмазы, углеводы и т. Д., Они являются частью его физические и химические проявления.
Если бы атом углерода не обладал качествами, которые его характеризуют, органическая химия не существовала бы полностью. Некоторые провидцы видят в нем новые материалы будущего через создание и функционализацию их аллотропных структур (углеродные нанотрубки, графен, фуллерены и т. Д.).
Характеристики атома углерода
Атом углерода обозначается буквой C. Его атомный номер Z равен 6, следовательно, он имеет шесть протонов (красные кружки со знаком «+» в ядре). Кроме того, он имеет шесть нейтронов (желтые кружки с буквой «N») и, наконец, шесть электронов (синие звезды).
Сумма масс его атомных частиц дает среднее значение 12,0107 u. Однако атом на изображении соответствует изотопу углерода 12 ( 12 C), который состоит из d. Другие изотопы, такие как 13 C и 14 C, менее распространенные, различаются только числом нейтронов.
Таким образом, если бы эти изотопы были нарисованы, то 13 C будет иметь дополнительный желтый кружок, а 14 С, еще два. Это логически означает, что они тяжелее атомов углерода.
Какие еще характеристики можно отметить в этом отношении? Он четырехвалентный, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (IVA) периодической таблицы Менделеева, а точнее в блоке p.
Это также очень универсальный атом, способный связываться почти со всеми элементами таблицы Менделеева; особенно с самим собой, образуя линейные, разветвленные и ламинарные макромолекулы и полимеры.
Состав
Обратите внимание, однако, что две звезды имеют более темный оттенок синего, чем остальные четыре. Зачем? Поскольку первые два соответствуют внутреннему слою 1s 2 или [He], который непосредственно не участвует в образовании химических связей; в то время как электроны во внешней оболочке, 2s и 2p, делают.
Орбитали s и p не имеют одинаковой формы, поэтому изображенный атом не соответствует действительности; в дополнение к огромной диспропорции расстояния между электронами и ядром, которое должно быть в сотни раз больше.
Следовательно, структура атома углерода состоит из трех орбиталей, на которых электроны «плавятся» в размытые электронные облака. А между ядром и этими электронами есть расстояние, открывающее огромную «пустоту» внутри атома.
Гибридизация
Имеется одна доступная p-орбиталь, которая пуста и заполнена дополнительным электроном на атоме азота (2p 3 ).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для ее образования; однако видно, что в исходное состояние атома углерода у него есть только два неспаренных электрона (по одному на каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, а значит, он образует только две связи (–C–).
Итак, как атом углерода может образовывать четыре связи? Для этого вы должны переместить электрон с орбитали 2s на орбиталь 2p с более высокой энергией. Это сделано, в результате четыре орбитали выродиться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены).
Этот процесс известен как гибридизация, и благодаря ему атом углерода теперь имеет четыре sp-орбитали. 3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с его четырехвалентностью.
зр 3
Таким образом, можно идентифицировать углеродный sp 3 поскольку он образует только четыре одинарные связи, как в молекуле метана (CH4). И вокруг этого можно наблюдать тетраэдрическое окружение.
Перекрытие зр орбиталей 3 она настолько эффективна и стабильна, что одинарная связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные карбонатные структуры и неизмеримое количество органических соединений. Помимо этого, атомы углерода могут образовывать другие типы связей.
зр 2 и зр
Атом углерода также способен принимать другие гибридизации, которые позволяют ему образовывать двойную или даже тройную связь.
В случае sp-гибридизации есть две sp-орбитали, разнесенные на 180º, таким образом, что они рисуют линейную электронную геометрию. На этот раз у них есть две чистые 2p-орбитали, перпендикулярные друг другу, которые позволяют углероду образовывать тройные связи или две двойные связи: –C≡C– или ·· C = C = C ·· (центральный углерод имеет sp-гибридизацию. ).
Обратите внимание, что всегда (обычно), если добавляются связи вокруг углерода, будет обнаружено, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур. Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
Классификация
Как классифицируются атомы углерода? Это больше, чем классификация по внутренним характеристикам, это на самом деле зависит от молекулярного окружения. Другими словами, атомы углерода в молекуле можно классифицировать следующим образом.
Первичный
Первичный углерод связан только с одним другим углеродом. Например, молекула этана CH3–CH3 Он состоит из двух связанных первичных атомов углерода. Это сигнализирует о конце или начале углеродной цепи.
Вторичный
Это тот, который связан с двумя атомами углерода. Таким образом, для молекулы пропана CH3–CH2–CH3, средний атом углерода вторичен (метиленовая группа, –CH2–).
Третичный
Третичные атомы углерода отличаются от остальных тем, что от них отходят ответвления основной цепи. Например, 2-метилбутан (также называемый изопентаном), CH3–CH(CH3) –CH2–CH3 в нем жирным шрифтом выделен третичный углерод.
Четвертичный
И, наконец, четвертичные атомы углерода, как следует из их названия, связаны с четырьмя другими атомами углерода. Молекула неопентана, C(CH3)4 он имеет четвертичный атом углерода.
Приложения
Атомная единица массы
Средняя атомная масса 12 C используется как стандартная мера для расчета масс других элементов. Таким образом, водород весит одну двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как единица атомной массы u.
Таким образом, другие атомные массы можно сравнить с массой 12 C и 1 З. Например, магний ( 24 Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают CO2 в процессе фотосинтеза выделять кислород в атмосферу и действовать как легкие растений. Когда они умирают, они превращаются в древесный уголь, который после сжигания снова выделяет CO.2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая множество микроорганизмов.
Когда микроорганизмы умирают, твердое вещество остается в отложениях биологического разложения, и через миллионы лет оно превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии сжиганию угля, оно способствует выбросу большего количества CO.2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода снизу. Это связано со стабильностью его связей, которая позволяет ему образовывать цепочки и молекулярные структуры, из которых состоят макромолекулы, столь же важные, как ДНК.
ЯМР-спектроскопия 13 C
В 13 C, хотя его доля намного меньше, чем у 12 C, его распространенности достаточно для выяснения молекулярных структур с помощью спектроскопии ядерного магнитного резонанса углерода 13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13 C и к каким функциональным группам они принадлежат. Таким образом, можно определить углеродный скелет любого органического соединения.
Ссылки
Линейное расширение: что это такое, формула и коэффициенты, пример
В чем разница между государством и правительством?