что значит условно патогенные бактерии
УСЛОВНО-ПАТОГЕННЫЕ МИКРОБЫ
Условно-патогенные микробы — микробы, способные при снижении естественной резистентности макроорганизма вызывать заболевания, для к-рых характерно отсутствие нозологической специфичности.
Условно-патогенные микробы встречаются среди всех категорий микробов: бактерий (Staphylococcus, Corynebacterium, Clostridium, Escherichia, Erwinia, Pseudomonas, Proteus, Providencia, Serratia, Moraxella, Veillonella, Haemophilus и др.), микоплазм (Mycoplasma). грибков (Candida, Aspergillus), простейших (Trichomonas, Lamblia), а также вирусов (Herpes, Enterovirus и др.)- Как правило, Условно-патогенные микробы являются представителями нормальной микрофлоры человека (см.) не только ее факультативной части, не постоянно встречающейся в норме, но и облигатной (бактероиды, лактобациллы, энтерококки). В результате взаимодействия макроорганизма и окружающих его микробов произошел отбор определенных видов, заселивших соответствующие экологические ниши макроорганизма. Важным условием развития инфекционного процесса, вызванного У.-п. м., является преодоление ими колонизационной резистентности (см. Селективная деконтаминация), к-рую создают определенные сочетания представителей нормальной микрофлоры человека. При этом возбудителями инф. процесса могут быть как представители собственной микрофлоры макроорганизма, так и У.-п. м., попадающих в него извне.
Для заболеваний, вызванных Условно-патогенными микробами, характерен ряд особенностей: они развиваются у недоношенных и ослабленных детей, людей с пониженной иммунологической реактивностью в результате соматических заболеваний, оперативных вмешательств, применения лекарственных средств, обладающих иммунодепрессивным действием (гормоны, цитостатики и др.). Инф. процессы, вызванные У.-п. м., лишены нозологической специфичности: один и тот же вид микробов может вызвать воспалительные процессы различных органов и тканей, и, напротив, разные виды микробов способны вызывать гнойно-воспалительные процессы одного и того же органа или ткани. Плейотропность У.-п. м.. т. е. способность размножаться в различных органах и тканях, зависит от наличия у них большого числа факторов патогенности (см. Патогенность). К ним относят адгезины (напр., пили), способствующие прикреплению микробов к клеткам макроорганизма, капсулы, К- и О-антигены, белки наружной мембраны, сообщающие микробам устойчивость к фагоцитозу и бактерицидному действию нормальной сыворотки, ферменты, способствующие проникновению и распространению микробов, экзо- и эндотоксины, гемолизины, факторы колициногенности и др. (см. Вирулентность). Различные штаммы одного и того же вида У.-п. м. могут характеризоваться различной комбинацией признаков. Наблюдается относительная связь нек-рых признаков микробов с локализацией инф. процесса. Так, для штаммов E. coli (см. Кишечная палочка), выделенных при менингитах, характерно наличие антигена К1, специфического для менингококков группы В.
Условно-патогенные микробы способны вызывать заболевания в различных ассоциациях: бактерии разных видов, бактерии и вирусы, бактерии и микоплазмы и др. (см. Смешанные инфекции). При смешанных бактериальных инфекциях возможен синергизм возбудителей в случае их патогенного воздействия на организм. Так, слабо патогенные вейллонеллы могут прилипать к эпителию под влиянием внеклеточной глюкозотрансферазы, продуцируемой Streptococcus salivarius, аэробные бактерии, снижая окислительно-восстановительный потенциал тканей, могут способствовать размножению анаэробов.
Этиологическая структура заболеваний, вызванных У.-п. м., отличается динамичностью: происходит постоянная смена возбудителей гнойно-воспалительных процессов, определяющаяся факторами окружающей среды, а также изменчивостью биол. свойств микробов. Одним из основных факторов, влияющих на этиол. структуру этих инфекций, является применение антибиотиков. Резко возросшая роль У.-п. м. в инф. патологии человека связана с применением антибиотиков широкого спектра действия, к-рые вызвали нарушение экологического баланса (см. Дисбактериоз) и развитие множественной лекарственной устойчивости микроорганизмов (см.). У.-п. м. являются основными возбудителями внутрибольничных инфекций (см.). Основной причиной этого является их природная или приобретенная устойчивость к антибактериальным препаратам. Приобретенная устойчивость в большинстве случаев детерминируется R-плазмидами (см. R-фактор), к-рые обнаружены практически у всех видов У.-п.м. Особенно часто они присутствуют в госпитальных штаммах микробов, выделяемых в леч. учреждениях, где создаются благоприятные условия для распространения R-плазмид в результате селективного действия антибиотиков. Отмечается связь полирезистентности с определенным фаготипом (фаговаром) у госпитальных штаммов стафилококков, серотипом (сероваром) клебсиелл, псевдомонад и др. Возможна также коинтеграция (объединение) плазмид с факторами вирулентности, что повышает патогенный потенциал У.-п. м.
Очевидна относительность деления определенных видов микробов на патогенные и условно-патогенные. Так, Salmonella typhimurium является возбудителем зоонозов (см.) и пищевых токсикоинфекций (см. Токсикоинфекции пищевые). Сформированные резистентные к антибиотикам клоны сальмонелл должны рассматриваться как У.-п. м.: они вызывают внутрибольничные инфекции в педиатрических и родовспомогательных стационарах.
Резистентные к антибиотикам госпитальные штаммы микробов лучше выживают в окружающей среде и обладают повышенной способностью к колонизации (заселению), поэтому в условиях стационара они интенсивно распространяются и вызывают развитие тяжелых заболеваний у ослабленных людей. У здоровых людей, как правило, наблюдается формирование бактерионосительства (см. Носительство возбудителей инфекций).
Микробиологическая диагностика заболеваний, вызываемых У.-п. м., имеет особенности, обусловленные свойствами этой группы микробов и характером вызываемых ими процессов. Полимикробная этиология и отсутствие нозол. специфичности определяют необходимость выделять и изучать все виды микробов, содержащихся в патол. материале. Это отличает микробиол. исследования при заболеваниях, вызванных У.-п. м., от исследований при заболеваниях, вызванных истинно патогенными микробами, когда ведется поиск определенного (специфического) возбудителя. В связи с этим выделение возбудителей из клин, материала проводят на питательных средах, позволяющих выращивать максимальное число видов микробов. Дальнейшему изучению — идентификации и определению чувствительности к антибактериальным препаратам — подвергаются культуры, имеющие этиол. значение. Уровень идентификации микробов (см.) может быть различным. Для проведения соответствующей терапии идентификацию возбудителя достаточно проводить до рода или вида. При проведении эпидемиол. исследований — установлении источника возбудителей инфекции, путей распространения микробов в леч. учреждении — идентификацию выделенных культур проводят до штамма (см.).
Принадлежность У.-п. м. к нормальной микрофлоре макроорганизма затрудняет определение этиол. значимости этих микробов в инф. процессе. В связи с этим при микробиол. диагностике заболеваний, вызываемых У.-п. м., используют методы, позволяющие отличать контаминацию (загрязнение) исследуемого материала нормальной микрофлорой. К ним относятся количественные методы определения степени микробной обсемененности исследуемого материала. Установить этиол. роль У.-п. м. помогает повторное выделение культуры от больного и увеличение ее количества в исследуемом материале в процессе заболевания. Существенное значение имеет определение патогенных свойств у выделенных культур микробов, что свидетельствует об их этиол. значимости. При этом определяют принадлежность культуры возбудителя к определенным серотипам (сероварам), чувствительность к бактериофагам, колицинам и другие признаки, коррелирующие с патогенностью.
Серологические исследования (см.) очень важны для подтверждения этиол. значимости культур У.-и. м., выделенных от больных. Однако эти исследования менее информативны, чем при инфекциях, вызванных истинно патогенными микробами, что связано с медленным накоплением антител к У.-п. м. и невысоким титром антител. В связи с этим серологические исследования чаще проводят при хронических длительно текущих процессах, а также с целью ретроспективной диагностики острых заболеваний. Оптимальные результаты получают при исследовании процесса накопления антител в парных сыворотках, взятых от больного в динамике заболевания. При этом используют реакцию пассивной гемагглютинации (см. Гемагглютинация), метод иммунофлюоресценции (см. Иммунофлюоресценция) и другие методы.
Лечение заболеваний, вызванных У.-п. м., проводят с помощью антибиотиков, сульфаниламидов и других химиотерапевтических средств. Назначение их зависит от вида возбудителя и его чувствительности к лекарственным препаратам. Желательно применять препараты, не действующие на нормальную микрофлору (см. Селективная деконтаминация). Используют также препараты, повышающие защитные силы организма больного, напр, продигиозан (см.), а также бактериальные препараты, корректирующие состав нормальной микрофлоры, напр. колибактерин (см.), бифидумбактерин (см.) и др.
В профилактике заболеваний, вызванных Условно-патогенными микробами, значительная роль принадлежит соблюдению сан.-гиг. режима и правил профилактики в леч. учреждении (см. Внутрибольничные инфекции). Большое значение имеет рациональное использование антибиотиков (см.) в условиях стационара, уменьшающее распространение в госпитальной среде лекарственно-устойчивых штаммов У.-п. м.
Для специфической профилактики стафилококковой инфекции (см.) используют стафилококковый анатоксин. Разрабатываются вакцины против синегнойной и протейной инфекций.
Библиогр.: Беляков В. Д. и др. Госпитальная инфекция, Л., 1976; Каган Г. Я. О патогенных потенциях семейства Mycoplasmataceae, Журн. микр., эпид. и иммун., № И, с. 33, 1972; Кудлай Д. Г. Внехромосомные факторы наследственности бактерий и их значение в инфекционной патологии, М., 1977; Лошонци Д. Внутрибольничные инфекции, пер. с венгер., М., 1978; Петровская В. Г. О так называемых условно патогенных микроорганизмах, Журн. микр., эпид. и иммун., № 6, с. 94, 1974; Тимаков В. Д. и Петровская В. Г. Актуальные проблемы медицинской микробиологии: достижения, задачи и перспективы, там же, № 9, с. 3, 1977; Costerton J. W., Irvin R. Т. a. Cheng К. J. The bacterial glycocalyx in nature and disease, Ann. Rev. Microbiol., v. 35, p. 299, 1981; Microbial pathogenicity in man and animals, ed. by H. Smith a. J. H. Pearce, Cambridge, 1972; Mims C. A. The pathogenesis of infectious disease, L.— N. Y., 1976; Smith H. Microbial surfaces in relation of pathogenicity, Bact. Rev., v. 41, p. 475, 1977.
В. Г. Петровская; С. Д. Воропаева (диагноз, лечение, профилактика).
Условно-патогенная микрофлора
В организме существует множество бактерий, которые находятся с человеком в разных взаимоотношениях. Большую часть микрофлоры (микробиоценоза) представляют микроорганизмы, которые сосуществуют с человеком на основе симбиоза. Иными словами, основная масса микробов получает от человека пользу (в виде постоянной температуры и влажности, питательных веществ, защиты от ультрафиолета и так далее). В то же время эти бактерии сами приносят пользу, синтезируя витамины, расщепляя белки, соперничая с болезнетворными микроорганизмами и выживая их со своей территории. И одновременно с такими полезными бактериями у человека есть «сожители», которые в небольших количествах не приносят существенного вреда, но при определенных условях становящиеся болезнетворными. Такую часть микробов называют условно-патогенной микрофлорой.
Условно-патогенные микроорганизмы (УПМ) желудочно-кишечного тракта борются за свое выживание, поэтому их поколения вырабатывают устойчивость к конкурентной нормальной флоре. Лакто– и бифидобактерии в процессе жизнедеятельности производят вещества, сходные с антибиотиками по своему действию. Кроме того, сам организм, благодаря иммунной системе сдерживает размножение болезнетворных бактерий. Прием алкоголя и табакокурение, не говоря уже о наркомании, нервные стрессы, физические перегрузки, возрастные изменения, физиологическое несовершенство лимфатической системы (у маленьких детей), различные заболевания (в первую очередь – вирусного происхождения) – все это нарушает нормальный баланс микрофлоры в желудочно-кишечном тракте, приводит к гибели полезных микроорганизмов. Природа не терпит пустоты, и на смену погибшим полезным бактериям приходят условно-патогенные. С этого момента начинается развитие дисбиоза и дисбактериоза. Если же бывшие условно-патогенными, а теперь ставшие болезнетворными, бактерии покидают свое привычное место жительства, проникая через тканевые барьеры, то развивается оппортунистическая инфекция.
Состав условно-патогенной микрофлоры
Нормофлора у каждого человека индивидуальна по своему составу. То же самое касается и условно-патогенной микрофлоры, как части нормального биоценоза. Да-да! Несмотря на свою пагубную деятельность, условно-патогенные микроорганизмы нужны нормальной микрофлоре. Бактерии живут по принципу: «Что нас не убивает, то делает сильнее». То есть, постоянно соперничая за место, наши полезные бактерии становятся более выносливыми, вырабатывают «навыки» борьбы с УПМ на генном уровне. То же самое происходит и с остальной иммунной системой. Так что, можно сказать, что даже условно-патогенные микробы нужны нашему организму в качестве своеобразного «тренера» иммунитета.
К условно-патогенным микроорганизмам желудочно-кишечного тракта относится практически все семейство Enterobacteriaceae. Сюда входят клебсиелла пневмония, энтеробактеры (аэрогенес и клоацеа), цитробактер фреунди, протеи. Предельно допустимой нормой для семейства энтеробактерий в ЖКТ является показатель в 1000 микробных единиц. Из семейства стафилококков в кишечнике обитают на постоянной основе негемолитические формы стафилококка, количество которого может достигать в норме 10 000 микроорганизмов на 1 гкала. Гемолитических форм, то есть растворяющих эритроциты, в кишечнике в норме быть не должно вообще. Из УПМ очень большое количество бактероидов (фрагилис, например), можно встретить в толстом отделе кишечника. Эти бактерии принимают участие в жировом (липидном) обмене. Но их количество не должно выходить за пределы 10 9 колониеобразующих единиц, то есть отдельных особей, в1 г кала. В кишечнике можно также встретить небольшое количество стрептококков, которые помимо антагонистических (враждебных) свойств несут также и полезную нагрузку в нашем организме – они стимулируют выработку иммуноглобулинов, а также активно подавляют патогенных бактерий типа сальмонелл, шигелл.
Среди представителей нормофлоры также есть микроорганизмы, способные вызывать дисфункции кишечника. То есть, собственно эти бактерии относят к условно-патогенным, но тем не менее, их полезные свойства преобладают над патогенными. Такими бактериями являются энтерококки фекалис и фециум.
Из представителей условно-патогенной микрофлоры желудочно-кишечного тракта есть и такие, которые весьма редко, но все же могут вызывать заболевания. К таким можно отнести вейлонелл и фузобактерий. Их локализация, преимущественно, ограничена ротовой полостью. Но при попадании в кишечник, по данным некоторых ученых, они могут вызывать разного рода воспаления. Сведения о роли этих микробов в возникновении заболеваний ЖКТ весьма разрозненные и поэтому врачи, в лабораторных исследованиях причин дисбактериозов, особого внимания на них не обращают.
В отличие от вейлонелл и фузобактерий, хеликобактер пилори изучен довольно неплохо. Ему было отведено большое внимание в последнее время в связи с тем, что средой обитания он избрал желудок. Гастриты, язвенная болезнь желудка инфекционной природы в первую очередь связывается именно с хеликобактером. Лечение и приведение концентрации этого микроба к норме – довольно сложный процесс. Основная сложность терапии – высокая устойчивость хеликобактера к антимикробным препаратам. Еще бы – ведь он обитает в среде с повышенной кислотностью и через него проходят все лекарственные препараты. Какие должны быть защитные механизмы у бактерии, чтобы не только выживать, но и прекрасно себя чувствовать в подобных условиях!
Для того чтобы сдерживать патогенные свойства УПМ организму необходима помощь. Человек должен понимать, что его здоровье – в его же руках. Какими бы замечательными антагонистическими свойствами ни обладали наши эшерихии, бифидобактерии и лактобактерии, им нужна наша помощь, которая заключается в разумном подходе к образу жизни, и в первую очередь – к питанию.
Нужно ли избавляться от условно-патогенной флоры?
Мы – дом для бактерий, вирусов и грибов. Это не хорошо и не плохо, просто данность. Оставить только хорошие микроорганизмы, поднять иммунитет при помощи БАДов, избавиться выборочно только от условных патогенов не получится. Главное правило здорового человека в вопросе микрофлоры – «если все работает – не трогай».Разбираемся с условными патогенами и рассказываем, когда все-таки надо обращаться к врачу.
Что значит условно-патогенная
Патоген – это микроорганизм или чужеродный белок, который может вызвать заболевание. Словосочетание «условно-патогенный» означает то, что этот белок может вызвать болезнь только в определенных условиях:
Условно-патогенная флора есть у всех людей: и здоровых и больных. Мы не можем сделать так, чтобы на нашей коже и слизистых оболочках жили только хорошие бактерии: выбрать не получится.
Микроорганизмы заселяют человека с рождения: они передаются по родовым путям от матери, после контакта кожа-к-коже в первые месяцы жизни. Условные патогены хорошо уживаются с остальными и формируют уникальную микробиоту – индивидуальный набор бактерий каждого человека. Состояние иммунитета отчасти зависит от баланса видов бактерий, в норме хороших микроорганизмов больше. А условно-патогенные микроорганизмы размножаются медленно, они не дают иммунитету расслабиться.
К ним относятся: грибки кандиды, стафилококки, энтеробактерии, живущие в кишечнике, например, энтерококк фекальный, кожный клещ демодекс.
Где обитает
Условно-патогенные микроорганизмы живут:
Эти микроорганизмы есть у всех: на коже одни, в кишечнике другие, во влагалище третьи.
Лаборатории предлагают сдавать тесты (образцы кала, соскобы со слизистых оболочек или кожи) на микрофлору. Если у человека нет специфических жалоб – то делать этого не нужно. Баланс между хорошими микроорганизмами и патогенными динамичен: сегодня результат один, а завтра может быть другой.
Эти анализы не показывают полное соотношение хороших и плохих микроорганизмов, не дают возможность увидеть весь микробиом, а отображают его в ограниченном варианте (только из места, где взяли соскоб, например). Такие исследования без обоснованного назначения путают человека, они бесполезны для грамотного врача.
«Часто пациенты на приеме говорят, что у них высеялась кишечная палочка в секрете простаты, которую они хотят устранить, – комментирует Риназ Камалетдинов. – Но без клинических проявлений, без воспалительных изменений это состояние не нуждается в лечении».
Можно ли избавиться
Но после убийства условных патогенов:
В результате настоящим патогенам будет проще проникнуть в ослабленный организм и вызвать заболевание.
«Самолечение антибиотиками и другими препаратами для уничтожения условно-патогенных микроорганизмов приводит к антибиотикорезистентности, – предупреждает Мария Волкова. – Это означает, что бактерии становятся невосприимчивыми к препарату. Чем больше таких стойких или резистентных бактерий будет в мире, тем сложнее будет лечить инфекционные болезни».
Нужно ли лечение
Здоровому человеку не стоит вмешиваться в деятельность микроорганизмов. Лечение условно патогенной флоры только «по анализам» не проводят.
«Навсегда избавиться от условно-патогенной микрофлоры не удастся, – дополняет Риназ Камалетдинов. – И не нужно ставить перед собой такую цель. Задача врача – помочь справиться с воспалительным процессом, который появился из-за избытка бактерий или грибков».
Нужно лечить условно-патогенную микрофлору, которая размножилась, вышла из-под контроля и вызвала воспалительный процесс.
«Воспалительные заболевания органов малого таза у женщин, вызванные условно патогенной флорой, могут потребовать оперативного вмешательства, приводить к бесплодию, быть причиной неудачных попыток ЭКО, – объясняет Мария Волкова. – В случае наступления беременности повышается вероятность её прерывания, преждевременного излития околоплодных вод, преждевременных родов, инфицирования новорожденного и осложнений в послеродовом периоде для матери».
Примеры болезней, вызванных условно-патогенной флорой:
«Мужчинам стоит помнить, что простатит, вызванный кишечной палочкой, может повлиять на потенцию, – предупреждает Риназ Камалетдинов. – Если появились боли и трудности с мочеиспусканием – нужно обратиться к врачу, а не начинать самостоятельное лечение антибиотиками».
Когда лечить обязательно
Условно-патогенная флора опасна для людей с иммунодефицитами. Они бывают первичными (врожденные патологии) и вторичными: на фоне тяжелой болезни.
Состояния, которые приводят ко вторичным иммунодефицитам:
Если у человека есть одно из вышеперечисленных состояний, это не значит, что нужно сдавать анализы на флору, делать посевы кала, пить антибиотики для профилактики. Нужно более пристально следить за здоровьем и не игнорировать любые неприятные симптомы. С ними можно обратиться к семейному врачу, терапевту или напрямую к узкому специалисту, который занимается основным лечением.
Публикации в СМИ
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
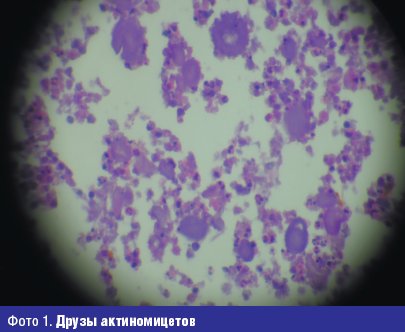
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
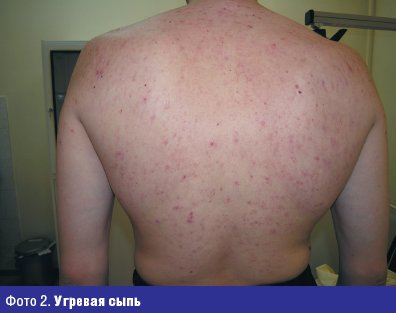
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
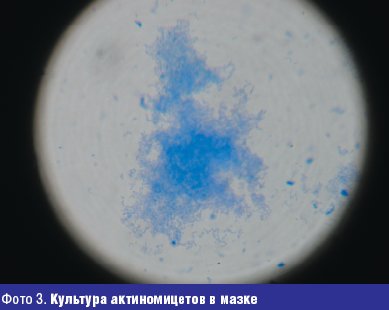
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.
Код вставки на сайт
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.