дезагрегационная тромбоцитопатия код мкб
Публикации в СМИ
Тромбоцитопатия
Тромбоцитопатия xe «Тромбоцитопатия» — состояние, характеризующееся наличием нормального количества тромбоцитов, не способных адекватно участвовать в гемостазе. Заболевание проявляется кожно-слизистой кровоточивостью тромбоцитарного типа, нормальным содержанием тромбоцитов, но увеличенным временем кровотечения и нарушениями функциональных свойств тромбоцитов (в частности, агрегации и адгезии). Тромбоцитопатии могут быть врождёнными и как результат воздействия внешних причин.
Этиология • Индуцированная лекарствами дисфункция тромбоцитов — наиболее частая причина тромбоцитопатий •• Ацетилсалициловая кислота вызывает ацетилирование мембран тромбоцитов, ингибируя синтез Пг, необходимых для нормального функционирования клеток. При большом количестве таких дефектных тромбоцитов удлиняется время кровотечения, образуются геморрагии и усиливаются кровотечения при травмах. Эффект препарата сохраняется до полной замены дефектных клеток новой популяцией (обычно в течение 3–7 сут) •• Другие противовоспалительные препараты (например, индометацин) вызывают аналогичную дисфункцию, но отличаются непродолжительным действием, исчезающим при отмене препарата • Дисфункция при уремии. Механизм патологии неясен; известно, что уремические токсины деполимеризуют высокомолекулярные полимеры фактора VIII.
ЛЕЧЕНИЕ носит симптоматический характер. Кровотечения у больных уремией могут уменьшаться при гемодиализе. Предполагают, что восстановление высокомолекулярных форм фактора VIII способно временно корригировать патологию; с этой целью вводят экзогенный фактор VIII в виде криопреципитата и активируют эндогенный фактор назначением десмопрессина.
МКБ-10 • D69. 1 Качественные дефекты тромбоцитов
OMIM • Глянцманна–Негели болезнь ( 273800, 173470) • 139090 Синдром серых тромбоцитов • 231200 Синдром Бернара–Сулье
Приложение • Тромбоцитоз xe «Тромбоцитоз идиопатический» идиопатический — миелопролиферативное заболевание (*187950, тромбоцитемия эссенциальная, 3q26.3–q27, дефект гена тромбопоэтина THPO, Â ), характеризующееся повышением количества тромбоцитов, гиперплазией мегакариоцитарного ростка и склонностью к тромбозам или кровотечениям. Клиническая картина: тромбоцитемия, миелопролиферативные нарушения, умеренная спленомегалия (в 60% случаев), реже — гепатомегалия, эритромелалгия, акроцианоз, артериальная гипертензия. Лабораторные данные: мегакариоцитарная гиперплазия и дисплазия, тромбоцитоз. Лечение: гидроксикарбамид 10–15 мг/кг/сут, радиоактивный фосфор, анагрелид в дозе 0,5 мг внутрь 4 р/сут или по 1 мг 2 р/сут в течение не менее 1 нед, симптоматическая терапия (препараты железа, дезагреганты). МКБ-10. D75. 2 Эссенциальный тромбоцитоз.
Код вставки на сайт
Тромбоцитопатия
Тромбоцитопатия xe «Тромбоцитопатия» — состояние, характеризующееся наличием нормального количества тромбоцитов, не способных адекватно участвовать в гемостазе. Заболевание проявляется кожно-слизистой кровоточивостью тромбоцитарного типа, нормальным содержанием тромбоцитов, но увеличенным временем кровотечения и нарушениями функциональных свойств тромбоцитов (в частности, агрегации и адгезии). Тромбоцитопатии могут быть врождёнными и как результат воздействия внешних причин.
Этиология • Индуцированная лекарствами дисфункция тромбоцитов — наиболее частая причина тромбоцитопатий •• Ацетилсалициловая кислота вызывает ацетилирование мембран тромбоцитов, ингибируя синтез Пг, необходимых для нормального функционирования клеток. При большом количестве таких дефектных тромбоцитов удлиняется время кровотечения, образуются геморрагии и усиливаются кровотечения при травмах. Эффект препарата сохраняется до полной замены дефектных клеток новой популяцией (обычно в течение 3–7 сут) •• Другие противовоспалительные препараты (например, индометацин) вызывают аналогичную дисфункцию, но отличаются непродолжительным действием, исчезающим при отмене препарата • Дисфункция при уремии. Механизм патологии неясен; известно, что уремические токсины деполимеризуют высокомолекулярные полимеры фактора VIII.
ЛЕЧЕНИЕ носит симптоматический характер. Кровотечения у больных уремией могут уменьшаться при гемодиализе. Предполагают, что восстановление высокомолекулярных форм фактора VIII способно временно корригировать патологию; с этой целью вводят экзогенный фактор VIII в виде криопреципитата и активируют эндогенный фактор назначением десмопрессина.
МКБ-10 • D69. 1 Качественные дефекты тромбоцитов
OMIM • Глянцманна–Негели болезнь ( 273800, 173470) • 139090 Синдром серых тромбоцитов • 231200 Синдром Бернара–Сулье
Приложение • Тромбоцитоз xe «Тромбоцитоз идиопатический» идиопатический — миелопролиферативное заболевание (*187950, тромбоцитемия эссенциальная, 3q26.3–q27, дефект гена тромбопоэтина THPO, Â ), характеризующееся повышением количества тромбоцитов, гиперплазией мегакариоцитарного ростка и склонностью к тромбозам или кровотечениям. Клиническая картина: тромбоцитемия, миелопролиферативные нарушения, умеренная спленомегалия (в 60% случаев), реже — гепатомегалия, эритромелалгия, акроцианоз, артериальная гипертензия. Лабораторные данные: мегакариоцитарная гиперплазия и дисплазия, тромбоцитоз. Лечение: гидроксикарбамид 10–15 мг/кг/сут, радиоактивный фосфор, анагрелид в дозе 0,5 мг внутрь 4 р/сут или по 1 мг 2 р/сут в течение не менее 1 нед, симптоматическая терапия (препараты железа, дезагреганты). МКБ-10. D75. 2 Эссенциальный тромбоцитоз.
Тромбоцитопатии
Общие сведения
Тромбоцитопатии – геморрагические диатезы, развивающиеся в результате нарушения первичного тромбоцитарного звена гемостаза. Популяционная частота тромбоцитопатий достигает 5-10%. Наследственные тромбоцитопатии являются наиболее частой причиной кровотечений неясного генеза у детей; на их долю приходится от 36 до 65%. Тромбоцитопатии представляют собой актуальную проблему для педиатрии и детской гематологии, поскольку их распространенность зачастую недооценивается, и многие дети с геморрагическим синдромом длительно и безуспешно лечатся у специалистов узкого профиля – детских отоларингологов, детских гинекологов, детских стоматологов, детских гастроэнтерологов, детских урологов.
Классификация тромбоцитопатий
Тромбоцитопатии объединяют в себе гетерогенную группу заболеваний, которые могут быть поделены на наследственные (врожденные) и приобретенные (симптоматические).
1. Наследственные тромбоцитопатии:
2. Приобретенные тромбоцитопатии, развивающиеся в течение жизни на фоне других заболеваний.
В детском возрасте наследственные тромбоцитопатии встречаются в 3 раза чаще, чем приобретенные.
Причины тромбоцитопатий
Первичный тромбоцитарно-сосудистый гемостаз включает в себя ряд последовательных реакций: адгезии, агрегации, ретракции кровяного сгустка и активации плазменного гемостаза.
Причиной наследственных тромбоцитопатий выступают дефекты генов, кодирующих те или иные факторы, принимающие участие в обеспечении тромбоцитарно-сосудистого гемостаза. Врожденные тромбоцитопатии могут наследоваться по аутосомно-доминантному или аутосомно-рецессивному типу.
Функциональная неполноценность тромбоцитов при приобретенных тромбоцитопатиях может быть связана с приемом тромбоцитоактивных лекарственных препаратов (НПВС, аспирина, пенициллинов, антикоагулянтов и др.), В12-дефицитной анемией, ДВС-синдромом, лейкозом, циррозом печени, геморрагическим васкулитом, системной красной волчанкой, диффузным гломерулонефритом, почечной недостаточностью, гигантскими ангиомами, тромбозами, массивными гемотрансфузиями, лучевой болезнью и пр.
Симптомы тромбоцитопатий
Диапазон проявлений тромбоцитопатии у детей очень широк. Клиническая манифестация врожденной тромбоцитопатии может быть связана с перинатальной патологией (ацидозом, гипоксией), родовыми травмами, вирусными или бактериальными инфекциями, сепсисом, гиповитаминозом, инсоляцией, проведением физиотерапевтических процедур (УФО, УВЧ), массажа, прививки и др.
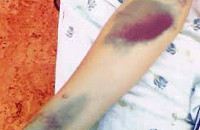
Ведущим в клинике различных форм тромбоцитопатии является рецидивирующий геморрагический синдром, тяжесть которого может варьировать от легкой кровоточивости до обильных кровотечений. У новорожденных тромбоцитопатия может проявляться кефалогематомами, внутричерепными кровоизлияниями, кровоточивостью и медленным заживлением пупочной ранки. Кровотечения микроциркулярного типа характеризуются петехиями, экхимозами, возникающими при незначительных травмах, трении тела одеждой. В отличие от гемофилии, для тромбоцитопатии не характерны гемартрозы и межмышечные гематомы.
При тромбоцтопатиях у детей раннего возраста отмечаются кровотечения при прорезывании зубов, рецидивирующие носовые кровотечения, повышенная кровоточивость десен, длительное заживление мелких повреждений. У девочек-подростков часто имеется «семейная» склонность к меноррагиям, ювенильным дисфункциональным маточным кровотечениям. У пациентов с тромбоцитопатиями даже малые хирургические вмешательства (удаление зуба, тонзиллэктомия и др.) сопровождаются обильными и длительными кровотечениями. Реже в клинике тромбоцитопатий встречаются желудочно-кишечные кровотечения, гематурия, кровоизлияния в склеры.
Вследствие повышенной кровопотери у детей с тромбоцитопатиями развивается анемический синдром, характеризующийся общей слабостью, бледностью кожных покровов, головокружениями, одышкой, тахикардией, артериальной гипотонией, склонностью к обморокам.
При сочетании тромбоцитопатии с дисплазией соединительной ткани у детей выявляются нарушения осанки, плоскостопие, нефроптоз, пролапс митрального клапана и др. аномалии развития.
Диагностика тромбоцитопатий
Как показывает практика, диагноз тромбоцитопатии у детей редко устанавливается своевременно. Участковые педиатры, как правило, не придают должного значения геморрагическим проявлениям и направляют детей к узким специалистам: детскому ЛОРу – при носовых кровотечениях; детскому гинекологу – при обильных менструациях; детскому стоматологу – при кровоточивости десен и т. д. Между тем, дети с тромбоцитопатиями нуждаются в как можно более ранней специализированной консультации гематолога для уточнения диагноза и формы тробоцитопатии.
Диагностика тромбоцитопатии включает несколько этапов, главными из которых являются анализ клинических проявлений и семейного анамнеза, углубленное исследование системы гемостаза. Функциональные эндотелиальные пробы (баночная, манжеточная, щипковая, проба жгута) при тромбоцитопатиях, как правило, положительные: на коже, в месте воздействия остаются многочисленные петехии или кровоподтек.
Лабораторный этап диагностики тромбоцитопатии начинается с клинического анализа крови, определения времени кровотечения, показателей коагулограммы. В процессе диагностического поиска тромбоцитопатии проводится определение количества тромбоцитов и тромбоцитарной формулы, изучение их морфометрических характеристик и функции (адгезивности; агрегационной активности тромбоцитов с АДФ, ристомицином, адреналином, тромбином, коллагеном; определение тромбоцитарных факторов свертывания и др.). Лабораторное обследование ребенка с тромбоцитопатией должно выполняться не менее 3-х раз в разные периоды заболевания (во время клинической ремиссии и в момент геморрагических проявлений).
Для оценки функции кроветворения в некоторых случаях назначается проведение стернальной пункции или трепанобиопсии и исследование миелограммы.
Лечение тромбоцитопатий
При наследственных тромбоцитопатиях проведение этиотропного лечения невозможно. Поэтому весь комплекс терапевтических мероприятий делится на неотложную терапию по купированию геморрагического синдрома и профилактическое лечение. В течение всей жизни пациентам с тромбоцитопатией запрещается употребление уксуса с пищей (в т. ч. в консервах), алкоголя. Рекомендуется обогащение рациона продуктами, богатыми витаминами А, С и Р; арахисом.
Медикаментозная терапия тромбоцитопатии проводится гемостатическими средствами (этамзилат натрия, адроксон, кальция глюконат, аминокапроновая кислота и др.), препаратами метаболического действия (инозин, АТФ, оротат калия, фолиевая кислота). Полезно употребление кровоостанавливающих фитосборов. Плановые профилактические курсы лечения тромбоцитопатии рекомендуется проводить 2-4 раза в год в зависимости от тяжести геморрагического синдрома.
Для локальной остановки кровотечений из поверхностных ран используется орошение кровоточащей поверхности охлажденным раствором аминокапроновой кислоты, нанесение адроксона, аппликации фибринной пленки с тромбином. При носовом кровотечении необходимо ведение в носовые ходы гемостатической губки, проведение анемизации слизистой носа. При маточных кровотечениях применяются препараты, усиливающие сокращение матки (этистерон), внутривенное введение аминокапроновой кислоты; РДВ полости матки при тромбоцитопатии должно проводится под прикрытием гемостатической терапии. При массивной кровопотере может потребоваться переливание эритроцитарной массы, тромбоцитов и плазмы.
При симптоматической тромбоцитопатии необходимо проведение лечения основного заболевания, исключение приема тромбоцитоактивных препаратов и других провоцирующих моментов.
Прогноз и профилактика тромбоцитопатии
Своевременное выявление тромбоцитопатии у ребенка и проведение адекватной профилактической терапии позволяет предупредить выраженную кровопотерю и повысить качество жизни. При массивных внутричерепных геморрагиях, сопровождающих течение некоторых форм тромоцитопатии, прогноз для жизни неблагоприятный.
Мерами профилактики тромбоцитопатий служат медико-генетическое консультирование семей с наследуемым геморрагическим синдромом, отказ от бесконтрольного приема медикаментов. Дети с установленным диагнозом тромбоцитопатии должны находиться на диспансерном учете у педиатра, детского гематолога, детского офтальмолога, ЛОРа, стоматолога; регулярно проходить полное лабораторное обследование, получать превентивное лечение, исключить занятия травмоопасными видами спорта. Вопрос о проведении профилактической вакцинации детей решается в индивидуальном порядке.
Дезагрегационная тромбоцитопатия код мкб
Многими исследователями доказана преобладающая частота нарушений тромбоцитарного компонента гемостаза среди причин (70–80 %) повышенной кровоточивости [1, с. 55; 2, с. 18]. Диагностика тромбоцитопатии для выявления характера нарушений и механизмов тромбоцитарных дисфункций необходима для проведения целенаправленного лечения, подготовки к плановым оперативным вмешательствам, а также для решения некоторых медико-социальных проблем [3, с. 339]. В клинической практике исследование гемостаза осуществляется чаще всего в двух принципиально разных ситуациях в ургентных условиях в стационаре, при возникновении геморрагий и в плановом порядке на неотягощенном фоне. Это обеспечивает выявление и дифференциальную диагностику различных видов тромбоцитопатий, как приобретенных, так и врожденных. Диагностика тромбоцитопатий представляет собой длительный многоступенчатый процесс, занимающий в общей сложности несколько месяцев [4, с. 1112; 5, с. 8]. Высокая доля пациентов с кожно-слизистым кровоточивым диатезом и подозрением на наследственное или приобретенное нарушение тромбоцитов остаются без диагноза даже после всестороннего лабораторного обследования. Поэтому некоторыми исследователями разработан стандартизированный и модульный метод проточной цитометрии, который способствует рациональному поэтапному выяснению нарушений функции тромбоцитов. Из-за одновременного анализа из четырех флуорофоров в базовый дизайн панели, авторы предложили определение наиболее распространенных и клинически значимых нарушений: тромбастению Гланцмана, тромбастению рецепторов фибриногена, синдромы Бернара-Сулье, фон Виллебранда и др. [6, с. 348]. Так, по мнению Nava T. и др. (2018), наследственные нарушения функции тромбоцитов были доступны идентификации в течение более чем 50 лет с помощью тестов на агрегацию и секрецию. Существуют методы решений, предназначенные для стандартизации исследования этих состояний. Большое разнообразие подходов все еще используется в лабораториях по всему миру. Несмотря на длительные лабораторные исследования, результаты были признаны неубедительными или отрицательными у значительной части пациентов с проявлениями кровотечения. Молекулярное исследование недавно выявленных тромбоцитопатий способствовало лучшему пониманию сложности функции тромбоцитов. Тромбоцитопатии, когда-то считавшиеся «классическими», такие как тромбастения Гланцмана и синдром Бернара-Сулье, подверглись переоценке своей патофизиологии, и их диагноз стал более точным и информативным. Было обнаружено, что мегакариопоэз, образование тромбоцитов и их функция тесно взаимосвязаны с генными нарушениями [7, с. 150].
Цель исследования: изучить клинические характеристики тромбоцитопатии у детей с нарушением адгезии и агрегации тромбоцитов.
Материал и методы исследования
На базе Национального центра охраны материнства и детства (НЦОМИД) Минздрава Кыргызской Республики (г. Бишкек) обследовано 60 детей с проявлениями повышенной кровоточивости микроциркуляторного и смешанного типа. Соотношение по полу мальчики/девочки составило 2,3. Обследование включало анализ клинико-анамнестических данных ребенка, сезонность заболевания, наличие сопутствующих заболеваний и оппортунистических инфекций. Изучались также лабораторные исследования системы гемостаза, клинический анализ крови с оценкой морфометрических характеристик тромбоцитов, определение длительности кровотечения по Дьюку, оценку функциональной активности на агрегометре, определение показателей коагулограммы. Определялись уровень антигена и активность фактора Виллебранда, а также группа крови пациентов.
Результаты исследования и их обсуждение
Всего нами было обследовано 60 детей, в том числе 18 девочек (30 %) и 42 мальчика (70 %). У девочек преобладали дети младшего и среднего возраста, тогда как у мальчиков – дети среднего и старшего возраста (табл. 1).
Характеристика детей с тромбоцитопатиями по возрасту и полу
Особенности терапии иммунной тромбоцитопении в условиях COVID-19
Семочкин С.В.1,2,3,*, Митина Т.А.4, Толстых Т.Н.3
1ФГАОУ ВО «Российский национальный исследовательский
медицинский университет им. Н.И. Пирогова»
2МНИОИ им. П.А. Герцена —
филиал ФГБУ «НМИЦ радиологии»
3ГБУЗ «Городская клиническая больница № 52»
Департамента здравоохранения г. Москвы
4ГБУЗ МО МОНИКИ им. М. Ф. Владимирского
Введение
Пандемия COVID-19, вызванная новым коронавирусом SARS-CoV-2, оказала существенное влияние на тактику лечения целого ряда неинфекционных заболеваний, что, с одной стороны, связано с тяжестью течения самой инфекции у больных с соматической патологией, а с другой стороны, — с вынужденным перераспределением медицинских ресурсов [1]. У больных иммунной тромбоцитопенией (ИТП) существует риск возникновения новых случаев заболевания и рецидивов у ранее диагностированных непосредственно при инфицировании SARS-CoV-2. Кроме того, очевидны сложности лечения сочетанной патологии ИТП и COVID-19 из-за одновременного риска и кровотечений, и тромботических осложнений [2]. Отдельного обсуждения требует изменение тактики ведения ИТП у больных, инфицированных COVID-19.
Цель настоящей работы — обсуждение терапии ИТП в период пандемии COVID-19 в соответствии с собственным опытом и рекомендациями, предложенными отечественными и международными профессиональными медицинскими сообществами.
Тромбоцитопения как гематологическое проявление COVID-19
В основе патогенеза COVID-19 лежит инфицирование вирусом клеток эпителия верхних отделов респираторного и пищеварительного трактов посредством взаимодействия с поверхностными рецепторами (ACE2 и CD147) и сериновой протеазой TMPRSS2.
Последующее распространение SARS-CoV-2 в нижние отделы респираторной системы приводит к поражению альвеолоцитов I и II типов, эндотелиоцитов и тканевых макрофагов легких и гематогенной диссеминации вируса. В результате развиваются системная воспалительная реакция и тяжелые формы пневмонии у 10–15 % больных [3]. Основными осложнениями заболевания являются острый респираторный дистресс-синдром (ОРДС), вторичные бактериальные пневмонии, сепсис, синдром диссеминированного внутрисосудистого свертывания (ДВС) и полиорганная дисфункция [4].
Тромбоцитопения является одним из гематологических проявлений COVID-19. В метаанализе [5] 9 исследований, выполненных в начале 2020 г. (8 — Китай, 1 — Сингапур), из общей когорты 1779 госпитализированных больных авторы выбрали 399 (22,4 %) случаев с тяжелым течением инфекции. Медиана количества тромбоцитов в этой группе составила 31 × 10 9 /л (95% доверительный интервал (ДИ): 29–35 × 10 9 /л).
Тромбоцитопения ассоциировалась с 5-кратным относительным риском (ОР) тяжелого течения COVID-19 (ОР = 5,1; 95% ДИ: 1,8–14,6). По данным другого исследования, умеренная тромбоцитопения имела место у 31,6 % больных в случае легкого и у 57,7 % — тяжелого течения COVID-19 [6]. Медиана времени от начала заболевания до минимального количества тромбоцитов составила 28,3 дня, а длительность периода тромбоцитопении — 4,3 дня [7].
Тяжесть тромбоцитопении коррелирует с прогнозом.
В одном из первых сообщений из провинции Ухань в Китае была установлена ассоциация между увеличением смертности от COVID-19 и уменьшением количества тромбоцитов [8]. В этом сообщении из 1 476 госпитализированных больных выздоровели 1238 (83,9 %) человек, среди них тромбоцитопения была у 10,7 %, в то время как среди 238 (16,1 %) умерших больных тромбоцитопения выявлена у 72,7 % (p 9 /л) и 79 × 10 9 /л (95% ДИ: 43–129 × 10 9 /л) (p 9 /л по сравнению с 1 % подобных случаев тромбоцитопении у выживших (р 9 /л нетипично и встречается лишь у 5 % госпитализированных больных и 8 % больных в отделениях реанимации и интенсивной терапии (ОРИТ) [4].
В большинстве ситуаций происходит компенсаторное повышение продукции тромбопоэтина и соответствующая активация мегакариоцитов, что позволяет поддерживать тромбоцитопоэз [13]. В аутопсийном материале больных, умерших от COVID-19, обнаружено многократное увеличение количества функционирующих мегакариоцитов и «голых» ядер, завершивших свой функциональный цикл мегакариоцитов в альвеолах легких и костном мозге (рис. 2А, Б) [14].
Лишь в терминальных стадиях COVID-19 формирование легочного фиброза приводит к разрушению мегакариоцитов и нарушению высвобождения тромбоцитов в системную циркуляцию [15]. Уменьшение количества тромбоцитов 9 /л или резкое уменьшение их количества более чем на 50 % за 1–2 дня может указывать на иммунноопосредованную этиологию тромбоцитопении [16].
ИТП является диагнозом исключения, для которого нет абсолютного подтверждающего теста. Наиболее частые причины тромбоцитопении при COVID-19 и подходы к дифференциальной диагностике ИТП суммированы в таблице 1.

Гепарин-индуцированная тромбоцитопения (ГИТ) 2-го типа — иммуноопосредованная реакция, возникающая в течение первых 5–14 суток от первого применения гепарина или в течение 24 часов после повторного воздействия [17]. Патология характеризуется выработкой специфичных антител и проявляется уменьшением количества тромбоцитов 9 /л и парадоксальными тромбозами. Лечебная тактика заключается в прекращении терапии гепарином и назначении ингибиторов тромбина (дабигатрана этексилат, ксимелагатран) или прямых ингибиторов фактора Хa (фондапаринукс, ривароксабан, апиксабан).
Тромботическую тромбоцитопеническую пурпуру (ТТП) следует заподозрить при наличии признаков микроангиопатической гемолитической анемии, тромбоцитопении, лихорадки и поражения жизненно-важных органов, в первую очередь, почек и ЦНС [18]. Диагностическим признаком ТТП служит уменьшение активности металлопротеиназы ADAMTS13 в крови менее 10 %. У больных COVID-19 без ТТП концентрация ADAMTS13 составляет около 20–40 %, что характерно и для других воспалительных состояний [19]. Общие принципы дифференциальной диагностики ИТП, ТТП и ДВС-синдрома представлены в таблице 2.

Медикаментозная тромбоцитопения развивается в среднем через 5–14 дней после начала приема нового препарата или даже через несколько часов, если в прошлом больной уже получал препарат [20].
Медикаментозная тромбоцитопения, как правило, глубокая ( 9 /л) и сопровождается выраженной кровоточивостью. У большинства больных возникают кровотечения из слизистых оболочек (носовые, маточные, желудочно-кишечные), реже — внутричерепные и легочные кровотечения. Из наиболее часто применяемых в терапии COVID-19 препаратов данное нежелательное явление характерно для гидроксихлорохина, моноклональных антител (сарилумаб, канакинумаб), ванкомицина и β-лактамных антибиотиков (пенициллины, цефалоспорины) [3].
Таким образом, можно выделить следующие отличительные признаки изменения количества тромбоцитов у больных с инфекцией, вызванной SARS-CoV-2:
Лечение ИТП в условиях пандемии COVID-19
Подобно другим вирусным агентам SARS-CoV-2 может индуцировать новые случаи ИТП или рецидив ранее диагностированного заболевания [21]. Для определения показаний к началу и выбору терапии ИТП следует придерживаться клинических рекомендаций [22–24], но с учетом особенностей, продиктованных пандемией COVID-19 [16]. Это касается показаний к госпитализации, методов социального дистанцирования, риска тромботических осложнений и иммуносупрессии, связанных с лечением ИТП. Решение о лечении ИТП следует принимать дифференцированно в зависимости от того, является ли больной инфицированным SARS-CoV-2 или свободным от заражения.
Терапии ИТП у SARS-CoV-2-негативных больных
Стандартной терапией первой линии лечения впервые диагностированной или рецидивов ранее диагностированной ИТП является преднизолон, назначаемый в дозе 1 мг/кг массы тела в течение 2 недель [23, 24]. Если ответ на преднизолон получен (тромбоциты > 50 × 10 9 /л), его дозу постепенно уменьшают, чтобы совсем отменить к 6, максимум к 8 неделям, даже если количество тромбоцитов снова начало уменьшаться.
При отсутствии ответа преднизолон полностью отменяют к 3-й неделе. Не рекомендуется превышать суточную дозу преднизолона у взрослых больных более 80 мг/сут вне зависимости от массы тела [23].
Назначение длительных курсов терапии глюкокортикостероидными гормонами (ГКС) следует избегать, хотя у отдельных больных может сохраняться ответ в результате приема небольших доз (5 мг/сут) ГКС. Альтернативным режимом применения ГКС при ИТП является назначение дексаметазона в дозе 40 мг/сут в течение 4 дней. Проводят от 1 до 3 циклов
подобной терапии. Согласно метаанализу 5 рандомизированных исследований, в которые суммарно было включено 459 больных, дексаметазон не увеличивал количество длительных ремиссий, однако частота полных «тромбоцитарных ответов» и профиль токсичности свидетельствовали в пользу применения дексаметазона в высоких дозах [25]. В настоящее время мало известно о том, повышают ли ГКС риск заражения COVID-19, или ухудшается ли течение инфекции после заражения. Экспертами ВОЗ рекомендуется избегать назначения ГКС при наличии альтернативных вариантов лечения [26].
У больных с отрицательным результатом на инфекцию COVID-19 использование агонистов рецепторов тромбопоэтина (рТПО) в качестве терапии первой линии может быть предпочтительным вариантом [16, 27]. Поскольку назначение агонистов рТПО (ромиплостим, элтромбопаг) в первой линии терапии ИТП не прописано в Российских клинических рекомендациях, следует рассматривать региональное финансирование в рамках временных мер в условиях пандемии COVID-19. Для появления эффекта агонистов рТПО требуется 1–3 недели, и, если необходим быстрый эффект, может понадобиться введение внутривенного иммуноглобулина (ВВИГ) или концентрата тромбоцитов.
ВВИГ назначают при кровотечении, высоком риске геморрагических осложнений и планируемых оперативных вмешательствах, неудачах терапии ГКС или при противопоказаниях к их назначению (сахарный диабет, психические расстройства или острые инфекции) [28].
Применение ритуксимаба приводит к угнетению образования антител и в первой линии не оправдано.
В когортном исследовании, включавшем 694 больных системными воспалительными заболеваниями соединительной ткани, перенесших COVID-19, с помощью многофакторного анализа было показано, что лечение ритуксимабом ассоциировалось с независимым риском (OР = 4,21, 95% ДИ: 1,61–10,98) тяжелого течения инфекции [29]. Не рекомендуется выполнять спленэктомию раньше, чем через 12–24 мес. от момента диагностики ИТП, поскольку возможны ремиссии или стабилизация количества тромбоцитов на безопасном
уровне, не требующем лечения.
Терапии ИТП у SARS-CoV-2-позитивных больных
Тактика терапии ИТП первой линии у больных, инфицированных COVID-19, окончательно не определена и может отличаться от стандартных подходов, выработанных до пандемии [16, 27].
Агонисты рецепторов тромбопоэтина (рТПО) Проблема применения агонистов рТПО заключается в повышенном тромбогенном потенциале данного класса препаратов [30], что может усугубить гиперкоагуляционное состояние при COVID-19.
Гипервоспалительное состояние и «цитокиновый шторм», вызванные вирусной инфекцией SARS-CoV-2, приводят к активации эндотелия и тромбоцитов [31].
Тромбоэмболические осложнения являются характерным осложнением COVID-19. Показано, что венозные и артериальные тромбозы имели место у 31 % больных с пневмонией, обусловленной COVID-19, наблюдавшихся в ОРИТ [32]. С другой стороны, ИТП является заболеванием, при котором существует определенный риск тромботических осложнений. По данным национальных регистров больных ИТП Швеции (n = 2490) и Франции (n = 7205), кумулятивная частота артериальных тромбозов в этой популяции составляет 14,7 и 15,0 случая, венозных — 6,5 и 6,9 случая на 1000 человеко-лет соответственно [33].
Применение агонистов рТПО, вероятно, сопряжено с риском тромбоэмболических осложнений, что, однако, статистически не подтверждено в плацебо-контролируемых исследованиях. Метаанализ 13 клинических исследований применения ромиплостима у 653 больных при 5-летнем периоде наблюдения показал, что частота всех тромботических осложнений составляла 5,9 % в группе ромиплостима и 3,6 % — в группе плацебо (p > 0,05) [34]. В другом метаанализе 8 клинических исследований по применению элтромбопага и ромиплостима, в который суммарно было включено 1180 больных, абсолютный риск тромбозов на терапии агонистами рТПО составил 1,8 (95% ДИ: 0,1–3,3), что также статистически не достоверно [30].
В эксперименте терапия агонистами рТПО не приводила к активации эндотелия и экспрессии молекул адгезии, привлекающих в очаг повреждения тромбоциты и нейтрофилы [35]. По всей видимости, значение имеют дополнительные факторы, повышающие риск тромбозов. Риск тромботических осложнений выше у больных, перенесших спленэктомию [36] и при наличии антифосфолипидных антител [37], а также увеличивается с возрастом [30].
На сегодняшний день нет данных об использовании агонистов рТПО у больных с COVID-19. При применении элтромбопага в 15 % случаев регистрируется гепатотоксичность [38].
Учитывая тромбогенный потенциал и риск печеночной токсичности, назначение агонистов рТПО требует осторожности. Стандартное лечение ГКС представляется более предпочтительным вариантом первой линии терапии. В метаанализе наблюдательных исследований по применению ГКС у больных гриппом был показан повышенный риск
смертности и вторичной инфекции, однако в большинстве включенных исследований сообщалось о больных, получавших высокие дозы ГКС, а качество полученных доказательств оценивалось как очень низкое или низкое [39]. В другой работе влияния на смертность вообще выявлено не было [40]. В исследовании, в которое были включены больные, получавших ГКС для лечения инфекции, вызванной коронавирусом ближневосточного респираторного синдрома (Middle East Respiratory Syndrome — MERS), также не обнаружено влияния на смертность, хотя и было выявлено торможение клиренса MERS-CoV из нижних дыхательных путей [41]. В современных рекомендациях по лечению новой коронавирусной инфекции везде звучит назначение ГКС при тяжелом течении.
Применение низкомолекулярных гепаринов (НМГ) является рекомендуемой опцией, уменьшающей смертность при COVID-19 [30]. НМГ и нефракционированный гепарин (НФГ) обладают противовоспалительными и антитромбоцитарными свойствами, которые могут быть полезными для лечения больных COVID-19. Применение гепаринов должно быть сбалансированным в отношении риска кровотечений больных с тяжелым течением COVID-19, даже если у них нет тромбоцитопении [42]. Если количество тромбоцитов меньше 30 × 109/л, следует использовать прерывистую механическую компрессию ног вместо
назначения гепаринов [43].
Клиническое наблюдение 1
Женщина, 57 лет, в октябре 2020 г. была госпитализирована в стационар ГКБ № 52 с подтвержденным диагнозом новой коронавирусной инфекции, вызванной SARS-CoV-2, среднетяжелого течения. Анамнез инфекции на момент обращения составил 5 дней.
Амбулаторно принимала геделикс, витамин D3, ингавирин и галавит. Больная в течение нескольких лет наблюдалась по поводу умеренной тромбоцитопении, но лечения по этому поводу не требовалось. При поступлении в стационар предъявляла жалобы на повышение температуры тела максимально до 38,5 °С, слабость, диарею, боли в мышцах и грудной клетке при дыхании. Имелся геморрагический синдром в виде петехий и экхимозов на коже грудной клетки, верхних и нижних конечностей. В легких — аускультативно везикулярное дыхание, хрипов нет, частота дыхания — 20 в минуту, по данным пульсоксиметрии, насыщение гемоглобина кислородом — 98 %. Печень, селезенка, лимфатические узлы были не увеличены.
В гемограмме: гемоглобин — 128 г/л, лейкоциты — 4,6 × 10 9 /л, лимфопения — 0,9 × 10 9 /л, тромбоцитопения — 21 × 10 9 /л.
В биохимическом анализе крови: общий белок — 71 г/л, альбумин — 43,4 г/л, мочевина — 6,7 ммоль/л, креатинин — 75,9 мкмоль/л, общий билирубин — 6,9 ммоль/л, мочевая кислота — 273 мкмоль/л, глюкоза — 3,2 ммоль/л, сывороточное железо — 4,7 мкмоль/л, ферритин — 205 мкг/л, общая железосвязывающая способность сыворотки — 63,0 мкмоль/л, трансферрин — 252 мг/дл, коэффициент насыщения трансферрина железом — 8 %, аспартатаминотрансфераза (АСТ) — 19,5 ед./л, аланинаминотрансфераза (АЛТ) — 16 ед./л, щелочная фосфатаза — 72 ед./л, гамма-глютамилтранспептидаза — 44 ед./л, ЛДГ — 155 ед./л, С-реактивный белок (СРБ) — 12,2 (0–5) мг/л.
Коагулограмма: фибриноген — 3,1 (2,0–4,0) г/л, активированное частичное тромбопластиновое время (АЧТВ) — 30 сек, протромбиновое время (ПВ) — 12 сек. Тест на РНК SARS-CoV-2 в мазке со слизистой носоглотки — позитивный. При компьютерной томографии (КТ) органов грудной клетки выявлена картина, характерная для вирусной пневмонии COVID-19 (КТ 1–2) (рис. 3).
Антитела к нуклеокапсиду SARSCoV-2: IgM — 0,48 ( 9 /л.
Генетического материала цитомегаловируса, вирусов Эпштейна — Барр, герпес-вирусов 1-го и 2-го типов в костном мозге с помощью полимеразной цепной реакции (ПЦР) не обнаружено. Вирусные гепатиты В и С, ВИЧ были исключены. Была диагностирована хроническая ИТП, ухудшение течения во время COVID-19.
Проводилась терапия дексаметазоном в дозе 6 мг/сут с 1-го по 7-й дни и антибактериальная терапия (амоксициллин/сульбактам, левофлоксацин).
С целью контроля «цитокинового шторма» использовался левилимаб — моноклональное антитело к рецептору ИЛ-6. Получен полный «тромбоцитарный ответ» (тромбоциты — 170 × 10 9 /л).
При контрольной КТ отмечена выраженная положительная динамика изменений в легких.
Антитела к нуклеокапсиду SARS-CoV-2: IgM — 3,00 ( 9 /л (палочкоядерные — 1 %, сегментоядерные — 83 %, лимфоциты — 9 %, моноциты — 7 %), тромбоцитопения — 3 × 10 9 /л.
Из биохимических параметров отмечалось повышение АЛТ — 50 ед./л и ЛДГ — 543 ед./л. В коагулограмме: фибриноген — 2,7 г/л, АЧТВ — 25,5 сек, ПВ — 12,3 сек, D-димер — 2653 нг/мл.
Тест на РНК SARS-CoV-2 в мазке со слизистой носоглотки — отрицательный.
В миелограмме: бластные клетки — 0,4 %, костный мозг —нормальной клеточности, токсическая зернистость в единичных нейтрофилах, эритропоэз — без особенностей, количество мегакариоцитов — уменьшено до 5 × 106/л, видимой «отшнуровки» тромбоцитов от цитоплазмы мегакариоцитов не было. Активность ADAMTS13 в плазме крови составила 114 %. Исключены вирусные гепатиты В и С, ВИЧ.
Ситуация была расценена как ИТП, ассоциированная с перенесенной COVID-19. Был проведен курс терапии дексаметазоном в дозе 40 мг/сут в течение 4 дней.
Ответ не получен. Безопасное количество тромбоцитов поддерживалось за счет трансфузий концентратов тромбоцитов. В качестве «второй линии» была начата терапия элтромбопагом в дозе 50 мг/сут. Через неделю применение агонистов рТПО получен «тромбоцитарный ответ» (тромбоциты — 286 × 10 9 /л).
В данном клиническом наблюдении дифференциаль-
ный диагноз проводился между ИТП, ассоциированной с инфекцией SARS-CoV-2, и лекарственно-индуцированной тромбоцитопенией, связанной с применением антибиотика пенициллинового ряда. Тромбоцитопения является самым частым гематологическим побочным эффектом комбинации амоксициллина и клавулановой кислоты [45]. Для пенициллинов и цефалоспоринов характерен гаптеновый механизм индукции тромбоцитопении. В конкретном случае возникновение тромбоцитопении укладывается в 14-дневный период после завершения терапии препаратом. Характерным является отсутствие существенного ответа на ГКС [46], уменьшение количества мегакариоцитов в пунктате костного мозга, выраженные тромбоцитопения ( 9 /л) и кровоточивость [47].
Доступных тестсистем для определения таргетных аутоантител в случае лекарственной тромбоцитопении не существует, как и специфических методов терапии. Диагноз лекарственно-индуцированной тромбоцитопении выглядел более убедительным, в связи с чем прием элтромбопага был остановлен на 10-й день. «Тромбоцитарный ответ» сохраняется при сроке наблюдения 2 мес.
Клиническое наблюдение 3
Мужчина, 35 лет, без предшествующих хронических заболеваний, в мае 2020 г. был госпитализирован в одну из больниц г. Москвы после эпизода судорожного синдрома. При поступлении предъявлял жалобы на спонтанное возникновение синяков на коже, слабость, пошатывание при ходьбе и онемение пальцев левой руки. Температура тела — 36,6 °С.
Отмечался геморрагический синдром в виде многочисленных петехий и экхимозов на коже по всему телу, частота дыхательных движений — 20 в минуту. АД — 120/80 мм рт. ст. Печень, селезенка, лимфатические узлы не пальпировались. Обращала на себя внимание дисметрия слева по данным координационных проб и пошатывание в пробе Ромберга.
В гемограмме: гемоглобин — 146 г/л, лейкоциты — 10,6 × 10 9 /л, тромбоциты — 5 × 10 9 /л.
Коагулограмма и биохимический анализ крови были без отклонений от нормы.
По данным КТ диагностировано нетравматическое субдуральное и субарахноидальное кровоизлияние.
Вирусные гепатиты В и С, ВИЧ — исключены.
У больного была диагностирована впервые выявленная ИТП, осложненная внутричерепным кровоизлиянием.
В качестве первой линии проведено два цикла терапии дексаметазоном (40 мг/сут × 4 суток). Количество тромбоцитов кратковременно повышалось максимально до 40–43 × 10 9 /л. Вслед за ГКС было выполнено два введения ромиплостима в дозе 3 мкг/кг (250 мкг) с интервалом в 1 неделю с достижением полного «тромбоцитарного ответа». Неврологические нарушения
и геморрагический синдром были купированы. В течение последующих 1,5 мес. количество тромбоцитов оставалось в переделах нормальных значений (152–288 × 10 9 /л) без какой-либо терапии.
Ухудшение состояния произошло в августе 2020 г., когда возникли жалобы на повышение температуры тела до 37,8 °С, сухой кашель, общую слабость, потерю обоняния и вкуса.
Инфекция COVID-19 подтверждена тестом на РНК SARS-CoV-2 мазка слизистой носоглотки.
Возобновился геморрагический синдром.
В связи с рецидивом тромбоцитопении амбулаторно выполнено еще два введения ромиплостима. Через сутки больной был госпитализирован в гематологическое отделение ГКБ № 52. При поступлении в клинической картине преобладали носовые кровотечения, кожный геморрагический синдром и глубокая тромбоцитопения.
В гемограмме: гемоглобин — 133 г/л, лейкопения — 3,6 × 10 9 /л, лимфопения — 0,8 × 10 9 /л и тромбоцитопения — 5 × 10 9 /л.
В биохимическом анализе крови: общий белок — 71,4 г/л, альбумин — 45,1 г/л, мочевина — 4,6 ммоль/л, креатинин — 93,6 мкмоль/л, общий билирубин — 11,6 ммоль/л, глюкоза — 6,7 ммоль/л, ферритин — 244 мкг/л, АСТ — 23 ед./л, АЛТ — 56 ед./л, щелочная фосфатаза — 70 ед./л, ГГТП — 50 ед./л, ЛДГ — 245 ед./л, натрий — 143 ммоль/л, калий — 3,6 ммоль/л, хлориды — 105 ммоль/л, СРБ — 0,2 мг/л, интерлейкин-6 — 2 пг/мл, прокальцитонин — 0,49 нг/мл.
Коагулограмма: фибриноген — 3,24 г/л, АЧТВ — 28 сек, ПВ — 11,7.
По данным КТ в легких выявлены единичные очаги уплотнения по типу «матового стекла», соответствующие вирусной пневмонии COVID-19 (КТ 1).
Органы брюшной полости и малого таза были без патологических изменений, за исключением незначительной спленомегалии. КТ-признаков внутричерепного кровоизлияния
не было. В миелограмме: бластные клетки — 0,8 %, костный мозг — пониженной клеточности, мегакариоциты — 20 × 10 9 /л.
Иммунофенотипирование мононуклеаров костного мозга — без патологических находок. Цитомегаловирус, вирус Эпштейна — Барр, герпес-вирусы 1-го и 2-го типов в материале костного мозга при ПЦР-исследовании не обнаружены.
Антитромбоцитарные антитела в сыворотке крови 1000 % от контроля, растворимый гликокалицин — 180 %.
Гормоны щитовидной железы — в норме.
Ситуация была расценена как рецидив ИТП, «запущенный» COVID-19. Длительность анамнеза ИТП составила 3–4 мес., что соответствовало персистирующей форме заболевания. По поводу COVID-19 больной получал иммуносупрессивную (тофацитиниб 20 мг/сут × 4 суток), детоксикационную и антикоагулянтную терапию. В связи с рецидивом тромбоцитопении проведено два цикла терапии преднизолоном в высоких дозах (160 и 180 мг/сут) и одно введение ВВИГ в дозе 400 мг/кг (суммарно — 30 г). Клинические проявления COVID-19 полностью исчезли в течение 2 недель, после чего на контрольной КТ не было признаков поражения легких. Антитела к нуклеокапсиду SARSCoV-2: IgM — 1,37 ( 150 × 10 9 /л).
При назначении агонистов рТПО следует учитывать, что «тромбоцитарный ответ» не может быть получен быстро, требуется до 2–3 недель для достижения таргетного количества тромбоцитов. Указанный временной интервал должен быть «прикрыт» средствами неотложной терапии, такими как ГКС и ВВИГ. В данном клиническом наблюдении также нельзя полностью исключить вклад иммуносупрессивного эффекта терапии тофацитинибом.
Описание одного такого случая в литературе имеется [48], однако в представленном нами наблюдении применение тофацитиниба было кратковременным и ориентированным лишь на лечение «цитокинового шторма», вызванного COVID-19.
Ромиплостим способен индуцировать «тромбоцитарный ответ» у 79–88 % больных ИТП, однако для поддержания длительного ответа у большинства пациентов требуется постоянное лечение [49]. Формально ромиплостим зарегистрирован в России и других странах для лечения взрослых больных хронической ИТП после спленэктомии, резистентных к другим видам лечения (ГКС, ВВИГ), или в качестве терапии «второй линии»
у больных с сохраненной селезенкой при противопоказаниях к ее удалению. Постепенно накапливаются данные, подтверждающие, что у отдельных больных, даже с рецидивирующей или рефрактерной формами ИТП, может сохраняться ответ после прекращения терапии агонистами рТПО [50]. Повторное применение агонистов рТПО в случае рецидива тромбоцитопении столь же эффективно, как и первое, что послужило обоснованием концепции «назначения по требованию» в ситуации нетяжелой ИТП [51].
В реальной практике применение агонистов рТПО не ограничивается хронической ИТП.
Эффективность применения ромиплостима при персистирующей ИТП была продемонстрирована в исследовании Amgen 20080435 (фаза 2) [52]. В общей сложности в протокол было включено 75 взрослых больных ИТП, которым не выполнялась спленэктомия, медиана длительности анамнеза заболевания составила 11 мес. (межквартильный интервал — 8–12 мес.). Согласно условиям протокола, спустя 24 нед терапии у больных, у которых сохранялся ответ (тромбоциты 50 × 10 9 /л), проводили постепенную отмену препарата, снижая дозу каждые 2 недели. Оказалось, что в случае персистирующей ИТП возможно достичь стабильного ответа у 31 % больных, не требуя в обозримом периоде наблюдения какого-либо лечения (рис. 6).

Поэтому ранний перевод на агонисты рТПО больных с ИТП и неэффективностью стандартной терапии «первой линии» (ГКС, ВВИГ), тем более уже переболевших COVID-19, выглядит оправданным и рациональным. В случае персистирующей ИТП попытка постепенной отмены ромиплостима возможна после относительно продолжительного периода лечения, поскольку ремиссии у большинства больных наблюдались после 24 недель терапии.
ВВИГ остается опцией для клинических ситуаций, когда требуется незамедлительное повышение количества тромбоцитов для остановки кровотечения или в качестве средства «второй линии» при неэффективности ГКС. Применение адекватных доз ВВИГ 1 г/кг 1–2 дня или 400 мг/кг в течение 5 дней сопряжено с существенными финансовыми затратами, что ограничивает широкое использование данной опции.
Роль ВВИГ в лечении больных тяжелой инфекцией COVID-19 неизвестна. В небольшом ретроспективном исследовании из китайской провинции Ухань было показано, что применение ВВИГ в качестве дополнительного метода лечения пневмонии COVID-19 в течение 48 часов после поступления в ОРИТ может уменьшить потребность в искусственной вентиляции легких и способствовать более раннему выздоровлению больных [53]. Однако можно предположить, что, поскольку в стандартном ВВИГ нет адекватных титров нейтрализующих антител к SARS-CoV-2, его применение вряд ли окажет биологическое воздействие на COVID-19.
Ритуксимаб
Применение ритуксимаба вызывает длительную деплецию В-клеток и может само по себе приводить к серьезным инфекционным осложнениям. Влияние ритуксимаба на риск заражения COVID-19 неясно.
Ритуксимаб может подавить нормальную продукцию антител и таким образом ослабить защиту против SARS-CoV-2 [54]. До тех пор, пока нет дополнительной информации, следует избегать применения ритуксимаба у впервые выявленных больных ИТП и больных с рецидивами ИТП на всем протяжении пандемии COVID-19 в тех ситуациях, когда это возможно.
Иммунодепрессанты
Обобщенные данные по иммунокомпрометированным больным, включая лиц со злокачественными опухолями, ВИЧ и первичными иммунодефицитами, реципиентов аллогенных гемопоэтических стволовых клеток и солидных органов, получающих иммуносупрессивную терапию, показывают, что нет особенностей клинических проявлений COVID-19 по сравнению с больными в общей популяции [55]. В то же время у больных онкологическими заболеваниями и у реципиентов органов выше риск тяжелого течения COVID-19 и летальность. Поэтому во время пандемии COVID-19 правильным представляется избегать применения иммунодепрессантов у больных ИТП.
Трансфузии концентратов тромбоцитов
Трансфузия донорских тромбоцитов не рекомендуется для использования у больных ИТП, у которых нет признаков кровотечения. Лишь в одном ретроспективном исследовании, включавшем 40 больных ИТП, совместное применение трансфузий концентратов тромбоцитов и ВВИГ привело к прекращению кровотечения и быстрому увеличению количества тромбоцитов и сопровождалось минимальными побочными эффектами [56]. У больных ИТП, инфицированных SARS-CoV-2, трансфузии концентратов тромбоцитов могут привести к усугублению протромботического состояния, характерного для COVID-19, а у больных ИТП донорские тромбоциты будут потребляться слишком быстро, чтобы оказать какую-либо пользу. Переливание донорских тромбоцитов следует проводить только в том случае, если считается, что кровотечение опасно для жизни или локализуются в критическом месте.
Лечение хронической ИТП вне рецидива
Лечение больных со стабильным течением хронической ИТП не следует модифицировать под влиянием пандемии. Больные должны продолжать получать свои привычные препараты, даже если это ГКС или иммунодепрессанты. Нет данных о том, что больные, перенесшие спленэктомию, имеют повышенный риск инфицирования SARS-CoV-2. В отношении этих
больных следует продолжить тактику своевременного профилактического назначения антибиотиков и вакцинации против пневмококка, гемофильной инфекции типа B и менингококка. Ревакцинация через 5 лет требуется только против пневмококка. Больные ИТП, не нуждающиеся в лечении в течение последних 12 мес. или постоянно получающие агонисты рТПО, также не относятся к группе повышенного риска заражения COVID-19 и должны соблюдать стандартные меры профилактики инфекции, как все другие люди.
Вакцинация больных ИТП против COVID-19
Данных по вакцинации больных ИТП против COVID-19 нет. Вакцинация может обсуждаться только у больных со стабильным течением ИТП и безопасным количеством тромбоцитов, которые не нуждаются в терапии или получают эффективную терапию, например агонистами рТПО. В настоящее время в России доступны для масштабного вакцинирования
населения два препарата.
Вакцина «Спутник V» (Гам-Ковид-Вак) состоит из двух компонентов. В состав компонента I входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26-го серотипа, несущий ген белка S вируса SARS-CoV-2, в состав компонента II — вектор на основе аденовируса человека 5-го серотипа, несущий ген бе лка S вируса SARS-CoV-2 [57].
Теоретически аденовирусы, в том числе аденовирус человека 5-го серотипа, сами по себе способны индуцировать тромбоцитопению, что было показано как в эксперименте,
так в клинических исследованиях. Механизм тромбоцитопении заключается в деструкции тромбоцитов макрофагами печени и селезенки, активированными аденовирусом [58].
С практической точки зрения риск этого осложнения невелик. Согласно данным исследования 1–2-й фазы, тромбоцитопения возникла у 1 (5 %) человека после введения компонента I вакцины «Гам-Ковид-Вак» и у 1 (5 %) из 20 здоровых добровольцев — после введения компонента II [57].
Возможно, что это был один и тот же испытуемый, но из публикации это не ясно. Важно, что все лабо(1–2-й степени токсичности). В исследовании 3-й фазы вакцины «Гам-Ковид-Вак» в общей сложности было привито 14 964 взрослых добровольца. Ни одного случая тромбоцитопении на столь репрезентативной выборке доложено не было [59].
Вакцина «ЭпиВакКорона» представляет собой химически синтезированные пептидные антигены S-белка вируса SARS-Cov-2, конъюгированные с белком-носителем [60]. Никаких указаний на нежелательные явления, за исключением реакций в месте инъекции и кратковременного повышения температуры тела, нет.
На основании ограниченных данных, полученных на здоровых добровольцах, сложно выработать рекомендации по вакцинированию больных ИТП.
Решение о вакцинации больных ИТП следует принимать индивидуально с учетом всех возможных рисков.
Не вызывает сомнения, что польза вакцинации в период пандемии COVID-19 превышает риски рецидива тромбоцитопении, вероятность которого, по всей видимости, крайне мала.
Таким образом, основываясь на международных рекомендациях [16, 27] и собственном опыте, можно сделать следующие выводы:
При меньшем количестве тромбоцитов следует ограничиться прерывистой механической компрессией ног до тех пор, пока нельзя будет использовать гепарины.
Источник: Журнал «Гематология и трансфузиология» №1, 2021