движение ионов в электрическом поле
Движение ионов в электрическом поле
Дата добавления: 2013-12-23 ; просмотров: 8596 ; Нарушение авторских прав
Электропроводность растворов
Предмет электрохимии
Современная электрохимия развивается в нескольких направлениях. Прежде всего, это изучение процессов, связанных с превращением энергии, выделяемой при самопроизвольных химических процессах, в электрическую энергию. Такие превращения происходят в электрохимических системах, называемых гальваническими элементами. На основе этих исследований созданы разнообразные химические источники тока от миниатюрных батареек, регулирующих сердцебиение людей, страдающих сердечными болезнями до водородных топливных элементов, обеспечивающих электроэнергией космические корабли и мощных батарей для электроавтомобилей.
Третье направление связано с изучением коррозионных процессов и разработкой эффективных методов защиты металлов от коррозии.
Важными задачами электрохимии являются создание и совершенствование методов количественного анализа химических веществ, исследования и контроля химических процессов, разработки приборов для обнаружения и количественного определения вредных примесей в окружающей среде и т.д.
Проводники электрического тока бывают двух типов:
1.Проводники первого рода или проводники с электронной проводимостью. К ним относятся все металлы.
2.Проводники второго рода, обладающие ионной проводимостью, это растворы и расплавы электролитов.
Поскольку рассматриваемые в электрохимии процессы протекают, главным образом, в растворах электролитов, остановимся подробно на ионной проводимости.
На скорость движения ионов в электрическом поле влияют следующие факторы:
б)Заряд иона: скорость движения иона тем больше, чем выше его заряд. Однако следует иметь в виду, что с увеличением заряда увели-чивается степень гидратации, значит уменьшается подвижность.
в)Природа растворителя: чем больше вязкость растворителя, тем большее сопротивление испытывает ион, тем меньше его скорость.
г)Напряженность электрического поля U, т.е. разность потен-циалов между электродами Е, деленная на расстояние между ними l:
Абсолютные скорости ионов в водных растворах (t=25 0 С)
Ток в электролитах (движение ионов)
Природа тока, ток в электролитах Законы Фарадея

В процессе растворения дипольные молекулы воды располагаются вокруг молекулы электролита так, что каждый ион окружается противоположными по знаку заряда концами молекул воды.
Силы притяжения между ионами ослабляются, и молекула распадается на ионы. Этот процесс называется электролитической диссоциацией. Ионы, сталкиваясь между собой в процессе теплового движения, могут рекомбинироваться в молекулу. Этот процесс называется молизацией.
Если в раствор электролита поместить металлические или угольные электроды и присоединить их к полюсам генератора постоянного напряжения, то между электродами образуется электрическое поле. Под действием поля скорости ионов, находящихся в беспорядочном тепло вом движении, получают составляющие в направлении действия сил поля и ионы начинают перемещаться между электродами вдоль линий напряженности поля.
Это движение ионов и образует электрический ток. Движение ионов происходит во всем объеме раствора, находящегося между электродами. Скорость ионов невелика, так как при движении они испытывают столкновения с молекулами растворителя (воды), а также нераспавшимися молекулами самого электролита.
От чего зависит скорость движения ионов
Скорость движения ионов зависит от их природы, температуры раствора, а также от напряженности электрического поля. Скорость движения ионов (в см/сек), отнесенную к единице напряженности поля (1 в/см), назы вают подвижностью ионов. Подвижности измеряют в см 2 /(в•сек). При повышении температуры вязкость раствора уменьшается, в связи с чем подвижность ионов повышается примерно обратно пропорционально изменению коэффициента вязкости
Подвижность некоторых ионов при температуре раствора 18° С приведена в таблице.
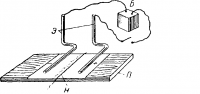
Движение ионов можно показать следующим опытом (рис. 2). На стеклянную пластинку П наложен лист фильтровальной бумаги, пропитанной раствором сернокислого натрия (Na2SO4), с примесью фенолфталеина и посредине его нитка Н, смоченная раствором едкого натрия (NaOH). Ионы гидроксила (ОН—) из едкого натра, взаимодействуя с фенолфталеином, окрашивают нитку и бумагу под ней в яркий малиновый цвет.
Вследствие различной скорости поступательного движения ионов противоположного знака они неравномерно участвуют в образовании тока.
Доля участия данного иона в образовании тока в растворе электролита называется его числом переноса а. Сумма чисел переноса анионов аа и катионов ак равняется единице:
Для растворов слабой концентрации числа переноса анионов и катионов прямо пропорциональны их подвижнос тям:
Совмещая эти две зависимости, можно вычислить число переноса:
Передвигаясь в растворе, ионы достигают электродов и, нейтрализуя заряды, превращаются в атомы соответствующего вещества. На аноде отрицательные ионы отдают лишние электроны, которые поступают во внешнюю цепь и поддерживают ток в ней. На катоде положительные ионы присоединяют электроны, поступающие из внешней цепи (см. рис. 222, б). Эти процессы называют первичными реакциями на электродах.
За единицу времени как на положительном, так и отрицательном электродах нейтрализуют свои заряды равные количества ионов (считая их валентность одинаковой). Поэтому более подвижные ионы не успевают полностью нейтрализовать свои заряды, накапливаются около электрода и образуют пространственный заряд противоположного по отношению к электроду знака.
Таким образом, при прохождении тока через электролит происходит постепенное убывание ионов из раствора. Количество ионов пополняется путем дальнейшей диссоциации молекул растворенного вещества. Пока средняя концентрация ионов в растворе остается неизменной, сила тока подчиняется закону Ома. Если пополнение убыли ионов прекратится, то ток через электролит ослабляется и затем прекращается.
При повышении температуры вследствие увеличения подвижности ионов электропроводность растворов электролитов увеличивается.
Жидкие среды организма (плазмы крови, лимфа, различные тканевые жидкости) содержат слабые растворы электролитов, преимущественно поваренной соли. Общая концентрация этих растворов эквивалентна 0,9% раствору поваренной соли. Удельная электропроводность подобного раствора в зависимости от температуры приведена в таблице.
Первый закон Фарадея
Процессы разложения электролита с выделением соответствующих веществ на электродах, которые происходят под действием электрического тока, называются электролизом. Законы электролиза были установлены Экспериментально Фарадеем и носят его имя I закон Масса m выделившегося на электроде вещества прямо пропорциональна количеству электричества q, протекшего через электролит:
где m подставляется в мг, q — в кулонах, I — сила тока в а, t — время действия тока в сек.
Коэффициент пропорциональности k называется электрохимическим эквивалентом и зависит только от природы вещества. Численно он равен массе вещества (в мг), выделившегося при прохождении через электролит единицы количества электричества в 1 к. В свое время это использовалось-для определения кулона, как количества электричества, необходимого для выделения на катоде 1,118 мг (электрохимический эквивалент) серебра из раствора его азотнокислой соли.
Электрохимические эквиваленты некоторых веществ приведены в таблице (см. стр. 168).
Второй закон Фарадея
II закон. Электрохимические эквиваленты k элементов прямо пропорциональны их химическим эквивалентам (химический эквивалент равен отношению атомного веса А к валентности п элемента в данном соединении):
Совмещая формулы, выражающие I и II законы, имеем m = (1/F)(A/n)q. При m = A/n получаем F = q т. е. число Фарадея равно количеству электричества, проходящего через электролит при выделении на каждом из электродов одного грамм-эквивалента вещества; F = 96 494 (округленно 96 500) к/г-экв.
Число атомов в грамм-эквиваленте простого одновалентного вещества равняется числу Авогадро. Поэтому отношение чисел Фарадея F и Авогадро Na позволяет определить элементарный электрический заряд одновалентного иона, равный заряду электрона:
Вторичные реакции на электродах
Не всегда в результате электролиза на электродах выделяются те вещества, ионы которых образуют ток в электролите. В связи с тем что атомы и ионы одного и того же элемента могут отличаться по химической активности, вещества, первично выделяющиеся на электродах, могут вступать в химическое взаимодействие с веществом электродов или с растворителем. Это взаимодействие называется вторичными реакциями на электродах.
Рассмотрим, например, процессы, происходящие на электродах, погруженных в слабый раствор поваренной соли. При растворении в воде молекулы поваренной соли диссоциируют на ионы натрия и хлора:
В растворе имеется также небольшое количество ионов диссоциированной воды:
которые также участвуют в процессе. Под действием электрического поля между электродами ионы натрия и водорода двигаются к катоду. На катоде ионы водорода (которые легче присоединяют электрон, чем ионы натрия) присоединяют электрон и превращаются в атомы водорода:
Атомы соединяются в молекулы Н2 и выделяются в виде пузырьков газа. Ионы натрия вместе с оставшимися в растворе ионами гидроксила образуют едкую щелочь:
В связи с уходом из раствора ионов водорода диссоциируют новые молекулы воды и процесс продолжается.
Ионы хлора двигаются к аноду, отдают электрон во внешнюю цепь и превращаются в атомы хлора:
Сl — → Сl + е.
Атомы хлора соединяются в молекулы Сl2 и выделяются в виде пузырьков, однако частью реагируют с водой, образуя соляную кислоту с выделением кислорода:
4Cl + 2H2O → 4HCl + O2 (реакция протекает с промежуточным образованием НOСl).
Кислород (вместе с хлором) выделяется в форме пузырьков газа на электроде.
Вторичные реакции могут не только изменить химический состав или состояние поверхности электродов (например, путем выделения пузырьков газа на его поверхности), но и вызвать появление на них разности потенциалов, обратной по знаку приложенному напряжению. К этим явлениям относится также отмеченное ранее образование около электродов пространственных зарядов противоположного знака и т. п. Все эти явления объединяются названием электролитической поляризации, а образующаяся при этом на электродах разность потенциалов называется обратной электродвижущей силой поляризации.
Покажем эти явления на опыте. Пропустим постоянный ток через два угольных электрода, опущенных в банку с раствором поваренной соли. Через некоторое время электроды (отрицательный и большей степени) покрываются мелкими пузырьками газа.
Если теперь электроды отключить от источника тока и присоединить к гальванометру, стрелка последнего отклонится, показывая наличие в цепи тока, в направлении обратном тому, в котором ток проходит под действием приложенного напряжения. Ток быстро снижается, одновременно исчезают пузырьки газа (атомы газа переходят обратно в раствор в форме ионов), покрывавшие пластины, и вскоре ток прекращается. Этот ток обусловлен ‘действием обратной электродвижущей силы поляризации, образовавшейся на электродах.
Наличие в цепи обратной э. д. с. поляризации должно учитываться путем введения ее величины Eпв формулу закона Ома:
В связи с этим сила тока в цепи, содержащей раствор электролита, при постоянном токе меньше по величине, чем при переменном (при таком же приложенном напряжении). Кроме того, что особенно нежелательно при точных измерениях, эта сила тока не остается постоянной, а с течением времени меняется в соответствии с ходом поляризационных процессов.
При физиологических исследованиях для того, чтобы исключить поляризацию, применяют неполяризующиеся электроды. Неполяризующиеся электроды изготовляются из металла, погруженного в раствор, который образует ион этого же металла (например, в раствор соли того же металла). В этом случае при первичных реакциях на электродах происходит или растворение (на аноде), или выделение (на катоде) металла, из которого состоят электроды; вторичных реакций не происходит.
Наиболее часто применяются цинковый и серебряный неполяризующиеся электроды. Цинковый электрод состоит из цинкового стержня Э, помещенного в узкую стеклянную трубку С, наполненную раствором сернокислого цинка. Отверстие трубки закрыто пробкой П из каолина или желатины, пропитанных физиологическим раствором, снабженной кисточкой, при помощи которой электрод соприкасается с объектом О.
В растворе появляется примесь хлористого цинка. На катоде ионы цинка приобретают электроны и выделяются в виде атомов. Остаю щиеся в избытке в растворе ионы радикала серной кислоты уравновешива ются ионами натрия, приходящими из объекта:
В растворе появляется примесь сернокислого натрия. После употребления раствор в обоих электродах заменяется.
Серебряный не поляризующийся электрод состоит из серебряного стержня, помещенного в раствор азотнокислого серебра, или из серебряной пластинки, покрытой электролитическим путем хлористым серебром.
Статья на тему Ток в электролитах
Похожие страницы:
Понравилась статья поделись ей
Факторы влияющие на электропроводность растворов.
3. Удельная электропроводимость. Физический смысл, математическое выражение,единицы измерения.
Уд.эл-ть –это величина обратная сопротивлению 1 см 3 р-ра, заключенного между 2-мя электродами с площадью 1 см 2 каждый,на расстоянии 1 см друг от друга. Обозначают ᴂ (каппа)
Молярная электрическая проводимость. Физический смысл, единицы измерения.
Это электропроводность объёма раствора элетролита,содержащего 1 моль в-ва ( или 1 моль эквивалента в-ва) заключенного между электродами (пластинки платины) одинаковой площади отстоящими друг от друга на 1 см
Взаимосвязь удельной и молярной электрической проводимости (ур-е взаимосвязи)

Перечислите факторы, влияющие на скорость движения ионов в электрическом поле.
Скорость движения иона зависит от размера иона. Чем больше радиус тем меньше гидратная оболочка при равенстве зарядов. ( у Лития плотность заряда больше,поэтому гидратная оболочка больше, следовательно скорость движения будет меньше)
Многозарядные ионы должны двигаться в эл.поле быстрее однозарядных (по з.Кулона), одна из-за большей гидратации различие в скорости движения не велико
Скорость зависит от концентрации ионов р-ре, в р-ах сильных эл-в нужно учитывать что даже при средней концентрации на ионы действуют тормозящие эффекты
Скорость зависит от температуры, например, при увеличении темп. На каждый градус увелич-ся 
Чем больше вязкость р-ля,тем медленнее движутся ионы, Влияет также диэлектрическая проницаемость р-ля.
Сущность электрофоретического эффекта, торможение при движении ионов в электрическом поле.
Каждый ион в соответствии со своим зарядов движется к определенному электроду,а его ионная атмосфера к противоположному в обратном направлении такой эффект носит название электрофоретического.
Сущность релаксационного эффекта торможения при движении ионов в электрическом поле.
Ионная атмосфера при движении разрушается и образуется вновь, в результате происходит накопление зарядов со стороны противоположн. Движению ионов. Т.е. ионная атмосфера не имеет сферической формы, а вытянута это и есть релаксационный эффект.
Объясните зависимость скорости движения ионов в электрическом поле от величин зарядов ионов.
Многозарядные ионы должны двигаться в эл.поле быстрее однозарядных (по з.Кулона), одна из-за большей гидратации различие в скорости движения не велико
Объясните на примере катионов щелочных металлов влияние радиуса иона на скорость его движения в электрическом поле.
Скорость движения иона зависит от размера иона. Чем больше радиус тем меньше гидратная оболочка при равенстве зарядов. ( у Лития плотность заряда больше,поэтому гидратная оболочка больше, следовательно скорость движения будет меньше)
Дата добавления: 2020-04-25 ; просмотров: 675 ; Мы поможем в написании вашей работы!
Скорости движения ионов. Числа переноса
В растворе электролита сольватированные ионы находятся в беспорядочном тепловом движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам.
Скоростью движения иона называется величина этого преимущественного передвижения в направлении одного из электродов, выраженная в м/с.
Для ионов i-го вида скорость движения в электрическом поле определяется силой, действующей на ион, которая равна произведению заряда иона на градиент потенциала поля, и фактором R, характеризующим сопротивление среды, зависящем от температуры, природы иона и растворителя:

где е – элементарный электрический заряд; zi – количество элементарных электрических зарядов, которое несет один ион (зарядность иона); U – разность потенциалов между электродами; l –расстояние между электродами.

Скорости движения ионов в данном растворе не одинаковы, поэтому интерес представляют величины, характеризующие долю электричества, переносимую ионами данного вида. Эти величины называются числами переноса и хар-ся как отношение количества электричества qi, перенесенного данным видом ионов, к общему количеству электричества q перенесенному всеми ионами, находящимися в растворе:
Согласно (3) число переноса катионов

Т.К. раствор электролита электронейтрален, то z+c+= z—c—, и ур-е (4) примет вид
Число переноса анионов
Существует экспериментальный метод Гитторфа по определению чисел переноса. В этом случае электролиз ведется в сосуде с разделением анодного и катодного пространств. Измеряя изменение концентраций в катодном и анодном пространстве ∆К и ∆А до и после электролиза определяют числа переноса:
где qF – количество катионов или анионов, разрядившихся при электродном процессе.
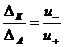
Лекция 2 Электрическая проводимость электролитов. Удельная электрическая проводимость. Молярная электрическая проводимость.
Дата добавления: 2018-02-18 ; просмотров: 2698 ; Мы поможем в написании вашей работы!
Электрический ток в электролитах
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).
Рис. 1. Молекулы воды
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.
Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4 ). Это и является необходимым условием прохождения тока через раствор.
Рис. 4. Раствор в воде
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5 ). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
Формула (3) с постоянной Фарадея запишется так:






