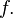экстенсивные параметры состояния термодинамических систем
Термодинамические параметры
Что такое термодинамические параметры
Термодинамические параметры — явления, описывающие макроскопические движения системы. С греческого слово «parametron» переводится как «отмеривающий» или «соразмеряющий». Таким образом, термодинамические параметры это то, что измеряет систему.
Для описания обычно достаточно трех величин. К примеру, чтобы определить состояние газа, необходимо знать его давление, температуру и удельный объём. Параметры состояния термодинамической системы не зависят от того, каким образом она пришла в данное положение.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Если оно равновесное, то это описывается строго определенным набором величин. Зависимость между ними определяется уравнением состояния, которое и позволяет классифицировать системы.
Классификация величин
Явления, которые характеризируют всю систему целиком, называют макроскопическими. В разных источниках классификация величин отличается, но основные группы все же можно выделить.
В некоторых случаях в литературе используются также такие определения, как внешние и внутренние величины. К первым относят экстенсивные свойства, а ко вторым — внутреннюю энергию, температуру или химсостав.
Термодинамическими параметрами называют и величины, которые поддаются и не поддаются измерению приборами. Давление, температура и объем легко измеряется, а внутреннюю энергию уже нужно вычислять по формулам.
Наряду с термическими параметрами свойств в термодинамике также широко используются и калорические. К ним относятся, в частности энтальпия и энтропия.
Основные величины
К основным термодинамическим параметрам относятся: удельный объем, давление и температура. Если меняется хотя бы одна из этих величин, происходит процесс. Совокупность генеральных свойств системы соответственно определяет ее состояние.
Основные термодинамические параметры состояния:
Основным термодинамическим параметром являются также удельная теплоемкость вещества (объем теплоты, поглощаемой в процессе нагревания на 1 кельвин).
Интенсивные и экстенсивные параметры
Термодинамические параметры состояния делятся на две группы: экстенсивные (суммирующиеся) и интенсивные (выравнивающиеся). В первом случае свойство прямо пропорционально массе системы и обладает аддитивностью. Во втором: параметры таким свойством не обладают и не зависят от массы.
Экстенсивные или аддитививные параметры при фиксированных значениях интенсивных параметров пропорциональны числу частиц в системе (или ее массе). Интенсивные параметры принимают одинаковые значения для любой части равновесной системы, даже когда она не является пространственно однородной.
Экстенсивные величины — величины, значения которых для всей системы равны аналогичному показателю для отдельных ее частей.
Интенсивные величины — величины, которые не изменяются при разделении системы на части.
В отличие от них экстенсивные величины зависят от размеров системы и ее массы.
Интенсивные термодинамические параметры:
Разновидности по свойствам веществ, вступающих в реакцию
Любая химическая реакция сопровождается изменениями функций состояния системы, определяющихся переменными состояниями системы (объемом, давлением и температурой, количеством молей химических компонентов). Реакция возможна, если вещества имеют более низкую свободную энергию, чем реагенты.
К характеристикам параметров состояния термодинамической системы относятся разные величины (в том числе температура, состав или плотность и многое другое). Именно они описывают ее в определенный момент времени в зависимости от набора состояний.
Экстенсивные параметры состояния термодинамических систем
Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Общая схема разделения термодинамических параметров состояния на основые виды дана на рис. 2.4.
Предмет химической термодинамики. Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функции состояния. Внутренняя энергия. Теплота и работа.



Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Параметры состояния связаны уравнением состояния.
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др.
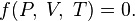 |
Таким образом, задать термическое уравнение состояния значит конкретизировать вид функции
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Функция состояния — это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния.
Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы. Функции состояния: внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G).
Внутренняя энергия — сумма всех видов энергий движения и взаимодействия частиц, составляющих систему.
Теплота — форма передачи энергии путем хаотического движения
микрочастиц.
Работа — форма передачи энергии путём направленного движения
макросистемы как целого.
Физическая химия: конспект лекций
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Оглавление
Приведённый ознакомительный фрагмент книги Физическая химия: конспект лекций предоставлен нашим книжным партнёром — компанией ЛитРес.
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика — наука, изучающая условия устойчивости систем и законы.
Термодинамика — наука о макросистемах.
Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические явления в термодинамике исследуются с помощью основных законов термодинамики. Состояние рассматриваемых объектов в термодинамике определяется непосредственно измеряемыми величинами, характеризующими вещества; механизм процесса и сама структура вещества не рассматриваются.
В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2) фазовые равновесия для индивидуальных веществ и смесей;
3) химическое равновесие.
Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий.
Изучение законов, которые описывают химические и физические равновесия, имеет огромное значение в химической термодинамике. Значение их позволяет решать задачи для производственной и научно-исследовательской работы. Рассмотрим основные задачи:
1) определение условий, при которых данный процесс становится возможным;
2) нахождение пределов устойчивости изучаемых веществ в тех или иных условиях;
3) устранение побочных реакций;
4) выбор оптимального режима процесса (давления, концентрации реагентов и т. д.).
Основные понятия и определения
1. Системы и их классификация
Система — тело или несколько тел, находящихся во взаимодействии между собой (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды.
Состояние системы в термодинамике определяется с помощью набора переменных, называемых параметрами состояния и характеризующих термодинамическое состояние при равновесии. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из параметров состояния, называется термодинамическим процессом.
Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными.
Гомогенная система — система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси. Составленные части гомогенной системы не могут быть выделены из нее с помощью простых механических приемов (фильтрования, отбора и т. д.).
Гетерогенная система — система, составные части которой отделены друг от друга видимыми поверхностями раздела, на которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д.). Составные части таких систем могут быть отделены друг от друга с помощью механических операций.
Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом, называется термодинамической системой.
Системы делят на изолированные (это те системы, которые не обмениваются энергией и веществом с другими системами), открытые (те системы, которые обмениваются с окружающей средой и веществом, и энергией), закрытые (системы, в которых есть только обмен энергией).
2. Термодинамические параметры. Термодинамические показатели. Баланс напряжений
Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми.
Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы — равновесные.
В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы — процессы, в которых система возвращается в первоначальное состояние.
Необратимые — когда система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, — функции состояния; внутренняя энергия, энтальпия, энтропия и другие — полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A.
Функции можно разделить на две группы: экстенсивные и интенсивные.
Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F.
Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, A, T, P.
Давление — параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура определяет меру интенсивности теплового движения молекул.
Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению).
Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры — абсолютный нуль, равный 273,15 о С.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, — уравнение состояния.
Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например, температура и объем, а значение третьего параметра — давления — можно определить из уравнения состояния
Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру. Таким образом, термодинамическая поверхность — геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров.
Пусть дан изолированный сосуд, который разделен полупроницаемой перегородкой (рис. 1). В первой части сосуда температура Т1, во второй — температура Т2; Т1 > Т2.
Молекулы, ударяясь о полупроницаемую перегородку, будут отдавать часть энергии, а другие — принимать ее, без механического перемещения.
Форма передачи энергии от одной части системы к другой называется теплотой Q.
Мера переданной энергии от одной системы к другой — количество теплоты. Q не является функцией состояния и не является полным дифференциалом ΔQ.
Работа процесса — это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому.
Обмен энергией между системой и внешней средой обуславливается работой, совершаемой этой системой:
Работа (А) определяется суммой произведений сил, действующих на систему сил (давления и изменения объема).
Работа не является полным дифференциалом, ΔА.
Если протекают равновесные процессы, то работа равновесного процесса будет максимальной величиной, по сравнению с неравновесным процессом
Если телу сообщают определенное количество теплоты, то это значит, что тело надо нагреть, а охладить систему — произвести действие, обратное нагреванию, т. е. отвести энергию.
Работа и теплота являются количественными характеристиками двух форм обмена энергией между системой и окружающей средой.
Понятие внутренней энергии
Внутренняя энергия системы Uвнскладывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Uвнявляется полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвнопределить нельзя, можно определить только ее изменения.
Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, A, Uвнустанавливает первый закон термодинамики.
К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условий, что система находится в равновесии. Напряжение разложения:
где ΔG — изменение термодинамического потенциала;
п — число электронов, участвующих в химической реакции;
где А — максимальная работа, которую способна совершить система в равновесном состоянии.
где Q — тепловой эффект реакций;
Up — термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза.
Отклонение системы — поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий:
1) подвод реагирующего вещества к границе раздела фаз;
2) разряд и ионизация;
3) отвод продуктов реакции.
Поляризация, определяемая медленной стадией массопереноса — концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природа реагирующего вещества, материал электрода, состояние поверхности электрода, плотность тока, состав раствора и режим электролиза. Кинетический параметр — параметр, определяемый в реальных условиях электрохимической системы: ρ тока, ЕАКТИВ, коэффициент диффузии, коэффициент переноса α (на катод), β (на анод) — доля расхода на процесс:
1) сила тока в электрохимическом аппарате J= iKSед загрузки, A, Z, iK — в зависимости от электролита;
2) скорость электролиза — образование массы вещества за единицу времени
где q — электрохимический эквивалент, v электролиза — J тока,
если в 1 см 2 — v — i тока.
Баланс напряжений. Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих:
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Функция состояния термодинамической системы: энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
В ходе самопроизвольного процесса в закрытых системахG уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0).
В изолированных системахэнтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0
Энтальпийный и энтропийный фактор действуют независимо друг от друга и могут направлять процесс в противоположные стороны.
эннтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG 0).
Диффузия
диффузией является перемешивание молекул вещества при их беспорядочном тепловом движении.
процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму
примеры: 1)растворение молока в кофе;
2)заваривание чая;
3)распространение запахов;
Осмос. Эндо- экзоосмос
Осмос — результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полу24проницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества.
Односторонняя диффузия растворителя через полупроницаемую мембрану, отделяющую раствор от чистого растворителя.
наблюдаются, когда жидкости приходят во взаимодействие через перепонки.
ЭНДООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из внешней среды внутрь клетки
ЭКЗООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из клетки в окружающую внешнюю среду
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом.
22. Осмотичекое давление (закон Вант-Гоффа)
Осмотическое давление равно тому давлению, которое имело бы растворенное вещество, будучи в газообразном состоянии в объеме раствора
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.