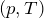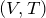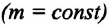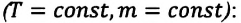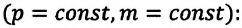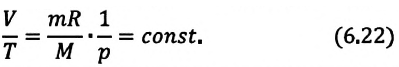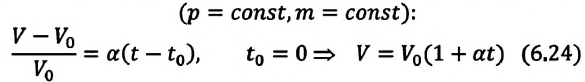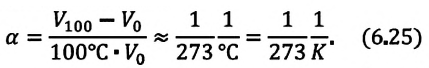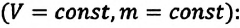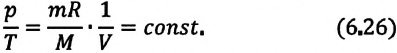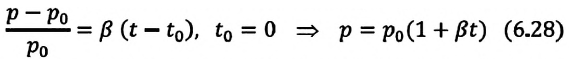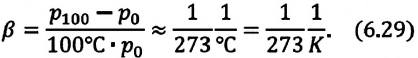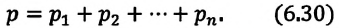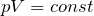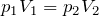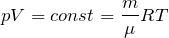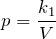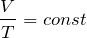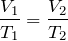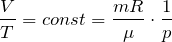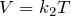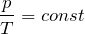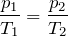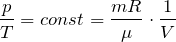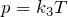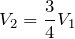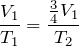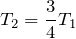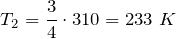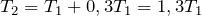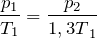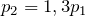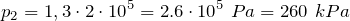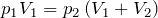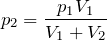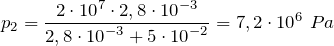какие еще газовые законы вам известны
Газовые законы
Существуют законы, определяющие поведение газов при изменении их состояния. Нагреем газ в закрытом сосуде. Ясно, что атомы или молекулы начнут двигаться быстрее, а значит, с большей силой случать в стенки. Вывод: при постоянном объеме газа его давление пропорционально температуре (закон Шарля).
Если газ нагревать и дать возможность расширяться (как в воздушном шарике), то будет расти уже его объем. Следовательно, при постоянном давлении объем газа пропорционален его температуре (закон Гей-Люссака).
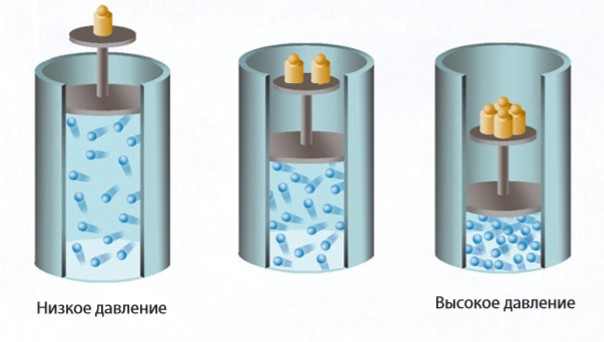
Наконец, если сжать газ (уменьшить объем), сохраняя его температуру, молекулы в меньшем объеме будут быстрее преодолевать расстояние между стенками и чаще ударяться о них. Больше ударов — больше давление. Отсюда следует, что давление газа при постоянной температуре обратно пропорционально его объему (закон Бойля—Мариотта).
История открытия
Хотя Роберта Бойля и называли «отцом химии», именно он открыл самый известный газовый закон физики. Бойль описал, как давление газа связано с объемом. Этот и еще пара других газовых законов стали первым ключом к тому, как устроена материя на непостижимом пока атомном уровне.
Паскаль изучал силы в жидкостях, Гук занимался упругими свойствами твердых тел, а Роберт Бойль вслед за Отто фон Герике занялся газами, или, как говорили тогда, «воздухом». (Не забывайте, что даже в самые древние времена считалось, что элементов природы четыре — воздух, земля, огонь и вода.)
Бойль воспитывался под влиянием Фрэнсиса Бэкона, английского философа, опубликовавшего одно из первых описаний научного метода исследований. (Другие ученые, не говоря уже об аль-Хайсаме и Галилео, уже использовали похожий метод исследований.) Бойль начал с традиционного скептицизма, который составляет в наши дни в науке саму основу, а именно отбросил принимаемые на веру положения алхимии, в основе которой лежали не факты, а религиозные предрассудки.
Воздушная пружина
Будучи родом из богатой ирландской семьи, Бойль и в науке зарекомендовал себя как джентльмен. Он построил лабораторию в своем доме в Лондоне и привлек Роберта Гука для изготовления «пневматической машины» — по сути, вакуумного насоса, подобно насосу Герике.
Бойль также привлек к работе лучшего лондонского мастера стекольных дел, который изготавливал ему необычные стеклянные емкости — без них не состоялась бы даже первая серия опытов Бойля. Кстати, их результаты были опубликованы в 1660 году в статье под названием «Новые физико-механические эксперименты: пружинящий воздух и другие эффекты». Эксперименты показали, что в вакууме звук распространяться не может, а пламя в отсутствие воздуха не горит. Также Бойль доказал, что без воздуха не могут жить не только животные, но и растения.
Бойль много занимался физической природой «воздуха». Например, он показал, что в вакууме перо падает столь же быстро, как и камень. Это наводило на мысль, что воздух содержит материю, хоть и невидимую глазом.
В 1662 году Бойль опубликовал то, что мы теперь знаем как «закон Бойля». Он обнаружил, что давление в сосуде с газом растет при уменьшении объема сосуда, и установил закон роста давления. Выражаясь современными словами, давление газа (P) обратно пропорционально объему (V): P 1/V. Бойль воспользовался этим эмпирическим законом, чтобы доказать свою идею о том, что воздух состоит из «корпускул» — крошечных частиц, хаотично двигающихся во всех направлениях, сталкивающихся друг с другом и со стенками сосуда и создающих таким образом давление.
Другие газовые законы
Прошло более ста лет, и к закону Бойля добавилось еще два газовых закона, учитывающих температуру. Закон Чарльза (1780) гласит, что объем газа пропорционален температуре, а по закону Гей-Люссака (1802) температуре пропорционально давление газа. Вместе эти три закона образуют основу современной атомной теории. Как и предполагал Бойль, поведение воздуха (впоследствии ученые писали «газы») согласовывается с древнегреческим представлением о хаосе, который лучше всего описывает поведение огромного количества взаимно независимых частиц. Сейчас, оглядываясь назад, можно даже подумать об очевидности существования атомов, однако в свое время для подтверждения атомной теории потребовалось не одно столетие.
Содержание:
Газовые законы:
С помощью уравнения состояния идеального газа можно исследовать процессы, при которых сохраняются постоянными масса газа и один из его макроскопических параметров.
Газовыми законами называются законы, определяющие количественную зависимость между двумя макроскопическими параметрами газа данной массы
Закон Бойля-Мариотта
Этот закон был определен в 1662 году английским физиком Робертом Бойлем (1627-1691) и в 1676 году французским физиком Эдом Мариоттом (1620-1684).
Для данной массы газа при неизменной температуре произведение давления газа на его объем постоянно
Для данной массы газа при неизменной температуре произведение давления начального состояния 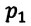
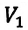
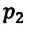
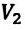
Изотермическим называется процесс изменения состояния данной массы идеального газа при постоянной температуре 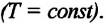
Закон Гей-Люссака
Этот закон был экспериментально установлен в 1802 году французским физиком Джозефом Луи Гей-Люссаком (1778-1850).
Для данной массы газа при неизменном давлении отношение объема газа к его абсолютной температуре постоянно
При неизменном давлении отношение первоначального объема газа 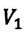
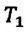
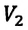
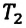
Закон Гей-Люссака можно выразить и так:
Для данной массы идеального газа при неизменном давлении относительное
Где 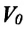
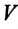
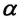
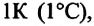
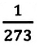
Изобарным называют процесс изменения состояния данной массы идеального газа при постоянном давлении 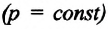
Закон Шарля
Этот закон экспериментально определил в 1787 году французский физик Шарль Жак Александр Сезар (1746-1823):
Для данной массы газа при постоянном объеме отношение давления газа к его абсолютной температуре остается неизменным
Отношение первоначального давления 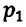
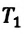
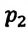
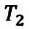
Закон Шарля можно выразить и так:
Для данной массы идеального газа при неизменном объеме относительное изменение давления прямо пропорционально изменению температуры
Где 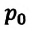
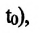
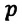
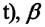
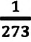
Изохорным называется процесс изменения состояния данной массы идеального газа при постоянном объеме 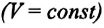
Закон Дальтона
Этот закон в 1801 году установил английский исследователь Джон Дальтон (1766-1844):
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов:
Парциальное давление — это давление отдельно взятого газа из газовой смеси.
Закон Авогадро
Этот закон, как предположение, был выдвинут в 1811 году итальянским физиком Амедео Авогадро (1776-1856). В последующем это предположение было подтверждено многочислеными опытами.
В равных объемах различных газов, взятых при одинаковых температурах и давлении, содержится одинаковое число молекул. Например, число молекул в 1 моле произвольного газа равно: 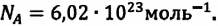
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Какие еще газовые законы вам известны
Состояние какого газа описывает уравнение Менделеева—Клапейрона.
Можно ли универсальную газовую постоянную считать фундаментальной постоянной?
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трёх параметров — давление, объём или температура — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
Слово «изопроцесс» — сложное слово, первая часть которого происходит от греческого слова isos — равный, одинаковый.
Отметим, что в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объёма. Лишь в лабораторных условиях удаётся поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс — это идеализированная модель реального процесса, которая только приближённо отражает действительность.
Изотермический процесс.
Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим.
Слово «изотермический» происходит от греческих слов isos — равный, одинаковый и therme — теплота.
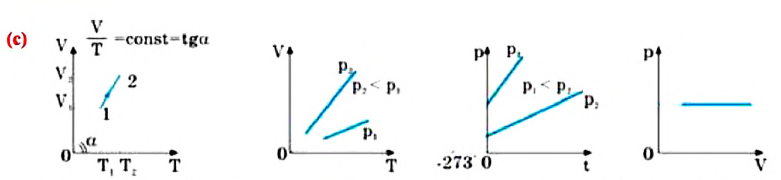
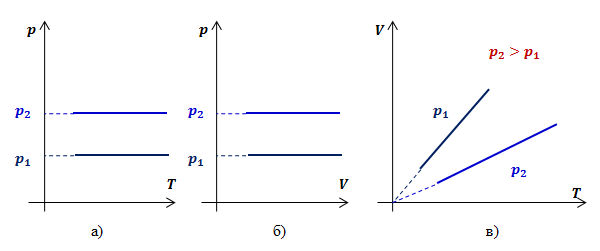
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплом с большой системой — термостатом. Иначе при сжатии или расширении температура газа будет меняться. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса. Согласно уравнению состояния идеального газа (10.4), если масса газа не изменяется, в любом состоянии с неизменной температурой произведение давления газа на его объём остаётся постоянным:
pV = const при Т = const. (10.6)
Этот вывод был сделан английским учёным Р. Бойлем (1627—1691) и несколько позже французским учёным Э. Мариоттом (1620—1684) на основе эксперимента. Поэтому он носит название закона Бойля—Mapuoттa.
Для газа данной массы произведение давления газа на его объём постоянно.
Закон Бойля—Мариотта справедлив обычно для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
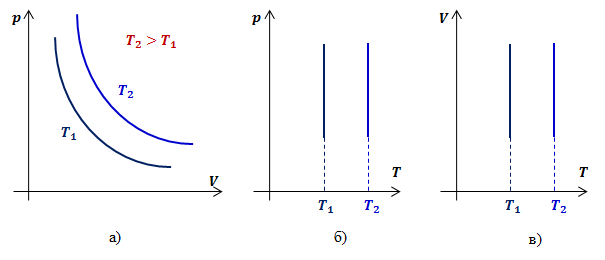
Кривую, изображающую зависимость давления газа от объёма при постоянной температуре, называют изотермой.
Изотерма газа изображает обратно пропорциональную зависимость между давлением и объёмом. Кривую такого рода в математике называют гиперболой (рис. 10.1).
Различным постоянным температурам соответствуют различные изотермы. При повышении температуры газа давление согласно уравнению состояния (10.4) увеличивается, если V = const. Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1 (см. рис. 10.1).
Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. Дело в том, что, например, при сжатии газ нагревается, так как при движении поршня в сосуде скорость и соответственно кинетическая энергия молекул после ударов о поршень увеличиваются, а следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха.
Кроме этого, отметим, что при быстром сжатии давление под поршнем сразу становится больше, чем во всём сосуде. Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии и мы не можем назвать значения температуры и давления, определяющие в данный момент состояние системы. Если систему предоставить самой себе, то температура и давление постепенно выравниваются, система приходит в равновесное состояние.
Равновесное состояние — это состояние, при котором температура и давление во всех точках объёма одинаковы.
Параметры состояния газа могут быть определены, если он находится в равновесном состоянии.
Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
Очевидно, что на графиках зависимости одного параметра от другого мы можем изображать только равновесные процессы.
Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Слово «изобарный» происходит от греческих слов isos — равный, одинаковый и baros — вес, тяжесть.
Согласно уравнению (10.4) в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным:
Этот закон был установлен экспериментально в 1802 г. французским учёным Ж. Гей-Люссаком (1778—1850) и носит название закона Гей-Люссака.
Для газа данной массы при постоянном давлении отношение объёма к абсолютной температуре постоянно.
Согласно уравнению (10.7) объём газа при постоянном давлении пропорционален температуре:
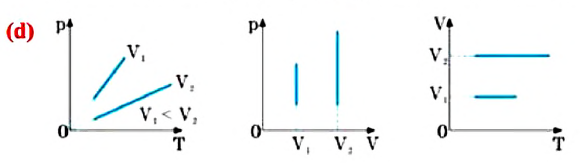
Прямую, изображающую зависимость объёма газа от температуры при постоянном давлении, называют изобарой.
Разным давлениям соответствуют разные изобары (рис. 10.2). Проведём на рисунке произвольную изотерму. С ростом давления объём газа при постоянной температуре согласно закону Бойля— Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению p1.
В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объём реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (10.4) неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объёма от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Давление в цилиндре постоянно и равно сумме атмосферного давления и давления mпg/S поршня.
Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объёме называют изохорным.
Слово «изохорный» происходит от греческих слов isos — равный, одинаковый и chora — место, пространство, занимаемое чем-нибудь.
Из уравнения состояния (10.4) вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся постоянным:
Этот газовый закон был установлен в 1787 г. французским физиком Ж. Шарлем (1746—1823) и носит название закона Шарля.
Для газа данной массы отношение давления к абсолютной температуре постоянно, если объём не меняется.
Согласно уравнению (10.9) давление газа при постоянном объёме пропорционально температуре:
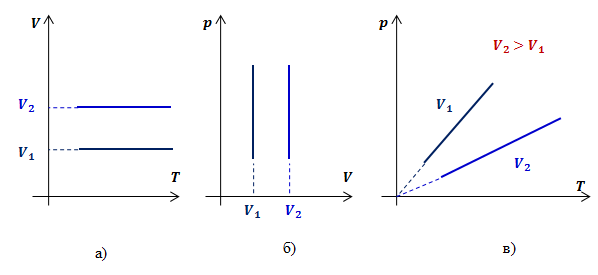
Прямую, изображающую зависимость давления газа от температуры при постоянном объёме, называют изохорой.
Разным объёмам соответствуют разные изохоры. Также проведём на рисунке произвольную изотерму (рис. 10.3). С ростом объёма газа при постоянной температуре давление его, согласно закону Бойля— Мариотта, падает. Поэтому изохора, соответствующая большему объёму V2, лежит ниже изохоры, соответствующей меньшему объёму V1.
В соответствии с уравнением (10.10) все изохоры идеального газа начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объёма.
В заключение составим опорную схему (рис. 10.4) и покажем логические переходы, связывающие различные законы и уравнения.
Газовые законы
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Обозначив константу буквой 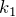
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах 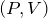
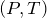
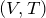
Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также следует из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изобарами.
Определим вид графика в координатах 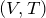
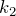
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах 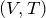
Рис.2. Графики изобарных процессов в различных координатах
Закон Шарля (изохорный процесс)
Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изохорами.
Для определения вида графика изохорного процесса в координатах 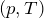
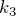
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).
Рис.3. Графики изохорных процессов в различных координатах
Примеры решения задач
| Задание | До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой 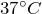 , чтобы объем газа уменьшился при этом на одну четверть? , чтобы объем газа уменьшился при этом на одну четверть? |
| Решение | Изобарный процесс 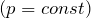 описывается законом Гей-Люссака: описывается законом Гей-Люссака: |
По условию задачи объем газа вследствие изобарного охлаждения уменьшается на одну четверть, следовательно:
откуда конечная температура газа:
Переведем единицы в систему СИ: начальная температура газа 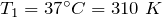
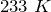 .
.| Задание | В закрытом сосуде находится газ под давлением 200 кПа. Каким станет давление газа, если температуру повысить на 30%? |
| Решение | Так как сосуд с газом закрытый, объем газа не меняется. Изохорный процесс описывается законом Шарля: |
По условию задачи температура газа повысилась на 30%, поэтому можно записать:
Подставив последнее соотношение в закон Шарля, получим:
Переведем единицы в систему СИ: начальное давление газа 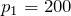
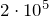
| Задание | В кислородной системе, которой оборудован самолет, имеется 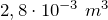 кислорода при давлении кислорода при давлении 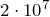 Па. При максимальной высоте подъема летчик соединяет с помощью крана эту систему с пустым баллоном объемом Па. При максимальной высоте подъема летчик соединяет с помощью крана эту систему с пустым баллоном объемом 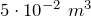 . Какое давление установится в ней? Процесс расширения газа происходит при постоянной температуре. . Какое давление установится в ней? Процесс расширения газа происходит при постоянной температуре. |
| Решение | Изотермический процесс 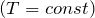 описывается законом Бойля-Мариотта: описывается законом Бойля-Мариотта: |
откуда давление, установившееся в системе:
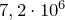 Па.
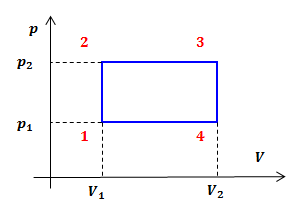
Па.| Задание | На рисунке дан график изменения состояния идеального газа в координатах 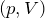 . Представить этот цикл в координатах . Представить этот цикл в координатах 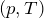 и и 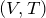 , обозначив соответствующие точки. , обозначив соответствующие точки. |
 и
и  — изохоры, переходы
— изохоры, переходы  и
и  изобары.
изобары.В координатах