какие изопроцессы вы знаете
Изопроцессы в газах.
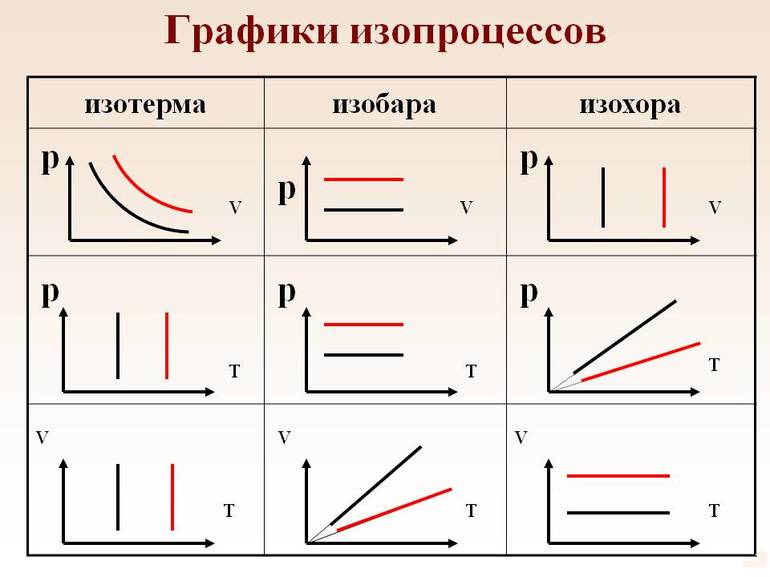
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
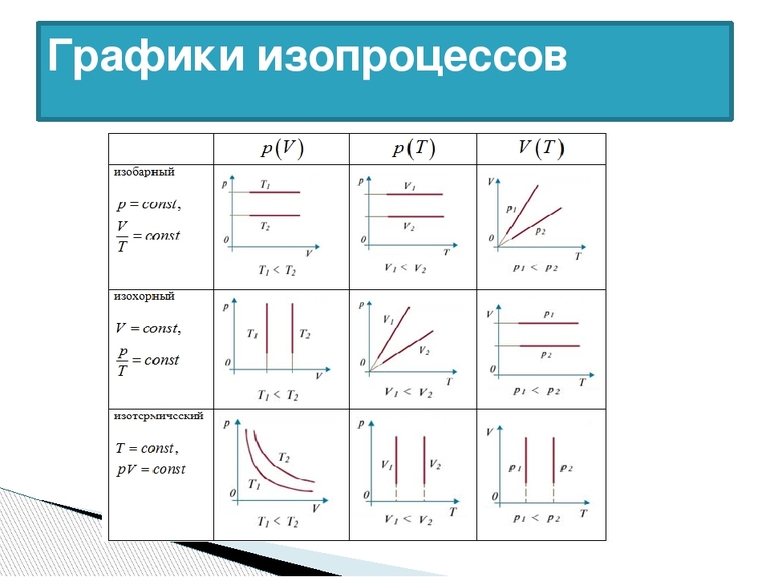
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
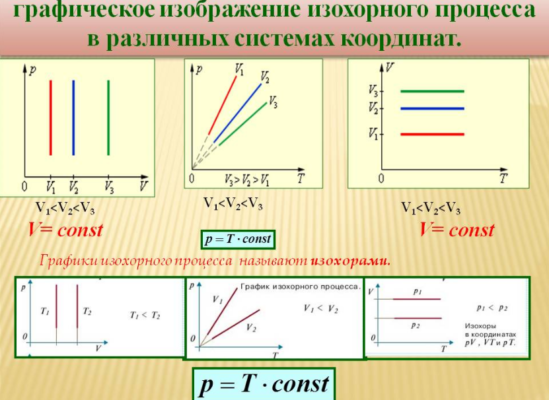
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Трактовка понятий
Газ является одним из существующих агрегатных состояний вещества, для которого характерна слабая связь между компонентами и большая подвижность частиц. Последние передвигатся хаотично и свободно. При их столкновения изменяется характер движения.
Реальный газ считается высоко перегретым паром. Его свойства несколько отличаются от идеального компонента. В термодинамики различаются два состояния:
Газы, как и жидкости, обладают текучестью. Они хорошо сопротивляются деформации. В отличие от воды, газ не имеет фиксированного объёма. Он стремится заполнить весь сосуд. Изопроцессы в газах подчиняются законам, которые определяют зависимость между двумя параметрами вещества при постоянном значении третьего. Так как уравнение справедливо для любой смеси, поэтому формула изотермического процесса (ИЗ) выражается следующим образом: T=const.
Само понятие ИЗ трактуется как новое состояние вещества, которое протекает при неизменной температуре. Процесс соответствует закону Бойля — Мариотта: для газа определённой массы произведение объёма на давление постоянно, если не изменяется температура. Равенство отображается на графике изопроцессов с помощью гиперболы и координат. Отдельно отмечаются изотермы при разных значениях температуры. В последнем случае соблюдается неравенство: Т1 23 молекул. Это считается числом Авогадро.
По закону Дальтона, давление смеси равно сумме парциальных P, входящих в состав. Выражение записывается следующим образом: P cm=P1+P2+…Pn. Последний показатель Pn является давлением газа, который бы занимал весь объёмом сосуда.
Чаще в старших классах физике рассматриваются изохорические процессы, когда переходит идеальный газ из одного состояния в другое, при этом не изменяется его объёмом. Явление впервые рассмотрел француз Жак Шарль. Закон записывается следующим образом: PV=vRT. Так как v= const и V=const, поэтому для любых разных состояний веществ используется равенство: P1/T1=P2/T2=….Pn/Tn. Закон Шарля математически записывается так: P/T=const.
Из выражения следует, что между температурой и давлением наблюдается прямо пропорциональная связь. Если увеличивается P, тогда повышается T, и наоборот. График зависимости данных величин называется изохорой. На промежутке абсолютного нуля для кривых предусмотрена условная зависимость. Прямая доводится до начала координат с помощью пунктирных линий.
Подобная зависимость T от P и V при изобарных и изохорных процессах определяет точность и эффективность измерения температуры газовыми термометрами. Первыми ученые открыли эти явления, которые считаются частными случаями уравнения состояния. Позже физики утвердили закон Клапейрона и Менделеева.
Если следовать хронологии, сначала изучались процессы, которые протекали при постоянной температуре, а затем при одном объеме. Последними рассматривались изобарические процессы. Редким и интересным явлением считается изоэнтропия, когда изменяется термодинамическая система при условии постоянной энтропии. Последнее записывается как S=const.
Примером подобного считается адиабатический обратимый процесс. Чтобы вычислить идеальный газ, используется уравнение: pV γ = const, где γ — показатель адиабаты (определяется типом газа). Для адиабатического явления характерно отсутствие теплоприёма и теплоотдачи. Физики считают такие процессы быстро протекающими.
Изопроцессы
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
График изотермического процесса называется изотермой.
Рис. 2. Чем выше температура, тем выше изотерма
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3 ):
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
где — атмосферное давление.
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Рис. 5. Чем ниже изобара, тем больше давление
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6 ):
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Рис. 8. Чем ниже изохора, тем больше объём
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9 ):
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
«Изопроцессы»
Разделы: Физика
Цели, ориентированные на развитие личности учащегося:
Единый план изучения газовых законов:
Основные понятия урока: изопроцессы, изотермический, изобарный, изохорный, изотерма, изобара, изохора.
I. Организационный момент
Сообщение целей и задач урока.
II. Актуализация знаний
Проверка домашнего задания
III. Объяснение нового материала
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Первый газовый закон был открыт английским ученым Р. Бойлем. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал давление газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Рисунок 1
Теперь давайте сформулируем изотермический закон:
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
А сам процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим процессом.
Рисунок 2
Зависимость давления газа от объема при постоянной температуре графически изображается кривой, которая называется изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой. Разным постоянным температурам соответствуют различные изотермы. При повышении температуры давление согласно уравнению состояния 
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда.
Провожу закрепление нового материала: Мини-тест, решение задач
Следующий закон называется законом Гей-Люссака и происходит при постоянном объеме.
Рисунок 3
Теперь давайте, ребята, вместе сформулируем закон Гей-Люссака:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не изменяется.
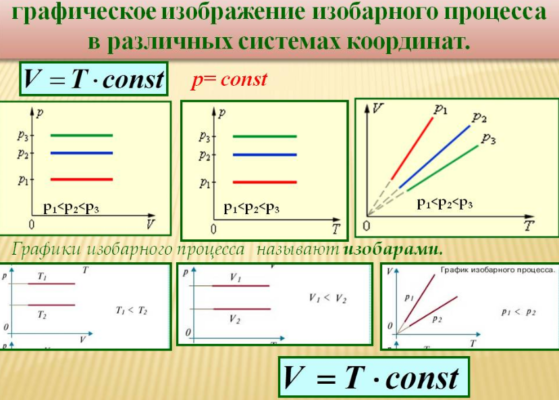
Сам же процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным.
Объем данной массы газа при р = const зависит от температуры по линейному закону
Рисунок 4
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению (Рисунок 4)
В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объем реального газа действительно обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния 
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
При V = const давление данной массы газа при постоянном объеме зависит от температуры по линейному закону:
В результате эксперимента получаем таблицу и график зависимости (Р, T) откуда видно, что 
Рисунок 5
Теперь давайте, ребята, вместе сформулируем закон Шарля:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Сам же процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным.
Рисунок 6
Эта зависимость давления от температуры изображается прямой, называемой изохорой. Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление согласно закону Бойля – Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1. В соответствии с законом Шарля все изохоры начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равна нулю.
Увеличение давление газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема.
IV. Структурированный комплексный тест по всем газовым законам
Тест составлен в EXSEL (приложение 2). Программа сразу же автоматически выставляет полученную оценку и указывает на ошибки. Причем она позволяет при соответствующем навыке работы с ней исправлять эти ошибки. Это вырабатывает у учащихся уверенность в своих в себе, веру в свои знания, повышает познавательный интерес.
V. Домашнее задание
На рисунке (смотри слайд №26) дан график изменения состояния идеального газа в координатных осях V, T. Представьте этот процесс в координатных осях P, T и P, V.
Изопроцессы

Всего получено оценок: 96.
Всего получено оценок: 96.
В исследовании поведения газов рассматривается три макроскопических параметра – температура, давление и объем. В общем случае в газовом процессе могут меняться все три параметра. Однако большое значение имеют частные случаи, когда один из параметров постоянен (или почти постоянен). Рассмотрим эти случаи.
Газовые изопроцессы
Для любого газового процесса, в котором количество газа постоянно, макроскопические параметры связаны соотношением, называемым уравнением Клапейрона (оно является следствием уравнения Менделеева-Клапейрона):
Из этой формулы следует, что при одном фиксированном параметре два других по-прежнему могут изменяться.
Газовый процесс, в котором один из трех макроскопических параметров фиксирован, называется изопроцессом.
И, поскольку в формулу входят три параметра, следовательно, возможны три уравнения состояния изопроцессов:
Изотермический процесс
Данный изопроцесс происходит при неизменной температуре. Для этого необходимо, чтобы газ мог свободно обмениваться теплом с окружающей средой, температура которой неизменна. Как правило, такой процесс возможен, если объем газа изменяется очень медленно.
Заменяя в уравнении Клапейрона значение температуры константой, мы получим следующую зависимость:
То есть, при постоянной температуре давление газа и объем связаны обратной зависимостью. Данное соотношение было доказано Р.Бойлем, и, несколько позже, Э.Мариоттом, поэтому оно носит название закона Бойля-Мариотта.
Изобарный процесс
Данный изопроцесс происходит при неизменном давлении газа. Такое возможно, если газ способен свободно менять свой объем, выравнивая давление с атмосферным. Полагая в уравнении Клапейрона давление постоянным, получаем:
То есть, при постоянном давлении объем и температура газа связаны прямой зависимостью. Этот закон был открыт Ж.Гей-Люссаком, и носит его имя.
Изохорный процесс
Данный процесс происходит при неизменном объеме газа. Такой изопроцесс возможен, если газ находится в замкнутом объеме, и его давление меняется только в результате подвода тепла. Полагая в уравнении Клапейрона объем постоянным, получаем:
То есть, при постоянном объеме давление и температура газа связаны прямой зависимостью. Этот закон был открыт Ж.Шарлем, и носит его имя.
Сводная таблица
Для удобства уравнения состояния изопроцессов можно свести в таблицу: