какие заболевания диагностируются пренатально с помощью молекулярно генетических методов
Молекулярно-генетическая служба ФГБУ «НМИЦ Радиологии» Минздрава России
Молекулярно-генетическая служба ФГБУ «НМИЦ Радиологии» Минздрава России имеет подразделения во всех 3-х филиалах Центра (МНИОИ имени П.А. Герцена, МРНЦ имени А.Ф. Цыба, НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина) и проводит уникальные молекулярно-генетические исследования (в том числе методов NGS) и медико-генетическое консультирование онкологических пациентов и их родственников.
Узнать о риске онкозаболевания
Вовремя начать профилактику рака
Выбрать оптимальную схему лечения
ОМС, ДМС, платные медицинские услуги
Руководитель молекулярно-генетической службы, д.м.н. Людмила Николаевна Любченко
Записаться к врачу
Оставьте заявку и ожидайте консультацию нашего специалиста
Что нужно знать о молекулярно-генетической диагностике?
Молекулярно-генетическая диагностика онкологических заболеваний
Совершенствование диагностических методик и развитие онкогенетики требуют внедрения более персонифицированного подхода к выявлению генетической предрасположенности к наследственным онкологическим заболеваниям (индивидуализированная оценка риска). По этой причине сегодня пациентам предлагается широкий спектр генетических тестов: от выявления наиболее частых мутаций до полного секвенирования генома. Подбор соответствующей методики проводится онкологом, совместно с врачом генетиком.
Принимая во внимание доказанный и хорошо охарактеризованный вклад различных мутаций определенных генов в риск развития рака, проведение генетического тестирования, позволяет предсказывать наследственные формы рака, а также разрабатывать программу его профилактики и контроля.
Вторым направлением в молекулярно-генетической диагностике рака является проведение молекулярно-генетического тестирования, которое помогает выбрать наиболее эффективное лечение на основе индивидуальных характеристик опухолевых тканей, таких как соматические мутации или другие уникальные биологические параметры злокачественных опухолей.
Кому и чем полезны генетические исследования?
По результатам молекулярно-генетической диагностики врач-онколог:
● подбирает эффективную лекарственную терапию пациентам с установленным онкологическим диагнозом;
● определяет наличие онкологической предрасположенности и корректирует лечение пациентам моложе 50 лет с диагнозом рак молочной железы, рак яичников, рак желудка и рак поджелудочной железы;
● определяет наличие онкологической предрасположенности и заблаговременно проводит профилактические мероприятия по раннему выявлению опухоли здоровым людям с неблагоприятной наследственностью в генах, вовлеченных в канцерогенез.
Лаборатория молекулярной генетики и методы диагностики
Лаборатория молекулярной генетики является профильным высокоспециализированным подразделением ФГБУ “НМИЦ Радиологии” Минздрава РФ, выполняющим молекулярно-генетическую диагностику при наследственных и спорадических формах злокачественных новообразований с целью индивидуализации диагностики, лечения и профилактики онкологических заболеваний у пациентов и членов их семей, а также с целью проведения научно-исследовательской работы. На базе Лаборатории молекулярной генетики выполняются молекулярно-генетические исследования, в том числе молекулярное профилирование, индивидуального и опухолевого геномов с целью определения герминальных, соматических мутаций и других геномных перестроек у пациентов и членов их семей.
Проектирование и комплектация Лаборатории регламентированы Методическими указаниями (МУ 1.3.2569–09) «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
Оснащение Лаборатории молекулярной генетики
Оборудование для проведения молекулярной диагностики
● Роботизированная станция для автоматической экстракции нуклеиновых кислот из различных биологических материалов методом сорбции на магнитных частицах.
● Детектирующие амплификаторы в режиме реального времени.
● Система генетического анализа (капиллярный секвенатор) для секвенирования по Сэнгеру.
● Фрагментный анализатор на основе капиллярного гель- электрофореза.
● Высокопроизводительные NGS секвенаторы.
● Гель-детектирующая станция.
● Низкотемпературные холодильные камеры хранения биологического материала.
● ПЦР-боксы, дозаторы, центрифуги и др.
Рабочие зоны лаборатории молекулярной генетики
Лаборатория оснащена современным диагностическим оборудованием для проведения широкого спектра молекулярно-генетической диагностики: выделения нуклеиновых кислот из любого биологического материала (опухолевая и/или нормальная ткань, плазма, лимфоциты, клеточные культуры и др.), полимеразная цепная реакция (ПЦР), ПЦР в реальном времени (высокоспецифичный и чувствительный метод, использующийся в качестве инструмента для выявления соматических мутаций при различных видах рака), фрагментный анализ (позволяет обнаружить изменения в ДНК для идентификации наличия или отсутствия определенной геномной последовательности), секвенирование методом Сэнгера и методы секвенирования нового поколения (позволяют идентифицировать мутации при анализе длинных участков ДНК или всего генома).
Список рабочих зон лаборатории:
* прием, регистрация, разбор и первичная обработка материала;
* выделение ДНК/РНК;
* приготовление реакционных смесей и проведения ПЦР;
* детекции продуктов амплификации методом электрофореза и др;
*секвенирование.
Применение методов молекулярной диагностики
Молекулярно-диагностические исследования
ФГБУ «НМИЦ радиологии» Минздрава России располагает необходимой материально-технической базой и квалифицированным персоналом для применения комбинированных методов исследований из тканей ДНК пациента:
● позволяют обнаружить и исследовать соматические мутации в генах, имеющих ключевое значение в развитии онкологических заболеваний (EGFR, KRAS, NRAS, BRAF, PIK3Ca, PDGFRA, ERBB2, c-KIT и др.);
● идентифицировать герминальные мутации в генах, вовлеченных в наследственную предрасположенность к раку (BRCA1/2, CHEK2, MSH6, CDH1, VHL, RET и др);
Молекулярно-диагностические исследования
Какие анализы сдаются для молекулярно-генетического тестирования?
Что необходимо сдать для исследования
Для проведения молекулярно-генетических исследований в качестве образцов биологического материала используются:
● периферическая кровь, буккальный эпителий и нормальная ткань (постоперационный материал) для диагностики герминальных мутаций, определения чувствительности и токсичности лекарственных препаратов, HLA-типирования, определения вирусной нагрузки, определения MSI-статуса и др;
● все патоморфологические материалы: опухолевая ткань в парафиновых блоках и стеклах. При низком качестве срезов или для выявления важных деталей могут понадобиться дополнительные срезы. Культуры опухолевых клеток, асцитическая, плевральная и др. жидкости для диагностики соматических мутаций и молекулярных маркеров с целью подбора таргетной терапии.
Перечень анализов по ОМС
Моногенные заболевания
Генетические патологии часто диагностируются уже после рождения ребенка.
Эти заболевания отмечаются как при естественном зачатии, так и после использования репродуктивных технологий. Различные генетические нарушения встречаются у 5-6 детей из 100. Генные болезни, спровоцированные мутацией только одного гена, классифицируют как моногенные заболевания.
Что такое моногенные болезни?
Вследствие действия различных факторов с определенной частотой встречаются поломки или изменения только в одном гене.
В зависимости от типа наследования выделяют следующие виды патологий:
В случаях доминантного наследования даже одной пары модифицированного гена достаточно для проявления клинической картины болезни. Такие пациенты, как правило, осведомлены о наличии у себя определенного вида мутации. В таком случае при планировании ребенка удается предупредить передачу генного заболевания, исключив измененные мутацией гены.
При рецессивных изменениях генов полностью отсутствуют клинические проявления болезни. Поэтому в большинстве случаев пациенты не знают о наличии генетической аномалии и передают ее потомству. В тех случаях, когда оба родителя имеют одинаковые пары модифицированных генов, риск развития болезни стремительно возрастает.
Причины возникновения моногенных заболеваний
Моногенные заболевания обладают менделевским типом наследования. Без использования репродуктивных технологий поломанный ген передается по наследству. А риск развития клиники напрямую связан с механизмом такого наследования и наличия сопутствующих факторов.
Точковые мутации – обязательное условия для развития этой группы болезней.
В зависимости от этиологических причин развития моногенных заболеваний их подразделяют на две группы:
Вторая группа более многочисленна и насчитывает около 90% всех моногенных заболеваний.
Статистика
Распространенность каждого моногенного заболевания различна. Так самые частотные патологии диагностируются у одного ребенка из 500, а более редкие болезни могут встречаться с вероятностью 1:10000.
Если оба родителя имеют одинаковый мутированные ген, то у такого плода риск развития генных болезней существенно увеличивается. Кроме того, если носителем поврежденного гена является только один из родителей, но в семье уже есть дети с моногенной болезнью, риск диагностики патологии у младших детей увеличивается в несколько раз.
Точная диагностика генных мутаций в период планирования беременности позволяет генетику определить индивидуальные риски наследования моногенных болезней. Тем парам, у которых по результатам диагностики риск развития болезней выше среднего рекомендуется воспользоваться репродуктивными технологиями, чтобы не допустить наследования мутированной пары.
Диагностика
Данное обследование не проводится рутинно и рекомендуется парам, у которых были выявлены случаи врожденных патологий. Исследование на риски развития моногенных болезней минимизирует риск контаминации ДНК матери и плода.
Для этого эмбриолог проводит ряд обязательных тестов для определения оптимальных яйцеклеток для процедуры ЭКО. Использование этого метода диагностики позволяет имплантировать только эмбрионы с правильным генным набором.
Это исследование крови, которое проводится после 10 недели гестации позволяет с высокой точностью определить генные мутации и вероятность рождения ребенка с тяжелыми заболеваниями, спровоцированные генными мутациями. Для проведения этого исследования ДНК плода выделяется из периферической крови беременной.
Метод абсолютно безопасный и высокоинформативный. Это позволяет вовремя оценить возможные риски и принять обоснованное решение о сохранении или прерывании беременности.
Лаборатория Медикал Геномикс рекомендует расширенный неинвазивный пренатальный тест VERAGENE
Муковисцидоз
Это генное заболевание спровоцировано модифицированным геном транмембранного регулятора муковисцидоза. Болезнь поражает железы внутренней секреции. Болезнь поражает органы дыхания, пищеварения, встречаются смешанные и изолированные формы. Продолжительность жизни зависит от степени патологических изменений и в среднем составляет около 30 лет. Использование специальных протоколов лечения позволяет минимизировать проявление болезни и улучшить качество жизни пациента.
Бета-талассемия
Синдром Барде-Бидля
Это генетическое заболевания отражается на всех органах и системах. Самому негативному влиянию подвержена сетчатка глаз. Что приводит к развитию полной слепоты. Для таких больных свойственно нарушения анатомии тела, для них характерно укорочение ног, патологии развития половых органов. Кроме этого, болезнь способствует психическим и эмоциональным нарушениям, развитию патологий почек.
Артрогриппоз
Умственная отсталость и судороги (AMRS)
Заболевание характеризуется как экзогенная умственная отсталость. Для больных свойственна судорожная активность. Степень изменения психики зависит от клинического проявления заболевания. Отмечаются формы с сохранением интеллекта и полным нарушением умственной деятельности. Болезнь плохо поддается коррекции и ее течение непрогнозируемо.
Синдром Альстрема
Это цилиапатия, которая проявляется изменением пигментации сетчатки, ожирением, нейросенсорной глухотой. Такие пациенты подвержены проявлению сахарного диабета, кардиомиопатий и тяжелым нарушениям функции почек.
Синдром Андерманна
Это редко диагностируемый симптокомплекс наследственных патологий, который проявляется агенезией мозолистого тела и периферической нейропатией. Болезнь проявляется в первые часы после рождения, после чего стремительно прогрессирует. Выживаемость в среднем не составляет более 5х лет.
Аутосомно-рецессивная поликистозная болезнь почек
Эта болезнь проявляется кистозными изменениями в структуре почек. Болезнь в большинстве случаев имеет двустороннее проявление. Стремительное прогрессирование патологии приводит к увеличению почек.
Это состояния проявляется нарастанием почечной недостаточности. Для коррекции изменений больным проводятся процедуры гемодиализа, медикаментозная поддержка, пересадка трупного органа.
Своевременная диагностика моногенных заболеваний и использование репродуктивных технологий позволяет выносить и родить здорового ребенка! Будьте здоровы!
Перечень моногенных заболеваний, включенных в тест Veragene:
Научная электронная библиотека
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
6.1. Молекулярно-генетические методы
Поиск изменений последовательностей нуклеиновых кислот и белков на молекулярном уровне является одним из основных направлений молекулярной генетики. Выявление мутационных изменений ДНК при наследственных заболеваниях и полном отсутствии знания о патогенезе заболевания происходит с помощью молекулярно-генетических методов следующим образом: на первом этапе осуществляется сканирование генома для поиска каких-либо отклонений или соответствующих маркеров. Это проделывается на базе анализа сегрегации болезни в семьях больных, а также поиска аллелей, потенциально связанных с заболеванием, среди больших групп неродственных больных. Далее, выделяются некоторые гены-кандидаты, в которых с высокой долей вероятности могут наблюдаться мутации, связанные с исследуемым заболеванием. Однако, при наличии предположений или некоторых доказательств относительно механизмов, лежащих в основе патогенеза заболевания, первый этап молекулярно-генетических исследований, как правило, опускается.
Разрешающая способность цитогенетических и молекулярно-цитогенетических методов
Разрешающая
способность (пары нуклеотидов)
Культивирование клеток и последующее дифференциальное окрашивание метафазных хромосом
Флюоресцентная гибридизация in situ с использованием ДНК зондов на определенные гены, высокоповторяющиеся последовательности и проб, маркирующих полностью хромосому
от 500–5000
до 3 млн
Классическая метафазная CGH
CGH с использованием смеси меченых геномной ДНК пациента и ДНК донора
Серийная CGH (arrayCGH)
CGH на чипах с использованием смеси меченых геномной ДНК пациента и ДНК контроля
Олигонуклеотидная серийная CGH
CGH с использованием смеси меченых геномной ДНК пациента и небольших последовательностей ДНК (олигонуклеотидов)
Наиболее известными молекулярно-генетическими методами для поиска генов, потенциально связанных с конкретной болезнью, являются анализы сцепления и аллельной ассоциации. Оба метода преследуют цель картирования генов, аномалии которых приводят к болезни, и основаны на анализе полиморфных генетических маркеров для молекулярного сканирования генома. Эти два метода позволяют проводить молекулярно-генетические исследования в условиях отсутствия знаний о процессах, лежащих в основе патогенеза болезни. Исследование с помощью анализа сцепления требует большого числа индивидуумов из семей с соответствующими больными, в противном случае полученные данные не будут статистически достоверными. При анализе сцепления исследуются полиморфные маркеры с известной локализацией на хромосоме (расположенные в определенных локусах), которые могут наследоваться вместе с болезнью. Если наблюдается совместное наследование (сцепление) болезни и определенных полиморфных маркеров, можно говорить о картировании генов болезни. Картирование представляет собой процесс ассоциации болезни с определенным хромосомным локусом в геноме человека. При аллельных ассоциациях изучается совместное наследование аллелей и заболевания в репрезентативных выборках неродственных больных. Если частота определенных комбинаций аллелей у больных превышает значение в контрольной группе, можно с определенной долей вероятности утверждать то, что в хромосомном (геномном) участке этого аллеля расположен ген, связанный с исследуемой болезнью. Анализ аллельных ассоциаций может указать на генетические факторы патогенеза или предрасположенности к заболеванию.
Существует множество методических подходов к определению генов болезни на базе данных анализа сцепления или аллельных ассоциаций. Среди них наиболее распространенным методом для определения генов, связанных с заболеванием, является выбор наиболее вероятных генов-кандидатов, локализованных в картированном участке, с последующим определением последовательности ДНК этих генов. Такой подход оказался эффективным при идентификации генов болезни Альцгеймера, но, например, при шизофрении, аффективных расстройствах и аутизме этот метод по большей части не дает воспроизводимых результатов. Следует отметить, что классические молекулярно-генетические методы были преимущественно разработаны для системы «один ген – одна болезнь». Это позволяет некоторым исследователям оспаривать результаты многих анализов сцепления и аллельных ассоциаций мультифакторных психических болезней (шизофрения, аутизм и др.). В связи с этим, наиболее подходящим для подобных исследований следует рассматривать анализ всего генома, при котором используются от нескольких сотен до нескольких тысяч полиморфных генетических маркеров.
Существует достаточно большое количество молекулярно-генетических методов, которые имеют широкий спектр применения. Однако многие из них являются либо модификацией, либо комбинацией нескольких основных методов. Среди последних следует выделить полимеразную цепную реакцию (ПЦР) и секвенирование (определение последовательности полимерных макромолекул).
Многие учёные используют в своей работе ПЦР как современный молекулярно-генетический метод. Этот метод позволяет определять небольшие фрагменты последовательностей ДНК. Он также относительно несложен в исполнении и не требует значительных затрат как при адаптации к имеющимся лабораторным условиям, так и в ходе его дальнейшего использования. Классический вариант ПЦР представляет собой искусственную экспоненциальную репликацию или амплификацию небольших фрагментов ДНК в среднем от 200 до 1000 пн. Для использования ПЦР необходимо знать определенную часть исследуемой последовательности ДНК, поскольку для инициации реакции применяются синтетические олигонуклеотиды (как правило, размером около 20 пн) или праймеры. ПЦР для амплификации одного фрагмента ДНК требует использования не менее 2-х праймеров: один – идентичный прямой 5′ последовательности, второй – идентичный обратной 5′ последовательности. Геномная ДНК смешивается с праймерами и ферментом температуро-устойчивой ДНК полимеразы и единичными нуклеотидами (А, Г, Ц и Т), которые являются основой для синтеза новых коротких последовательностей. Смесь нагревается для того, чтобы образовались однонитевые последовательности ДНК (процесс денатурации). Затем, при снижении температуры праймеры связываются с образованными последовательностями, и начинается полимеризация ДНК от 3′ конца на базе единичных нуклеотидов, находящихся в смеси. Данный искусственный процесс не слишком отличается от репликации молекул ДНК в клетке за исключением того, что он происходит с короткими последовательностями. Процесс повторяется много раз, результатом чего является экспоненциальное увеличение концентрации исследуемого фрагмента ДНК по отношению к остальным последовательностям геномной ДНК. Классическая ПЦР может быть использована для получения фрагментов ДНК, которые далее можно исследовать с помощью секвенирования, а также оценить их размеры с помощью метода электрофореза. Последний основан на разделении (в зависимости от размера последовательностей) макромолекул, помещенных в гель, который находится в электрическом поле. Помимо этого, имеются также возможности для количественного определения содержания последовательностей нуклеиновых кислот в реальном времени (ПЦР в реальном времени) или по сравнению с другими последовательностями. Некоторые методы используют предварительную обработку ДНК с последующей амплификацией для выявления изменения последовательности в исследуемом фрагменте. ПЦР может быть также использована для исследования молекул РНК.
Секвенирование позволяет определить нуклеотидную последовательность ДНК. В связи с этим данный метод активно применяется для выявления генных мутаций при моногенных заболеваниях. Наиболее используемый вариант секвенирования известен также как метод Сэнджера. Как правило, перед секвенированием проводят ПЦР с целью увеличения концентрации ДНК фрагмента, последовательность которого необходимо определить. Далее, к однонитевой (денатурированной) молекуле ДНК присоединяется прямой и обратный праймеры и с помощью ДНК полимеразы проводят синтез новой молекулы ДНК на базе дидезоксинуклеозидтрифосфатов и немодифицированных единичных нуклеотидов. В классическом протоколе секвенирования с помощью этого метода предлагается проводить 4 реакции, в каждой из которых реакционная смесь содержит три немодифицированных нуклеотида и один дидезоксинуклеозидтрифосфат. Поскольку полимеризация ДНК будет каждый раз заканчиваться на дидезоксинуклеозидтрифосфате, то в каждой смеси будут находиться фрагменты разных размеров, соответствующие исследуемой последовательности, оборванной на нуклеотиде, замещенном дидезоксинуклеозидтрифосфатом. Затем результаты 4-х реакций анализируются с помощью электрофореза, складывая их, восстанавливается исходная последовательность ДНК. В настоящее время, благодаря созданию высокоразрешающих систем детекции, для секвенирования используются другие способы проведения реакции и анализа конечных результатов. Однако принцип метода остается прежним.
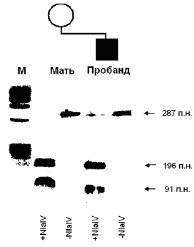
В связи с тем, что при многих наследственных заболеваниях патогенные мутации (в основном, рекуррентные) уже известны, отпадает необходимость использования метода секвенирования для их определения. В данном случае наиболее рационально применение рестрикционного анализа с последующей ПЦР. Этот метод использует способность некоторых ферментов (эндонуклеаз рестрикции или рестриктаз) «разрезать» фрагменты ДНК в зависимости от их последовательности в специфических сайтах. Этот процесс также называется рестрикцией. Для проведения данного анализа ДНК необходимо знать изменение последовательности, чтобы подобрать соответствующую рестриктазу. На первой стадии этого метода проводится рестрикция ДНК, а затем ПЦР фрагмента ДНК, в котором предположительно расположена мутация. Результаты ПЦР также анализируются с помощью электрофореза. В основном, используются такие рестриктазы, которые при условии наличия мутации взаимодействуют с ДНК, образуя два фрагмента различных размеров. Возможен также вариант, когда рестриктазы взаимодействуют с неизмененной последовательностью ДНК, тогда как при мутации рестрикции не происходит (рис. 18).
В ряде случаев возникает необходимость сравнительного анализа содержания фрагментов ДНК. С помощью подобных методов, в основном, исследуют полиморфные последовательности, которые с высокой вероятностью будут отличаться в зависимости от родительского происхождения. Они используются для определения родительского происхождения и диагностики однородительской дисомии, потери/приобретения последовательностей ДНК, а также Х-инактивации при условии предварительной обработки веществами, чувствительными к метилцитозину. Наиболее востребованным для этой цели методом является количественная ПЦР. Данная модификация использует мечение одного из праймеров, благодаря чему амплифицированный участок также становится меченным. Затем, с помощью различных систем детекции можно провести сравнительный количественный анализ ДНК фрагментов одного или нескольких аллелей.
Рис. 18. Результаты рестрикционного анализа с последующей ПЦР мутации R270X в гене МЕСР2 у пробанда с синдромом Ретта и его матери
Взаимодействие ДНК с рестриктазой NlaIV (+NlaIV) показывает наличие мутации у ребенка – дополнительная полоса, соответствующая апмлифицированному участку, необработанному рестриктазой (–NlaIV). У матери в данном случае мутации не обнаружено (М – маркер молекулярного веса для определения размера последовательности ДНК).