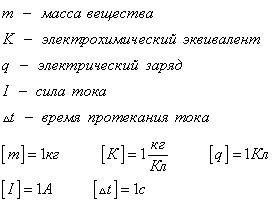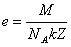какие жидкости проводят электрический ток
III. Основы электродинамики
Тестирование онлайн
Электрический ток в жидкостях
Как известно, химически чистая (дистиллированная) вода является плохим проводником. Однако при растворении в воде различных веществ (кислот, щелочей, солей и др.) раствор становится проводником, из-за распада молекул вещества на ионы. Это явление называется электролитической диссоциацией, а сам раствор электролитом, способным проводить ток.
В отличие от металлов и газов прохождение тока через электролит сопровождается химическими реакциями на электродах, что приводит к выделению на них химических элементов, входящих в состав электролита.
Первый закон Фарадея: масса вещества, выделяющегося на каком-либо из электродов, прямо пропорциональна заряду, прошедшему через электролит

Второй закон Фарадея:

Протекание тока в жидкостях сопровождается выделением теплоты. При этом выполняется закон Джоуля-Ленца.
Электрический ток в металлах
При прохождении тока металлы нагреваются. В результате чего ионы кристаллической решетки начинают колебаться с большей амплитудой вблизи положений равновесия. В результате этого поток электронов чаще соударяется с кристаллической решеткой, а следовательно возрастает сопротивление их движению. При увеличении температуры растет сопротивление проводника.

Применение электрического тока в металлах
Лампа накаливания производит свет за счет электрического тока, протекающего по нити накала. Материал нити накала имеет высокую температуру плавления (например, вольфрам), так как она разогревается до температуры 2500 – 3250К. Нить помещена в стеклянную колбу с инертным газом.
Электрический ток в газах
Газы в естественном состоянии не проводят электричества (являются диэлектриками), так как состоят из электрически нейтральных атомов и молекул. Проводником может стать ионизированный газ, содержащий электроны, положительные и отрицательные ионы.
Ионизация может возникать под действием высоких температур, различных излучений (ультрафиолетового, рентгеновского, радиоактивного), космических лучей, столкновения частиц между собой.
Прохождение электрического тока через газ называется газовым разрядом.
Электрический ток в вакууме
Электрический ток в жидкостях
Знакомство с явлением
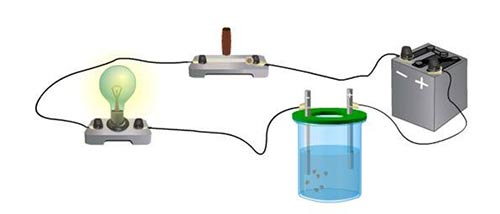
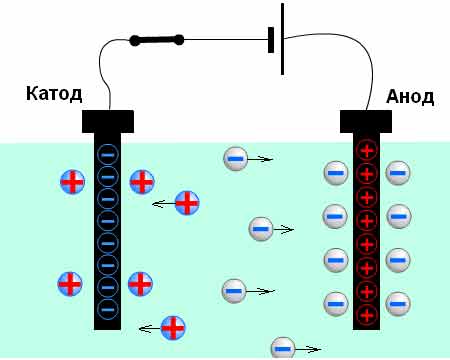
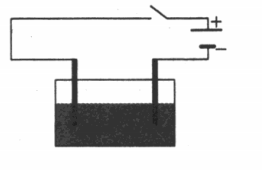
Соединим с источником тока последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены угольные электроды. Химически чистая вода почти не проводит ток.
Если же в воде растворить соль (например CuSO4, CuCl2), то лампочка загорится, а на катоде из раствора выделится медь.
Электролитическая диссоциация
По способности проводить электрический ток в водном растворе и расплаве все вещества делятся на электролиты и неэлектролиты.
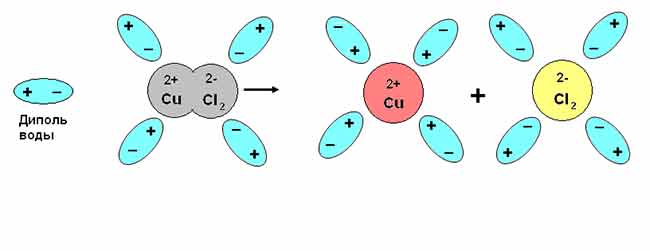
Электролитическая диссоциация – явление расщепления нейтральных молекул кислот, солей и щелочей при их растворении на положительные и отрицательные ионы.
Интенсивность электролитической диссоциации зависит:
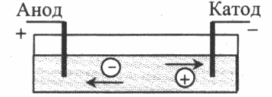
Электрический ток в растворах и (или расплавах) электролитов представляет собой упорядоченное перемещение ионов обоих знаков в противоположных направлениях.
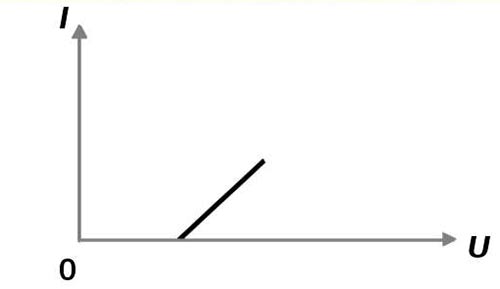
На вольт-амперной характеристике график смещен вследствие явления поляризации.
Справедлив закон Ома при неизменной концентрации раствора и температуры.
Электролиз
Электролиз – перенос вещества при прохождении электрического тока через электролит.
Электролиз сопровождается выделением на электродах, опущенных в электролит, составных частей растворенного вещества.Закон электролиза Фарадея
Масса вещества, выделившегося на электроде за время Dt при прохождении электрического тока, пропорциональна силе тока и времени:
k – электрохимический эквивалент вещества (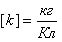
Сопротивление электролита уменьшается с ростом температуры, т. к. увеличивается количество ионов вследствие электролитической диссоциации.
Закон Фарадея позволяет определить заряд электрона:
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в 1881 г.
Применение электролиза
Рафинирование (очистка) металлов
Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом – тонкая пластинка из чистого металла, а электролитом – раствор соли данного металла, например при рафинировании меди – раствор медного купороса.
При определенных условиях на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия
Некоторые металлы, например алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным подом, а анодом – угольные стержни. Температура руды (около 900 0 С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через отверстие выпускают в форму для отливки.
Гальваностегия
Электролитический способ покрытия металлических изделий слоем благородных металлов не поддающихся окислению.
Гальванопластика
Используется для воспроизведения формы рельефных предметов (медалей, монет, точных копий художественных изделий).
Электроэпиляция
Используется в косметологии для удаления волос воздействием на волосяные фолликулы очень тонкими иголками.
Электрический ток в жидкостях, в полупроводниках, в вакууме, в газах
теория по физике 🧲 постоянный ток
Напоминаем, что в каждой среде есть свои носители электрических зарядов. В металлах ими служат свободные электроны, в электролитах — положительные и отрицательные ионы, в газах — ионы и электроны, полупроводниках — электроны и дырки, в вакууме — электроны. Электрический ток может течь с переносом и без переноса вещества. Перенос вещества осуществляется только ионами.
Электрический ток в электролитах
Электролиты — жидкости, проводящие электрический ток. К ним относят растворы солей, щелочей и кислот.
Положительные ионы (катионы) движутся к катоду, а отрицательные (анионы) — к аноду.
Пример №1. Электрическая цепь, изображенная на рисунке, включает в себя сосуд со слабым раствором поваренной соли (NaCl) и опущенными в него двумя электродами. В каком направлении (вправо, влево, вверх, вниз) будут двигаться ионы натрия при замыкании ключа:
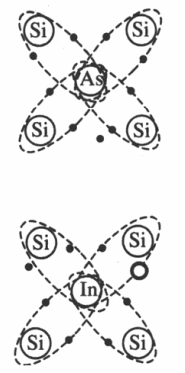
Электрический ток в полупроводниках
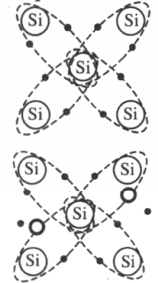
К полупроводникам относят элементы четвертой группы таблицы химических элементов Д.И. Менделеева, которые имеют 4 валентных электрона. Собственная
При низкой температуре все электроны участвуют в создании ковалентных связей, свободных электронов нет, и полупроводник ведет себя как диэлектрик. При повышении температуры или облучении полупроводников часть ковалентных связей разрушается, и появляются свободные электроны. На месте разрушенной связи возникает электронная вакансия — дырка. Она также перемещается по кристаллу и ведет себя подобно положительной частице.
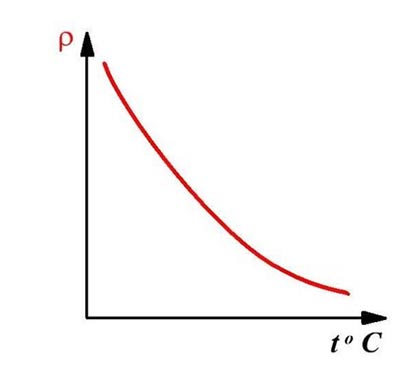
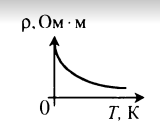
Зависимость удельного сопротивления полупроводников от температуры и внешнего излучения показана на графике.
В полупроводниках также может осуществляться примесная
Донорные примеси — это элементы пятой группы таблицы химических элементов Д.И. Менделеева. Только 4 из 5 валентных электрона участвуют в создании ковалентных связей. Остальные сразу становятся свободными. Полупроводник, основными носителями в котором являются отрицательные электроны, относятся к полупроводникам n-типа.
Акцепторные примеси — элементы третьей группы таблицы химических элементов Д.И. Менделеева. Три валентных электрона устанавливают ковалентные связи, а не месте четвертой появляется дырка. Полупроводник с положительными носителями относится к полупроводникам p-типа.
Применение полупроводниковых приборов
Термисторы — приборы, сопротивление которых изменяется при нагревании. Они позволяют определять малые изменения температуры.
Фоторезисторы — приборы, аналогичные термисторам, но сопротивление в них изменяется не при изменении температуры, а при изменении освещенности.
Полупроводниковый диод — соединение полупроводников двух типов. Обладает односторонней проводимостью.
Электрический ток в вакууме
Получение основных носителей происходит за счет термоэлектронной эмиссией.
Термоэлектронная эмиссия — процесс испускания электронов при нагревании катода до высокой температуры.
Свойства электронных пучков:
Электрический ток в газах
Электрический ток в газах называют разрядом. Обычно газы состоят из нейтральных молекул, поэтому они являются диэлектриками. Чтобы появились носители электрического заряда, необходима затрата энергии.
Несамостоятельный разряд. При нагреве газа или при облучении его атомов могут отделиться электроны, и атомы превращаются в положительные ионы.
Самостоятельный разряд. В газах при столкновении молекул может освободиться хотя бы один электрон. Если он попадет в электрическое поле, то начнет двигаться с ускорением. Сталкиваясь с нейтральным атомом газа, ускоренный электрон может «выбить» из него другой электрон, превратив сам атом в положительный ион. Электроны будут и дальше ускоряться, разрушая атомы. Ионы создают ток в противоположном направлении. Таким образом, электрический ток в газах создается электронами и ионами.
На рис. 1 изображена зависимость силы тока через светодиод D от приложенного к нему напряжения, а на рис. 2 – схема его включения. Напряжение на светодиоде практически не зависит от силы тока через него в интервале значений 0,05 А
Физика. 10 класс
Электролиз
Электрический ток в жидкостях
Необходимо запомнить
Жидкости по степени электропроводности делятся на:
— диэлектрики (дистиллированная вода);
— полупроводники (расплавленный селен).
Электролит – это проводящая электрический ток жидкость (растворы кислот, щелочей, солей и расплавленные соли).
Электролитическая диссоциация – распад молекул электролита на ионы при растворении в воде или расплавлении.
Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул, растворённого вещества. Степень диссоциации измеряется в долях или процентах.
Электропроводимость электролитов – ионная. Прохождение электрического тока связано с переносом вещества.
Явление электролиза – это выделение на электродах веществ, входящих в электролиты, в процессе окислительно-восстановительных реакций, которое возникает при прохождении через электролиты электрического тока.
$m = m_0 \cdot N = \frac
$m = k \cdot I \cdot t$
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения электрического тока.
k – электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
m – масса выделившегося вещества,
e – заряд электрона,
— получение чистых металлов (очистка от примесей);
— гальваностегия (никелирование, хромирование и т. д.);
— гальванопластика, т. е. получение отслаиваемых покрытий (рельефных копий).
Лабораторная работа «Определение элементарного заряда методом электролиза»
Техническое применения электролиза
Гальваностегия – покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет. Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними.
Гальванопластика – электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала.
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским учёным Якоби Б.С., который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди – катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли насыпают глинозём (оксид алюминия Аl2O3), полученный путем переработки бокситов – руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозём при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.
Описанный способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту металлом.
Путем электролиза расплавленных солей в настоящее время получают также натрий, калий, магний, кальций и другие металлы.
Электролиз используется для гальваностегии, гальванопластики, рафинирования меди, получения алюминия и других целей.
Электрический ток в жидкостях
Что такое электрический ток в жидкостях
Электролитическая диссоциация — это процесс распада молекул на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решетках твердых электролитов
Электролиз — это процесс выделения на электроде вещества при окислительно-восстановительных реакциях.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Опишем механизм протекания электролиза в физике. Ток в жидкостях зависит от движения заряженных ионов, которые приняли или отдали похожие молекулы и атомы. Показателем такого движения служит изменение характеристик определенного вещества, в котором проходят ионы. Получается, что необходимо опираться на основное определение электрического тока, чтобы сформулировать понятие формирования тока в разных жидкостях. Разложение отрицательно заряженных ионов приводит к движению в область источника тока с положительными значениями. Положительно заряженные ионы в таком случае будут двигаться в ином направлении — к отрицательному источнику тока.
Происхождение, количественные и качественные характеристики
Чтобы определить основные параметры тока, следует использовать известные теории и формулы. Самый распространенный — закон Ома. Он является универсальной амперной характеристикой, через которую применяется принцип зависимости тока от напряжения. Единица измерения напряжения — Ампер.
Чтобы провести опыты с водой и солью, нужно взять сосуд с соленой водой. Это даст представление о применении явлений, происходящих при содержании электрического тока в жидкостях, на практике. Кроме того, в установке должны быть электроды прямоугольной формы и источники питания. Для полной подготовки к опыту следует иметь амперную установку. С ее помощью энергия переводится от сети питания к электродам.
В роли проводников выступают металлические пластины. Их опускают в жидкость и подключают напряжение. Частицы перемещаются в хаотичном порядке. При появлении магнитного поля между проводниками все процессы движения частиц упорядочиваются.
Ионы начинают обмениваться зарядами и соединяться. Так катоды становятся анодами и наоборот. В данном явлении нужно обратить внимание на еще несколько факторов:
В результате эксперимента на пластинах образуется слой соли.
Каким законом описывается
Электролитическая диссоциация описывается законом Майкла Фарадея: масса вещества, выделяющегося на каком-либо из электродов, прямо пропорциональна заряду, который прошел через электролит:
Здесь m — масса вещества, K — электрохимический эквивалент, q — электрический заряд, I — сила тока, Δt — время протекания тока.
Второй закон Фарадея: для данного количества электрического заряда масса химического элемента, который осажден на электроде, прямо пропорциональна эквивалентной массе элемента.
Эквивалентная масса вещества — это его молярная масса, поделенная на целое число, которое зависит от заданной химической реакции.
Формула для второго закона выглядит так:
Проводимость жидкостей, какие не проводят ток
Проводят ток только ионные жидкости или электролиты. Это, например, растворы солей, кислот или щелочей.
Не проводят ЭТ все неполярные жидкости, то есть соединения, молекулы которых обладают электрическим дипольным моментом. К ним относятся, керосин, бензин и различные масла.