какие значения степени окисления может иметь фтор
Степень окисления фтора
Общие сведения о степени окисления фтора
Фтор – неметалл. Самый электроотрицательный элемент. В обычных условиях фтор представляет собой газ бледно-желтого цвета. Ядовит.
В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
Молекула фтора двухатомна F2. Обладает самой низкой поляризуемостью среди галогенов. Температура плавления фтора аномально низкая. Не растворим в воде, т.к. разлагает ее (2F2 + 2H2O = 4HF + O2).
Степень окисления фтора в соединениях
Фтор образует двухатомные молекулы состава F2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Примеры решения задач
Затем найдем наименьшее общее кратное (знак «-» или «+» не учитываем):
Разделим полученное значение на величину степени окисления, а полученные цифры запишем в виде индексов, указывающих количество атомов каждого элемента в составе молекулы:
Аналогичным образом составляем формулы нитрида бария и нитрида кремния. Они будут иметь следующий вид: Ba2N3 и Si3N4.
Затем найдем наименьшее общее кратное (знак «-» или «+» не учитываем):
Разделим полученное значение на величину степени окисления, а полученные цифры запишем в виде индексов, указывающих количество атомов каждого элемента в составе молекулы:
Степень окисления фтора
Степень окисления фтора.
Степень окисления фтора:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону ( катиону ), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона ( аниона ), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Фтор F
Фтор в таблице менделеева занимает 9 место, в 2 периоде.
| Символ | F |
| Номер | 9 |
| Атомный вес | 18.9984032 |
| Латинское название | Fluorum |
| Русское название | Фтор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фтора
Порядок заполнения оболочек атома фтора (F) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Фтор имеет 9 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
5 электронов на 2p-подуровне
Степень окисления фтора
Ионы фтора
Валентность F
Валентность фтора характеризует способность атома F к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа F
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения фтора
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Какая степень окисления у фтора?
Дайте краткую характеристику элемента фтора. Положение в периодической системе; электронная конфигурация атомов; валентные возможности. Какая степень окисления у фтора (с примерами веществ)? Укажите высший оксид, его характер, высший гидроксид, его характер.
Фтор — девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIIA группе. В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов.
Электронная формула атома фтора в основном состоянии имеет следующий вид:
Фтор проявляет постоянную валентность I во всех своих соединениях.
Фтор образует двухатомные молекулы состава F2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Фтор характеризуется наибольшим значением электроотрицательности, в своих соединениях он всегда имеет постоянную отрицательную степень окисления равную (-1) (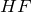
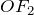
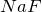
Высший оксид фтора — 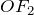
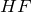
Валентность и степень окисления
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления





















