субокклюзия артерии сердца что это
Субокклюзия артерии сердца что это
Атеросклероз является причиной ишемической болезни сердца. Наиболее частой причиной уменьшения коронарного кровотока является атеросклероз. Развитие атеросклеротического процесса — специфическое нарушение липидного обмена. Суть этого процесса заключается в следующем.
У людей с генетической предрасположенностью к атеросклерозу, а также у людей, потребляющих большое количество холестерола с пищей и ведущих малоподвижный образ жизни, избыток холестерола постепенно откладывается в артериях под эндотелиальным слоем. Постепенно эти отложения прорастают фиброзной тканью и часто кальцинируются. В результате формируются атеросклеротические бляшки, которые выступают в просвет сосуда и приводят к полному или частичному перекрытию кровотока. Типичное место расположения атеросклеротических бляшек — первые несколько сантиметров крупных коронарных артерий.
Острая коронарная окклюзия
Острая коронарная окклюзия (закупорка сосуда) чаще развивается у людей с атеросклерозом коронарных артерий и почти никогда — у людей с нормальным коронарным кровообращением. Острая окклюзия может быть вызвана одной из следующих причин. 1. Атеросклеротическая бляшка приводит к местному свертыванию крови и образованию тромба, который перекрывает просвет артерии. Тромб возникает, если атеросклеротическая бляшка повреждает эндотелий и вступает в прямой контакт с протекающей кровью.
Поскольку бляшка имеет неровную поверхность, происходит адгезия тромбоцитов к поверхности бляшки, откладывается фибрин, образуется красный тромб, который продолжает расти, пока полностью не перекроет просвет сосуда. Нередко тромб отрывается от атеросклеротической бляшки и с током крови попадает в периферическую ветвь коронарной артерии, блокируя кровоток в этом участке. Тромбы, которые закупоривают сосуд, попадая в него с кровью, называют эмболами. 2. Многие клиницисты полагают, что местный спазм коронарной артерии тоже может вызвать нарушение кровообращения. Причиной спазма может быть непосредственное раздражение гладкомышечной стенки артерии краями атеросклеротической бляшки или же местное рефлекторное сосудосуживающее влияние. Спазм артерии приводит к вторичному тромбообразованию.
Жизненно важное значение коллатерального кровообращения в сердце. Тяжесть повреждения сердечной мышцы как при медленном развитии атеросклеротического процесса, так и при внезапной окклюзии коронарных артерий в большой степени зависит от состояния коллатерального кровообращения сердца. Имеет значение и уже существующая коллатеральная сеть, и коллатерали, которые открываются в первые минуты окклюзии.
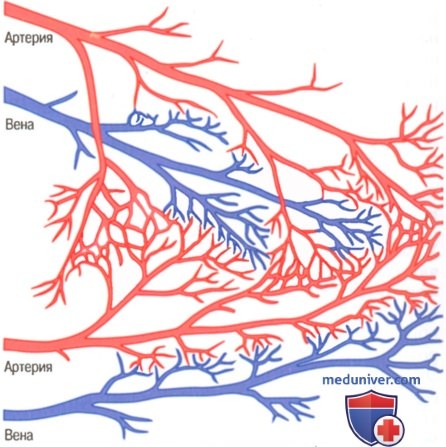
В здоровом сердце практически нет коллатералей между крупными коронарными артериями, однако существуют множество коллатеральных анастомозов между мелкими артериями диаметром от 20 до 250 мкм (рисунок выше).
При внезапной окклюзии одной из основных коронарных артерий мелкие анастомозы начинают расширяться уже через несколько секунд. Однако кровоток через мелкие коллатеральные сосуды обычно бывает в 2 раза меньше, чем требуется для выживания сердечных клеток.
В течение следующих 8-24 ч диаметр коллатеральных анастомозов существенно не увеличивается. Затем коллатеральный кровоток начинает расти. На второй или третий день его интенсивность увеличивается в 2 раза, а к концу первого месяца коронарный кровоток достигает нормального уровня. Благодаря развитию коллатеральных сосудов многие больные практически полностью выздоравливают после перенесенной коронарной окклюзии, если только зона повреждения миокарда не была слишком большой.
Если атеросклеротическое сужение коронарных артерий прогрессирует медленно, в течение многих лет, коллатеральное кровообращение развивается по мере того, как атеросклеротическое поражение становится все тяжелее. Поэтому у такого рода больных никогда не бывает острых нарушений сердечной деятельности. Однако коллатеральный кровоток не может компенсировать все большее развитие склеротического процесса, тем более что атеросклероз нередко поражает и сами коллатеральные сосуды. Если это происходит, производительность сердца резко ограничивается, оно оказывается не в состоянии перекачивать необходимый объем крови даже в состоянии покоя. Это является самой распространенной причиной развития сердечной недостаточности у большого числа пожилых людей.
Видео этиология, патогенез инфаркта миокарда
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Оперативные вмешательства при сужении сосудов. Коронарная ангиопластика
Сегодня существует несколько неинвазивных методик, эффективно используемых при сужении сосудов.
К самым популярным в современной эндоваскулярной (сосудистой) хирургии методам относятся ангиопластика и стентирование.
Малоинвазивные операции на сосудах производятся через небольшой прокол или разрез на коже пациента. В сделанное 
Просвет здоровой артерии равномерно широкий, а стенки гладкие. Возраст и атеросклероз провоцируют появление на стенках сосудов отложений, состоящих из фиброзной ткани, кальция и холестерина. Это так называемые атеросклеротические бляшки. Чем больше на стенках артерий таких бляшек, тем сильнее сужается просвет сосуда и ухудшается кровоток. В конечном итоге сужение достигает критической степени, и нормальный кровоток становится невозможен. Развивается ишемия (недостаточное кровоснабжение) и, как следствие, боль и даже некроз (омертвение) тканей.
Ангиопластика (балонная) чаще всего используется для лечения заболеваний периферических сосудов, иногда – для восстановления функциональной проходимости вен. Кроме того, она бывает единственной медицинской альтернативой коронарного шунтирования, в частности, потому что не требует разреза для проведения манипуляций, выполняется под местной анестезией, а период реабилитации после операции достаточно короткий.
Стентирование применяется в случае, если нужно не просто расширить просвет сосуда, но и армировать его постановкой стента – миниатюрного проволочного каркаса.
Показания к операции
Традиционно операция на сосудах показана всем пациентам с умеренным или тяжелым сужением сосудов.
Противопоказанием может служить значительная закупорка сосуда (кончик катетера не проходит через место сужения).
Осложнения, возникающие после стентирования
Нельзя исключать возможность возникновения осложнения после стентирования:
Операция по коронарной ангиопластике
Предоперационная подготовка к коронарной ангиопластике (транслюминальной реконструкции) заключается в полном обследовании пациента, в ходе которого обязательно проводятся:
Перед операцией рекомендовано воздерживаться от приема пищи. Касательно приема лекарств (особенно, противодиабетических препаратов) необходимо проконсультироваться у кардиолога.
Специфика процедуры
Через бедренную артерию пациента вводится катетер и проводится к суженному участку артерии для интраоперационной коронарографии, в ходе которой выявляется место и стадия сужения артериального просвета.
На основании полученных данных, кардиохирург выбирает баллон соответствующего размера и подходящий катетер-проводник. Для того чтобы предупредить тромбообразование и дополнительно разжижить кровь, пациенту назначается гепарин.
Катетер-проводник – это тончайшая проволока, имеющая рентгеноконтрастный наконечник, которая вводится в пораженную коронарную артерию пациента. Получив полную картину, кардиохирург направляет проводник в нужное место.
Наконечник выводится за место сужения просвета артерии.
После этого через проводник вводится баллонный катетер, который доставляет баллон на место сужения. После надувания, баллон расширяет просвет артерии, расплющивая бляшку. Если целью операции является постановка стента, то он при раздувании баллона вдавливается в стенку сосуда, армируя пораженный участок и не давая ему сужаться.
Эффект и реабилитация
Как правило, в результате успешно проведенной операции по коронарной ангиопластике значительно улучшается кровоток в коронарных сосудах и значительно сокращается вероятность проведения аортокоронарного шунтирования.
Чтобы минимизировать проявления основного заболевания, следует придерживаться предписанной врачом диеты, воздерживаться от курения и исключить стрессовые моменты.
Уже через шесть часов после успешной операции пациенту разрешают вставать и ходить, но первые два дня он проводит в стационаре кардиоцентра.
Реабилитационный период длится в среднем неделю.
Опыт эндоваскулярного лечения ишемической болезни сердца у пациентов с хронически окклюзированными коронарными артериями
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации,
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации, требующих проведения реваскуляризации миокарда.
Так, окклюзированные коронарные артерии выявляются примерно у 40% пациентов, а коронарная ангиопластика на хронически окклюзированных коронарных артериях составляет 10—20% всех интервенционных процедур [1].
Многие авторы ссылаются на то, что при ангиопластике хронических окклюзий коронарных артерий процент успешных вмешательств ниже, тогда как время облучения больше и стоимость процедуры выше, чем при ангиопластике у больных со стенотическими поражениями [10].
В Научно-практическом центре интервенционной кардиоангиологии (НПЦИК) при проведении плановой диагностической КАГ также довольно часто обнаруживаются полные хронические окклюзии 1-2 или более коронарных артерий. В связи с чем нами было проведено исследование, целью которого явилась оценка эффективности эндоваскулярного лечения хронически окклюзированных коронарных артерий.
В НПЦИК в период с октября 1997 по декабрь 2002 гг. были осуществлены 380 попыток механической реканализации хронически окклюзированных коронарных артерий у 375 больных. При этом успешными процедуры были признаны у 253 больных (67,5%), которым реканализировали 258 сегментов. В 122 случаях (32,5%) процедура реканализации оказалась неэффективной.
Проводниковая реканализация и коронарная ангиопластика окклюзированной артерии выполнялись 107 больным на 107 сегментах; реканализация, транслюминальная баллонная ангиопластика (ТЛАП) и стентирование — 146 больным, которым был реканализирован 151 сегмент.
В нашем исследовании в 2 случаях (0,53%) имелись осложнения — разрыв коронарной артерии передней межжелудочковой ветви левой коронарной артерии (ПМЖВ) и правой коронарной артерии (ПКА), потребовавшие хирургического вмешательства — эмболизации и ушивания артерии соответственно. Оба пациента живы и выписаны из клиники.
В настоящем исследовании представлены результаты обследования и лечения 185 человек ИБС, которым была выполнена процедура реканализации хронически окклюзированной коронарной артерии и которые прошли контрольное обследование, включающее коронароангиографию.
Пациенты были разделены на 2 группы: у 146 человек проводилось стентирование 151 сегмента после реканализации хронически окклюзированной коронарной артерии, у 107 больных — проведена ТЛАП. В исследование не включались больные, у которых процедура осуществлялась в острой стадии инфаркта миокарда (ИМ), а также пациенты, перенесшие ранее процедуры на венечных сосудах.
Диагностику ИБС и ее форм проводили на основании тщательного сбора анамнеза, данных электрокардиографии (ЭКГ), холтеровского мониторирования ЭКГ, эхокардиографического исследования (ЭхоКГ), велоэргометрической пробы (ВЭМ), клинического и биохимического анализа крови (КФК, КФК-МБ, АСТ, ЛДГ, холестерина и липидного спектра крови). Для оценки состояния и степени поражения коронарных артерий, сократительной и функциональной способности миокарда левого желудочка (ЛЖ) всем пациентам выполняли селективную коронароангиографию и левую вентрикулографию (ВГ).
Показаниями для проведения эндоваскулярной процедуры являлись приступы стенокардии, признаки ишемии миокарда, по данным суточного мониторирования ЭКГ, а также положительные результаты нагрузочных проб.
Клиническая характеристика пациентов представлена в таблице. В подавляющем большинстве случаев наблюдался III функциональный класс (ФК) стенокардии напряжения — 60,0 и 72,0% в 2 группах соответственно. Стенокардия напряжения I ФК в обеих группах больных в исследовании не встречалась. У 3 (4%) пациентов из группы ТЛАП была выявлена безболевая ишемия миокарда.
Инфаркт миокарда ранее перенесли 80% человек из первой группы и 86,7% пациентов второй группы, гипертоническая болезнь различной стадии и длительности была выявлена соответственно у 60,9 и 69,3% больных.
Сахарным диабетом 2 типа страдали 7,3% пациентов в группе стентирования и 5,3% больных в группе ТЛАП. Во всех случаях имела место средняя тяжесть течения заболевания. Сахарный диабет 1 типа не встречался в нашем исследовании ни в одном случае.
Предполагаемая длительность («возраст») окклюзии определялась как период времени от перенесенного инфаркта миокарда в области, кровоснабжаемой окклюзированной артерией, либо от эпизода стенокардии большей, чем обычно, интенсивности. Длительность окклюзии до 3 мес. наблюдалась у 46,4% пациентов из первой группы и у 46,7% — из второй группы. «Возраст» окклюзии от 3 до 6 мес. был выявлен у 30,9% больных первой группы и у 25,3% больных второй группы, от 6 до 12 мес. — 14,5 и 17,3% соответственно, свыше 12 мес. — 8,2 и 10,7% больных соответственно.
Для уточнения характера поражения коронарного русла и оценки функции ЛЖ всем больным выполнялись селективная КАГ и левая ВГ. Гемодинамически значимыми считались поражения, стенозирующие просвет коронарной артерии более чем на 50%.
Общее количество гемодинамически значимых атеросклеротических поражений (больше 50% просвета артерии) составило 248 у 110 больных в группе стентирования и 152 у 75 больных в группе ТЛАП. Основное количество поражений было локализовано в ПМЖВ и ПКА.
Наиболее часто процедура выполнялась на ПМЖВ — 50,45 и 56,0%, в первой и второй группах соответственно. На ПКА было выполнено 25,67% процедур в группе стентирования и 21,30% в группе ТЛАП. На огибающей ветви левой коронарной артерии (ОВ ЛКА) — 19,47 и 17,30% процедур соответственно.
Все больные получали симптоматическую терапию, заключавшуюся в назначении нитратов (нитросорбид, кардикет, моно мак), β-блокаторов (атенолол, конкор, эгилок, беталок-ЗОК, дилатренд), антагонистов Са (амловас, норваск, нормодипин, лацидипин), ингибиторов АПФ (эналаприл, престариум, фозиноприл) и статинов (зокор, липримар, симгал).
Непосредственный ангиографический успех процедуры у больных после проведения стентирования и баллонной ангиопластики был довольно высоким, остаточный стеноз не превышал 30%, а антеградный кровоток у всех пациентов определялся как TIMI III. В подавляющем большинстве случаев диаметр стентированного сегмента практически не отличался от прилегающих интактных сегментов коронарной артерии.
Для имплантации применялись различные стенты, однако наиболее часто использовались следующие стенты: BX Velocity (Cordis, Johnson&Johnson) — 26 (23,0%), BX Sonic (Cordis, Johnson&Johnson) — 15 (13,3%), CrossFlex (Cordis, Johnson&Johnson) — 14 (12,4%), Biodivysio (Biocompatible) — 12 (10,6%), Angiostent (Angio Dynamics, NJ) — 10 (8,9%), Multilink (Guidant, Santa Clara, CA) — 7 (6,2%). Средняя длина стента составила 17,96±4,79 мм, средний диаметр стента — 2,98±0,27 мм.
У 9 (8,2%) больных в основную артерию были установлены по 2 коронарных стента. У 1 (0,9%) больного в основную артерию имплантировано 3 стента.
При проведении стентирования ни в одном случае не отмечалось острого или подострого тромбоза стента. Спазм коронарной артерии после стентирования определяли в 2 (1,8%) случаях, что потребовало только медикаментозной коррекции. У 3 (2,7%) пациентов была отмечена окклюзия боковой ветви, ни в одном случае не сопровождавшаяся существенной клинической симптоматикой или развитием инфаркта миокарда.
Одновременно с основной процедурой 31 больному проводилась эндоваскулярная процедура на другом поражении коронарного русла. При этом у 24 (21,8%) больных была выполнена одна дополнительная процедура, у 7 (6,4%) пациентов — 2 процедуры.
В результате проведенного эндоваскулярного лечения полная реваскуляризация миокарда, т. е. устранение всех гемодинамически значимых стенозов, оказалась выполнена более чем у 60% больных в обеих группах.
На госпитальном этапе отсутствие обострений после вмешательства отмечали у 100% больных в группе стентирования и у 98,7% в группе ТЛАП, т. е. у всех больных проведение эндоваскулярных процедур обусловило стабилизацию состояния и купирование приступов стенокардии. Развития острого инфаркта миокарда, необходимости в оперативном лечении ни в одном случае отмечено не было. Госпитальной летальности в нашем исследовании также не наблюдалось.
Полученные в настоящее время данные рандомизированных исследований свидетельствуют о том, что позднее открытие окклюзированных венечных артерий оказывает положительное влияние на частоту неблагоприятных кардиальных событий в отдаленном периоде (снижение смертности, частоты повторных ИМ), улучшает функцию ЛЖ, влияет на его ремоделирование после перенесенного ИМ.
Отмечено, что выживаемость пациентов через 2 года после коронарной ангиопластики составляет 98%, а отсутствие инфарктов за тот же период отмечалось у 94% больных [2, 12].
По данным исследования, проведенного P. A. Sirnes, у пациентов после реканализации, ТЛАП и стентирования хронически окклюзированных коронарных артерий в отдаленном периоде наблюдалось значительное улучшение клинического состояния по сравнению с исходным. До ТЛАП 83% пациентов принимали b-блокаторы и 55% — нитраты. В отдаленном периоде соответствующие цифры составили 53 и 9% (p Рисунок 1. Ангиограмма пациента Ф. (68 лет), с хронической окклюзией ПКА
Частота рестеноза ТЛАП, согласно многочисленным исследованиям, выполненным в различных странах, колеблется в пределах от 17 до 50% [3, 4, 5, 7, 8, 9, 13].
По данным P. A. Sirnes и соавт., после баллонной ангиопластики хронически окклюзированных коронарных артерий частота отдаленного рестеноза составляет 53%, после стентирования коронарных артерий — 40% [11].
Анализ наших собственных данных (НПЦИК) показывает, что в отдаленные сроки после стентирования хороший ангиографический результат процедуры сохранялся в 68 (60,2%) артериях (рис. 1—3). Рестеноз стента был выявлен в 28,3%, реокклюзия — в 11,5% случаев.
 |  |
| Рисунок 2. Ангиограмма пациента Ф. (68 лет) после проведения механической реканализации, ТЛАП и стентирования ПКА | Рисунок 3. Отдаленный результат механической реканализации, ТЛАП и стентирования хронически окклюзированной ПКА (через 7 месяцев) |
Менее утешительные результаты получены после коронарной ангиопластики в аналогичных ситуациях: хороший результат процедуры выявлен лишь в 41,3% случаев, рестеноз в месте проведения ангиопластики наблюдали в 38,7% случаев, а реокклюзию — у 20% больных.
Таким образом, в отношении сохранения хороших результатов проведения ангиопластики стентирование хронически окклюзированных венечных артерий обладает достоверными преимуществами по сравнению с баллонной ангиопластикой.
Мы считаем, что по мере развития материально-технической базы медицинских учреждений, накопления опыта проведения интервенционных вмешательств, а также более точного отбора больных доля успешно выполненных процедур будет расти.
На основании всего вышеизложенного можно сделать следующие выводы.
По вопросам литературы обращайтесь в редакцию.
Д. Г. Иоселиани, доктор медицинских наук, профессор
М. В. Яницкая, кандидат медицинских наук
А. В. Кононов, О. В. Захарова, П. Ю. Лопотовский
Научно-практический центр интервенционной кардиоангиологии, Москва
Эндоваскулярные методы диагностики
Отделения эндоваскулярной хирургии на Рублевском шоссе д.135
Отделения эндоваскулярной хирургии на Ленинском проспекте д. 8.к.7
За последние десятилетия в нашей стране значительно увеличилось число клиник, занимающихся эндоваскулярной хирургией. Девяностые годы XX столетия стали эпохой расцвета эндоваскулярной хирургии. Катетерная техника достигла высокого уровня развития и постоянно продолжает совершенствоваться. Практически ежегодно возникают высокотехнологические новшества. Части из них суждено остаться в истории интервенционной кардиологии, а части — стать совершенным орудием оператора. И только большой экспериментальный и клинический опыт сможет определить место каждого метода в эндоваскулярной хирургии.
На сегодняшний день рентгенэндоваскулярные вмешательства представляют альтернативу практически любой открытой операции по поводу патологии сердца и сосудов. Спектр выполняемых эндоваскулярных вмешательств огромен.
ФГБУ НМИЦ ССХ им. А.Н. МЗ РФ является одним из пионеров отечественной эндоваскулярной хирургии. Именно здесь в 1982 году был заложен краеугольный камень многих школ по рентгенэндоваскулярным диагностике и лечению. Сегодня отделения ФГБУ НМИЦ ССХ им. А.Н. МЗ РФ, занимающиеся оказанием рентгенэндоваскулярной медицинской помощи оснащены современнейшим оборудованием, не уступающим ведущим клиникам Европы и США, включая все доступные методики внутрисосудистой визуализации и инвазивной оценки внутрикоронарной физиологии. Ежегодно в центре выполняется более 15000 диагностических эндоваскулярных вмешательств и более 3000 тысяч эндоваскулярных операций у пациентов с ишемической болезнью сердца, сосудистой патологией, врожденными и приобретенными пороками сердца. Состав отделений представлен первоклассными специалистами международного уровня, обладающими большим опытом выполнения данных операций при сложных клинических случаях.
Ишемическая болезнь сердца
Ишемическая болезнь сердца — острое или хроническое поражение миокарда, возникающее вследствие уменьшения или прекращения снабжения сердечной мышцы артериальной кровью, в основе которого лежат патологические процессы в системе коронарных артерий. ИБС широко распространенное заболевание. Одна из основных причин смертности, временной и стойкой утраты трудоспособности во всем мире. В структуре смертности сердечно-сосудистые заболевания стоят на первом месте, из них на долю ИБС приходится около 40%.
Этиология ИБС
Ведущий этиологический фактор развития ишемической болезни сердца — атеросклероз коронарных артерий. Атеросклероз развивается последовательно, волнообразно и неуклонно. В результате накопления холестерина в стенке артерии формируется атеросклеротическая бляшка. Избыток холестерина приводит к увеличению бляшки в размере, возникают препятствия току крови. Симптомы усугубляются с ростом атеросклеротической бляшки, постепенно суживающей просвет артерии. Уменьшение площади просвета артерии более чем на 90-95% является критическим, вызывает снижение коронарного кровотока и ухудшение самочувствия даже в покое.
Клиническая картина ИБС
Первое описание стенокардии предложил английский врач Уильям Геберден в 1772 году: «. боль в грудной клетке, возникающая во время ходьбы и заставляющая больного остановиться, в особенности во время ходьбы вскоре после еды. Кажется, что эта боль в случае ее продолжения или усиления способна лишить человека жизни…» Обычно симптомы болезни впервые появляются после 50 лет. В начале возникают только при физической нагрузке.
Классическими проявлениями ишемической болезни сердца являются:
Диагностика ИБС
«Золотым стандартом» в диагностике обструктивных поражений коронарных артерий сердца считается селективная коронарография. Это рентгеноконтрастное исследование применяется для того, чтобы узнать является ли существенным сужение сосуда, какие артерии и сколько их поражено, в каком месте и на каком протяжении.
Лечение ИБС
Лечение данной патологии в первую очередь направлено на восстановление нормального кровоснабжения миокарда и улучшение качества жизни больных. К сожалению, чисто терапевтические (консервативные) методы лечения не всегда эффективны. На сегодняшний день общепринятыми методами лечения ИБС с доказанной и неоспоримой эффективностью является хирургическая реваскуляризация миокарда – коронарное шунтирование (КШ) и чрескожное коронарное вмешательство (ЧКВ) или «стентирование».
Первое стентирование коронарной артерии у человека выполнили J. Puel и соавт. в марте 1986 г. в Тулузе (Франция) и практически одновременно с ними U. Sigwart и соавт. в Лозанне (Швейцария).
Сегодня в эпоху высоких технологий в области фармацевтики и медицинской инженерии современные внутрикоронарные стенты позволяют достичь хороших результатов как в раннем, так и в отдаленном периодах после ЧКВ.
Данная операция выполняется под местной анестезией. В области запястья или бедра проводится пункция артерии (лучевой или бедренной), устанавливается интродьюсер (катетер), через него по проводнику под контролем ангиографической установки заводится проводниковый катетер.
Катетер устанавливается в левую или правую коронарную артерию, далее производится серия снимков. Через установленный катетер проводится микропроводник в артерию через пораженный участок. По микропроводнику к пораженному участку заводится и устанавливается коронарный стент.
На сегодняшний день спектр чрескожных коронарных вмешательств значительно расширился от лечения простых локальных сужений до многососудистой реваскуляризации миокарда (в т.ч. ствола левой коронарной артерии) и реканализации хронически окклюзий (полностью закрытых сосудов) коронарных артерий. Сегодня в клиническую практику внедрены стенты со специальным биорассасывающимся покрытием, позвовляющим снизить частоту рестеноза (зарастания) и тромбоза стента, тем самым минимизируя риск повторных инфарктов у пациента после стентирования. Также в широко введены методы внутрисосудистой визуализации, позволяющие получить изображения коронарных артерий в режиме реального времени у пациента во время операции, сопоставимые с данными, полученными при использовании светового микроскопа. Все вышесказанное позволяет получить внутрипросветное изображение коронарных артерий в режиме реального времени. Это позволяет хирургу получить «ювелирный» результат при установке стента в коронарные сосуды.
Интраоперационная шунторафия
В ФГБУ НМИЦ ССХ им. А.Н. Бакулева в рутинную практическую деятельность введена интраоперационная шунтография. Интраоперационная шунтография представляет с собой ангиографическое исследована на завершающем этапе операции аорто-коронарного шунтирования. С помощью анигографии проверяется проходимость всех наложенных шунтов прямо в кардиохирургической операционной. В случае выявления поражения или нарушения функционирования шунта, оперирующий хирург получает возможность устранить её непосредственно в операционной, тем самым достигается «идеальный» результат большой кардиохирургической операции.
ФГБУ НМИЦ ССХ им. А. Н. Бакулева МЗ РФ является единственным центром в Российской Федерации и одним из не многих центров мира, где интраоперационная шунтография выполняется одновременно с коронарным шунтированием.
Врожденные пороки сердца (ВПС)
Вторая половина ХХ века ознаменовалась головокружительными успехами фактически во всех аспектах детской сердечно-сосудистой хирургии.
В настоящее время с помощью рентгенэндоваскулярных методов лечения можно устранить такие врожденные пороки сердца как дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП) или Боталлов проток, открытое овальное окно ( ООО), дефект межжелудочковой перегородки (ДМЖП), коарктация аорты. За последнее десятилетие данные вмешательства стали «стандартной» процедурой практически с нулевой летальностью. Рентгенэдоваскулярные методы лечения являются методом выбора при таких критических состояниях новорожденных, как критический клапанный стеноз аорты и легочной артерии. Выполнение баллонной атриосептостомии, предложенной в 1966 году Рашкиндом и Миллером, у новорожденных со сложными ВПС несовместимыми с жизнью привело резкому снижению летальности среди этой тяжелой категории больных.
На сегодняшний день в ФГБУ НМИЦ ССХ им. А.Н. Бакулева МЗ РФ выполняется полный спектр эндоваскулярных вмешательств при врожденных пороках сердца у пациентов всех возрастных групп, в том числе у новорожденных с критическими пороками развития сердца и сосудов. Многие операции выполнены впервые в мировой практике, а разработанные методики имеют уникальный характер. Наиболее часто встречаются открытый артериальный проток, дефект межпредсердной перегородки, коарктация аорты, клапанный стеноз аорты и легочной артерии.
Коарктации аорты
Клиника
Пациенты жалуются на головокружение, тяжесть и головную боль, повышенную утомляемость, носовые кровотечения, возможны боли в сердце, а также на слабость и боли в нижних конечностях, судороги в мышцах ног, зябкость стоп. У женщин возможны нарушения менструального цикла, бесплодие. При осмотре отмечается хорошее физическое развитие с диспропорцией мышечной системы: мышцы верхней половины туловища гипертрофированы при относительной гипотрофии мышц таза и нижних конечностей, ноги на ощупь холодные. При пальпации межреберных артерий отмечается их повышенная пульсация.
Решающее значение в диагностике коарктации аорты имеет определение характера пульса на руках и ногах. На бедренных артериях отсутствует или резко ослаблена пульсация и при этом напряженный пульс на верхних конечностях. Систолическое артериальное давление на руках у больных с изолированной резко выраженной коарктацией аорты достигает высоких цифр до 190-200/90-100 мм рт.ст.
Диагностика
Диагноз предполагают по данным клинического обследования (в том числе измерения артериального давления на всех 4 конечностях), подтверждают рентгенографией грудной клетки и ЭКГ и устанавливают на основании результатов двухмерной эхокардиографии с цветным потоком и допплеровского исследования. У старших пациентов – с помощью КТ- или МР-ангиографии.
Наиболее информативным методом выявления коарктации аорты является двухмерная эхокардиография (ЭхоКГ).
Эндоваскулярное лечение В нашей стране первую ТЛБАП коарктации аорты произвели Ю.С. Петросян и соавт. в 1985 году в Институте сердечно-сосудистой хирургии АМН СССР. Операция выполняется под седацией через небольшой прокол бедренной артерии. Через прокол проводится катетер и баллон к месту сужения аорты. Далее выполняется расширение суженного участка аорты баллоном соответствующего размера с восстановлением просвета и кровотока по аорте. ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» обладает большим опытом лечения коарктации аорты.
Ангиограмма пациента с коарктацией аорты, выполненной артериальным доступом:
а- аорторафия до баллонной ангиопластики, стрелками указана мембрана в области перешейка аорты;
Стентирование коарктации аорты у детей весом более 15кг
Стентирование коарктации/рекоарктации показано у детей весом более 15-20 кг. Необходимо помнить, что стентирование коарктации аорты выполняется специальными стентами, которые в дальнейшем, с ростом ребенка, можно дорасширить.
Рисунок. Стентирование коарктации аорты
А – при аортографии визуализировано сужение перешейка
КЛАПАННЫЙ СТЕНОЗ АОРТЫ У НОВОРОЖДЕННЫХ
Клапанный стеноз аорты — врожденный порок сердца, при котором отмечается срастание створок аортального клапана. Без хирургического вмешательства смертность среди новорожденных с врожденным клапанным стенозом аорты крайне высока – погибает почти 85-90% больных в течение первого месяца жизни.
Симптоматика
Новорожденные с тяжелым стенозом аорты становятся раздражительными, плохо едят, потеют во время кормления, у них затруднено дыхание, кожа приобретает неестественно бледную или сероватую окраску, мерзнут ладони рук и ступни ног, снижается объем мочи и учащается сердцебиение.
Лечение
Баллонная дилатация (расширение) клапана аорты является одним из методов лечения
Опыт ФГБУ «НМИЦССХ им. А.Н. Бакулева»
Большим опытом выполнения баллонной вальвулопластики в стране как у новорожденных и грудных детей, так и у детей старшего возраста обладает НМИЦ ССХ им. А. Н. Бакулева.
Рисунок. Этапы выполнения транслюминальной баллонной вальвулопластики клапанного стеноза аорты.
в – позиционирование баллона в проекции клапана аорты. Рентгенконтрастные метки баллона (стрелки) располагаются выше и ниже фиброзного кольца клапана аорты;
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) – врожденный порок сердца (ВПС), характеризующийся наличием сообщения (отверстия) между правым и левым предсердием, которое обуславливает существование артериовенозного сброса между ними. Риск развития ДМПП у будущего ребенка существенно выше в тех семьях, где есть родственники с ВПС. Кроме наследственной обусловленности, к возникновению ДМПП, могут приводить вирусные заболевания беременной (краснуха, ветряная оспа и др.), эндокринопатии, прием некоторых медикаментов и алкоголя во время беременности, производственные вредности, гестационные осложнения (токсикозы, угроза выкидыша и др.)
Жалобы
Одышка и сердцебиение являются наиболее частыми ранними симптомами заболевания при больших ДМПП у детей, но обычно в течение первых месяцев жизни происходят компенсация гемодинамики и регресс клинической картины. В дальнейшем у большей части детей ДМПП протекают асимптомно, пациенты жалоб не имеют. Дети нередко имеют астеническое телосложение с заметной бледностью кожных покровов.
Диагноз
ДМПП рекомендуется ставить при помощи трансторакальной эхокардиографии (ЭхоКГ) с применением режима цветного допплеровского картирования, что является основным диагностическим инструментом в постановке диагноза ДМПП, определении его размера, локализации, объема и направления шунтирования крови.
Рисунок. Различные модификации окклюдеров для закрытия дефекта межпредсердной перегородки.
Открытый артериальный проток
Открытый артериальный проток (ОАП) – сосуд, через который после рождения сохраняется патологическое сообщение между аортой и лёгочной артерией (ЛА). Комментарии: в норме ОАП обязательно присутствует у плода, но закрывается вскоре после рождения, превращаясь в артериальную связку.
Факторами риска открытого артериального протока являются преждевременные роды и недоношенность, семейный анамнез, наличие других ВПС, инфекционные и соматические заболевания беременной.
ОАП обычно встречается у недоношенных детей и крайне редко у детей, рожденных в срок.
Жалобы больных при ОАП неспецифичны. Клинические проявления зависят от величины протока и стадии гемодинамических нарушений. Течение порока варьируется от бессимптомного до крайне тяжелого. При больших размерах протока, последний проявляет себя уже с первых недель жизни признаками сердечной недостаточности, отставанием в физическом развитии. У детей раннего возраста при крике (либо натуживании) может появиться цианоз, который отчетливее выражен на нижней половине туловища, особенно на нижних конечностях. Характерно, что цианоз исчезает после прекращения нагрузки.
Диагностика
Основным методом диагностики является ультразвуковое исследование и аускультация. Аускультация выявляет характерный для порока «машинный» шум во втором-третьем межреберье слева от грудины, иррадиирующий в межлопаточное пространство и сосуды шеи.
Лечение
Рисунок. Окклюдер для закрытия открытого артериального протока.
Открытое овальное окно
Открытое овальное окно (ООО) представляет собой короткий межпредсердный канал (средняя длина 5 мм), расположенный точно на оси кровотока, поступающего из нижней полой вены. У 25-30% отсутствует полная анатомическая окклюзия, и овальное окно остаётся открытым или, точнее говоря, открываемым. Это называется ООО и, как правило, не считается отклонением, а скорее вариантом нормы. В большинстве случаев ООО остаётся бессимптомным и не проявляет себя. Наиболее очевидными проявлениями ООО являются парадоксальные артериальные эмболии, самыми серьёзными из которых являются вызванные ими инсульты.
Показания для закрытия ООО:
Мигрень (с аурой), апноэ во сне, инсульт, занятия дайвингом, высокогорный отёк лёгких ООО закрывается с помощью специальных окклюдеров. Операция проходит под местным обезболиванием, доступом через бедренную вену. По установленному катетеру проводится окклюдер, который закрывает ООО с помощью двух дисков («сэндвич»).
Рисунок. Различные устройства для закрытия открытого овального окна
Сосудистая патология
Эндоваскулярные методы лечения сосудов и вен является одной из самых интересных и быстро развивающихся специальностей медицины с неуклонным ростом количества операций. Эндоваскулярные методы лечения применяются при поражении всех магистральных сосудов и вен (сонны, почечных, подключичных артерий, сосудов нижних конечностей).
Сосудистая патология
Рентгенэндоваскулярные методы диагностики и лечения занимают лидирующие позиции при лечении сосудистой патологии, и их доля с каждым годом неуклонно растет. Наиболее активно данные методы используются при патологии сонных, брахиоцефальных, почечных артерий, сосудов нижних конечностей.
Стентирование внутренней сонной артерии
Согласно данным американской кардиологической ассоциации (AHA/ASA) ежегодно в США регистрируется приблизительно 6,5 миллионов случаев инсультов. Около 20% всех ишемических инсультов возникает вследствие атеросклеротического стеноза сонных артерий, обычно расположенных в области их деления на наружную и внутреннюю артерии. Атеросклероз ВСА является одной из основных патологий ВСА, которая представляет угрозу развития инсульта головного мозга вследствие закупорки сосудов головного мозга, с последующей инвалидизацией или приводящая к летальному исходу.
При нарушении проходимости возникают следующие проявления: