сульфитредуцирующие клостридии что это такое
Клостридии вызывают острые кишечные инфекции.
Бактерии рода Клостридий вырабатывают наиболее сильные из известных ядов – ботулотоксин, тетаноспазмин и другие.
Клостридии – бактерии в составе постоянной собсвтенной микрофлоры кишечника. Растут строго без доступа воздуха и их очень трудно идентифицировать.
В организме человека клостридии являются стимуляторами Т-регуляторных клеток, которые снижают аллергическую настроенность организма. Один из клостридиальных метаболитов – бутират –защищает нас через интерлейкин 10. к
Кроме того, клостридии учавствуют в обмене липидов, в обмене желчных кислот и их частичном выведении из организма, подавляют рост и развитие в ЖКТ болезнетворных бактерий, расщепляют до молекулярного состояния белки.
В кишечнике новорожденных детей клостридии появляются к 6-7 дню жизни.
У детей на грудном вскармливании уровень клостридий держится в норме.
У детей при раннем введении смешанного или искусственного вскармливании клостридий превышает норму.
Анализ на дисбактериоз
Количество клостридий у взрослых:
Повышенное содержание клостридий часто наблюдается у людей старшего возраста на фоне физиологического снижения бифидобактерий.
Также повышенное содержание мясных продуктов в диете может спровоцировать рост клостридий с превышением естественной нормы.
При дисбактериозах надо регулировать эубактерии, клостридии, бифидо- и лактобактерии.
Лечшими препаратами для коррекции микрофлоры в сторону нормы являются жидкие синбиотики бифидум баг и трилакт. В них запредельное количество живых бактерий плюс жидкая среда в качестве пребиотика.
Живые культуры бифидо- и лактобактерий вместе с частью культуральной среды работают как биокатализаторы, стимулирующие восстановление кишечного гомеостаза в сторону нормы.
Людям старшего возраста необходимо 2 раза в год проводить профилактические курсы бифидум баг+трилакт для восстановления бифидобактерий, латофлоры, клостридий и др. А также регулярно употреблять в пищу кисломолочные продукты.
Трилакт и Бифидум БАГ – это безопасная микробиологическая профилактика и терапия дисбиотических нарушений ЖКТ.
Клостридии
СТАЙЛАБ предлагает комплексные тест-системы для анализа клостридий в пищевых продуктах и продовольственном сырье методом ПЦР.
Клостридии – это анаэробные спорообразующие грамположительные бактерии. Они способны жить и размножаться только в отсутствие кислорода. Некоторые из этих бактерий входят в состав нормальной микрофлоры кишечника человека и животных, другие обитают в почве. Клостридии используются для производства спиртов и органических кислот.
Среди патогенных клостридий – возбудители таких заболеваний, как газовая гангрена, столбняк, ботулизм, псевдомембранозные колиты, некротические энтериты. Белковые токсины клостридий – ботулотоксины, тетаноспазмин (тетанотоксин, столбнячный токсин) и ε-токсин относятся к сильнейшим ядам органического происхождения, известным в настоящее время. В пищевых продуктах чаще всего встречаются два представителя клостридий: Clostridium botulinum и Clostridium perfringens.
Clostridium botulinum – это подвижная палочковидная бактерия, обитающая в иле и почве, иногда в организмах рыб. Она не размножается в присутствии кислорода. Однако бескислородная среда консервированных продуктов позволяет Clostridium botulinum размножаться и вырабатывать ботулотоксины. Эти яды разрушаются при кипячении в течение получаса и в щелочной среде (например, в растворе пищевой соды) в течение 1 часа, но проявляют устойчивость к желудочному соку. Наиболее токсичный из ботулотоксинов – ботулотоксин А. Его молекула имеет два связанных между собой домена. После попадания в организм одна часть молекулы превращается в канал в мембране нервной клетки. Вторая часть молекулы отделяется от первой и проникает в клетку по этому каналу, где необратимо препятствует выделению нейромедиатора ацетилхолина. Это приводит к нарушению нервной и нервно-мышечной передаче сигнала и, как следствие, расслаблению мышц. Пострадавшие умирают от остановки дыхания. Скрытый период отравления, во время которого не проявляются никакие его симптомы, зависит от дозы токсина и составляет от нескольких часов до нескольких суток. Отравление ботулотоксином не всегда приводит к смерти, однако противоядия против этого яда не существует. Лечением является симптоматическая и поддерживающая терапия в условиях больницы.
Clostridium botulinum попадает в продукты при нарушении правил их переработки, чаще всего, с землей. Заражены ей могут быть колбасные изделия, консервы из мяса, рыбы, овощей и грибов. Кроме того, иногда эта бактерия встречается в меде. Clostridium botulinum может выжить в пищеварительной системе маленьких детей (до 1 года). В этом случае она становится причиной детского ботулизма. Скрытый период заболевания длится несколько недель, после чего наступает отравление ботулотоксином. У взрослых людей со сниженным иммунитетом, после операций на брюшной полости и с некоторыми другими состояниями также может встречаться такой тип ботулизма.
Ботулизм может возникать не только у людей, но и у животных, зачастую приводя к их гибели. Помимо употребления продуктов, зараженных Clostridium botulinum, отравление ботулотоксином может наступать в результате попадания этого вещества на слизистые оболочки, роговицу глаз, в раны, а также при его вдыхании.
Ботулотоксин А используют в медицине и косметологии в качестве миорелаксанта.
Clostridium perfringens патогенна для человека и животных и является возбудителем пищевых токсикоинфекций, некротических энтеритов, а также газовой гангрены. Эти бактерии обитают в почве и воде, в том числе, в сточных водах. Они способны выживать в кишечнике человека и животных, и их присутствие не всегда приводит к заболеваниям. Clostridium perfringens типа А, в отличие от других бактерий этого вида, относительно устойчива к воздействию кислорода.
Clostridium perfringens выделяет множество ядов с некротическим и гемолитическим (вызывает разрушение клеток крови) действием. Наиболее токсичным из них является выделяемый сероварами B и D ε-токсин (эпсилон-токсин), образующий в клетках каналы, по которым из них выходят ионы калия. Это приводит к отеку различных органов, в том числе, мозга и нарушению их работы. Clostridium perfringens серовара A вызывают относительно легкие пищевые токсикоинфекции.
Clostridium perfringens нередко встречается в сыром мясе животных и птицы и консервах из него. С загрязненной водой эта бактерия может попадать в овощи и фрукты.
В Российской Федерации и странах Таможенного Союза содержание клостридий в пищевых продуктах регламентировано Техническим Регламентом Таможенного Союза ТР ТС 021/2011 «О безопасности пищевой продукции», ТР ТС 034/2013 «О безопасности мяса и мясной продукции» и другими законодательными документами. С актуальной информацией можно ознакомиться на сайте compact24.com
Микробиологические методы анализа клостридий и других анаэробов довольно трудоемки: в присутствии кислорода эти организмы не размножаются, потому необходимо создать им бескислородные условия. Для этого используют различные подходы: культивирование в жидких средах в специальных высоких пробирках или посев внутрь столбика агара, замена воздуха в пробирке углекислым газом, добавка в среды веществ, поглощающих кислород, запаивание пробирок, культивирование под вазелиновым маслом и др. После выделения культуры микроорганизма необходимо определить его биологическими методами, оценив биохимические свойства бактерий или иным методом. Определение ДНК с помощью ПЦР является самым точным способом определения микроорганизма.
Сульфитредуцирующие клостридии в воде
Сульфитредуцирующие клостридии представляют собой грамположительные спорообразующие палочки крупного размера. Микроорганизмы данной группы отличаются способностью восстанавливать сульфиты до сульфидов. Данное свойство активно применяется при их определении в лабораторных условиях.
Учитывая, что умением редуцировать сульфиты отличаются только споровые анаэробы, имеющие кишечное происхождение, данная их особенность позволила отнести представленную группу микроорганизмов к санитарно-показательным. При этом самым распространенным представителем сульфитредуцирующих клостридий является Clostridium perfringens.
Данный микроорганизм относится к постоянным консорбентам кишечного тракта, но при этом имеет меньшую численность, чем более распространенный род E. coli. Споры СРК отличаются высокой устойчивостью к воздействиям окружающей среды. С учетом данной особенности, при обнаружении бактерий можно судить о давнем фекальном загрязнении воды.
О роли сульфитредуцирующих бактерий как индикаторах загрязнения
Если предметно говорить о ценности спор СРК как индикатора фекального загрязнения, то она довольно невысока. Связано это с тем, что данные грамположительные микроорганизмы отличаются умением размножаться в окружающей среде при благоприятных условиях. Это означает, что они могут долгое время находиться в жидкости, усложняя тем самым интерпретацию результатов исследований. Это также касается и воды, хотя наиболее интенсивный рост наблюдается в почве.
Однако это не значит, что от таких бактерий нет пользы вообще. Сульфитредуцирующие клостридии могут выступать в роли важного индикатора оценки качества обеззараживания воды, так как отличаются устойчивостью к агрессивным воздействиям не только внешней среды, но и дезинфицирующих средств и стерилизующих приемов. Микроорганизмы данной группы являются первыми, пробивающими барьер, который может появляться при дефектах в работе систем обеззараживания.
Также бактерии могут относиться к определителям биологического загрязнения воды. В частности, их обнаружение во взятом образце может свидетельствовать о возможном присутствии цист и ооцист простейших яиц гельминтов, которые имеют схожесть по уровню устойчивости.
Особенности учета спор СРК в Российской Федерации
В РФ количественный учет грамположительных спорообразующих бактерий ведется в случае проведения санитарных исследований воды в открытых водоемах, а также при контроле качества водоподготовки. В данном случае анализ проб на споры СРК выполняется с применением среды Вильсон-Блера. В других случаях потребуется непосредственное обращение в сертифицированную лабораторию для заказа услуги отбора проб и проведения необходимых анализов в самом испытательном центре.
Определение сульфитредуцирующих бактерий в воде
В наши дни для определения и учета сульфитредуцирующих бактерий в пробах воды задействуются высокочувствительные и высокоспецифичные среды, в которых находятся соли тиогликолевой кислоты, а также добавки различных антибиотиков. Использование солей позволяет добиться более высокой степени анаэробиоза, за счет чего увеличивается чувствительность метода и точность получаемого результата.
Микробиологический анализ воды
Также для оценки качества работы водоочистных систем может проводиться микробиологический анализ на наличие данного вида спор. В рамках исследования используется особый метод, направленный на выращивание посевов в железно-сульфитном агаре – для этого создаются условия, близкие к анаэробным – а также подсчет количества колоний черного цвета.
При осуществлении анализа проба воды, помещенная в пробирки, прогревается на водяной бане при температуре 75 градусов с погрешностью +/- 5 градусов. Процедура выполняется на протяжении 15 минут. Если исследуется хлорированная вода, прогрев необязателен.
Определение бактерий в воде может производиться одним из трех методов – фильтрования в пробирках, в чашках Петри или прямым посевом.
Учет результатов производится на основании количественного подсчета. При этом ему подлежат только посевы, в которых получаются изолированные колонии, имеющие черный цвет. Они могут вырастать на фильтрах или в питательной среде. Результат исследования определяется числом колониеобразующих единиц в 20 мл воды. Нормальным показателем будет отсутствие микроорганизмов в данном количестве жидкости.
Анализ воды в лаборатории «НОРТЕСТ»
Испытательный центр «НОРЕСТ» предлагает услуги по анализу воды на наличие сульфитредуцирующих бактерий. Проведение данного вида исследований, как и любого другого в нашей лаборатории, имеет ряд преимуществ для клиентов:
За время работы лаборатории в достоверности и высочайшем качестве выполняемых нами исследований убедилось большое количество клиентов, которые являются как физическими, так и юридическими лицами. Проведение анализа воды на содержание СРК – это гарантия получения точных результатов в кратчайшие сроки.
Клостридия клостридии волк: С. difficile vs С. scindens
Клостридия клостридии волк: С. difficile vs С. scindens
Автор
Редактор
Тело человека населено триллионами микроорганизмов, совокупность которых называют микробиомом. Микробиом выполняет множество важных функций — от синтеза витаминов до расщепления сложных компонентов пищи. «Здоровая» микрофлора постоянно конкурирует за ограниченные питательные ресурсы с патогенными микроорганизмами, тем самым подавляя их рост. Однако из-за приема антибиотиков или других причин нормальный состав микробиома может нарушаться, и тогда патогены получают возможность размножаться неконтролируемо, вызывая болезни. Один из таких патогенов — бактерия Clostridium difficile, возбудитель псевдомембранозного колита. Борьба с С. difficile осложняется ее устойчивостью к большинству известных антибиотиков. Но недавно было показано, что рост С. difficile можно успешно подавлять не лекарствами, а при помощи родственного ему вида — С. scindens. Это открытие послужит основой для создания «умных» лекарств-пробиотиков: эффективных против С. difficile, но безопасных для полезной микрофлоры.
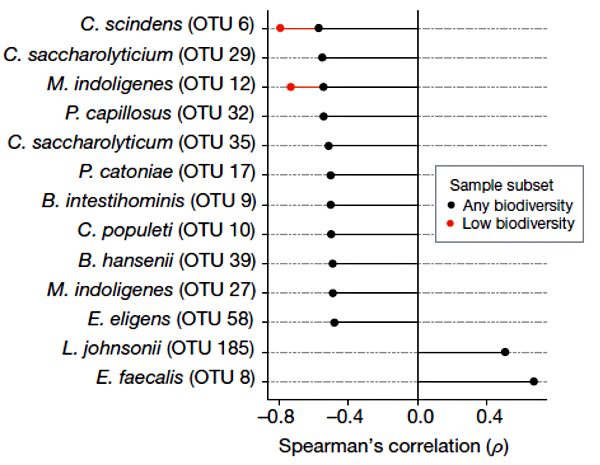
Рисунок 1. Корреляция между присутствием конкретных бактериальных таксонов в микробиоме и устойчивостью к заражению C. difficile [3].
Антибиотики эффективны в борьбе со множеством смертельных заболеваний, но вместе с тем они наносят существенный урон микробиому человека. После курса антибиотиков человек, как правило, более подвержен заражению различными патогенами. Clostridium difficile — грамположительная подвижная бактерия, основной возбудитель острых внутрибольничных кишечных инфекций. За последние 15 лет число смертельных случаев, обусловленных размножением С. difficile, возросло по меньшей мере в 10 раз, особенно среди пожилых и ослабленных людей [1]. Борьба с С. difficile осложняется тем, что при неблагоприятных условиях этот вид образует споры, выдерживающие действие антибиотиков. Такая особенность позволяет бактериям повторно колонизировать кишечник спустя несколько недель и даже месяцев после окончания лечения.
Недавно было показано, что трансплантация микробиомов здоровых доноров вылечивает тяжелые инфекции C. difficile [2]. Однако оставалось неизвестным, какие именно члены микробиома восстанавливают устойчивость организма к инфекции C. difficile и какими механизмами. И вот наконец вышла статья, которая проливает свет на довольно необычный механизм межвидовых взаимодействий в микробиоме [3].
О мышах и людях
C. difficile — не только человеческая беда, но и мышиная. Для начала микробиомы мышей пробовали травить разными антибиотиками и смотрели, как от этого меняется восприимчивость к C. difficile. В целом антибиотики не столько уменьшают суммарное число бактерий в кишечнике, сколько существенно нарушают расстановку сил — соотношение разных таксономических групп. Оказалось, что восприимчивость к C. difficile четко коррелирует с общим снижением видового разнообразия микробима. Удалось выделить горстку из 11 условных видов (операционных таксономических единиц), ассоциированных с устойчивостью к заражению C. difficile (рис. 1). Многие из них оказались тоже клостридиями (кластер Clostridium XIVa). Ученые обратили внимание на один таксон, присутствие которого сильнее всего коррелировало с резистентностью к C. difficile, даже у животных с экстремально низким видовым разнообразием микробиома. Героем оказался Clostridium scindens.
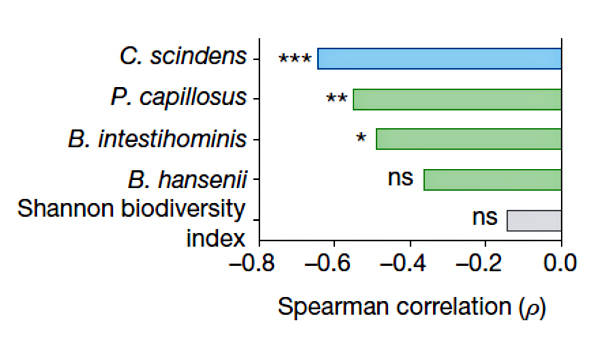
Рисунок 2. Корреляция между приживлением видов-кандидатов в микробиоме и устойчивостью к C. difficile [3].
Но то у мышей. Как же обстоят дела у человека? Для определения видов, связанных с устойчивостью к инфекции C. difficile, исследовали микробиомы пациентов, перенесших аллогеную трансплантацию гемопоэтических стволовых клеток. Большинство из них проходило химиотерапию и/или лучевую терапию одновременно с курсом антибиотиков во время трансплантации. Ослабленный иммунитет и снижение видового разнообразия микробиома делают этих пациентов легкой мишенью для C. difficile. У человека удалось найти два основных вида, с которыми не уживались C. difficile. Наиболее сильным ингибитором оказался C. scindens, как и у мышей. Как будто бы победа?
Для проверки ингибирующего эффекта C. scindens вместе с несколькими другими перспективными бактериями запустили в кишечники животных, недавно принимавших антибиотики (рис. 2). Оказалось, что такая микробная трансплантация существенно облегчила течение инфекции, вызванной C. difficile, а также положительно сказалась на снижении смертности и увеличении массы тела по сравнению с контролем. Наиболее заметную устойчивость к C. difficile обеспечивал, как и ожидалось, C. scindens. Приживление трасплантированных бактерий в микробиоме отслеживали по наличию гена соответствующей 16S рРНК. Устойчивость к C. difficile росла прямо пропорционально обилию C. scindens. То есть улучшение приживаемости C. scindens может повысить защиту против C. difficile. Примечательно, что такая аккуратная замена плохой клостридии на очень похожую, но хорошую, не нарушает существующий в микробиоме баланс (ни качественный, ни количественный). Своеобразная антидотная терапия, только на уровне микробиома. Все это открывает искрящиеся горизонты для разработки безопасных лекарств против C. difficile. Но как именно C. scindens противостоит C. difficile?
Механизм ингибирующего действия
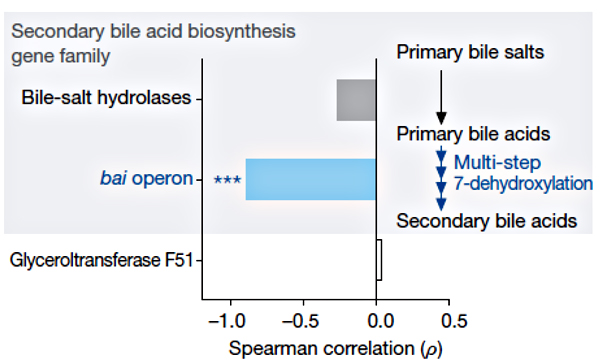
Рисунок 3. Корреляция между устойчивостью к C. difficile и наличием семейств генов, необходимых для синтеза вторичных желчных кислот [3].
Известно, что некоторые вторичные желчные кислоты могут ухудшать рост C. difficile in vitro [4]. У очень большого числа микробиомных бактерий есть ген bsh, кодирующий гидролазу желчных кислот. Однако у редкой бактерии (ужасно малой доли микробиомных организмов) есть все гены, необходимые для осуществления полного пути биосинтеза желчных кислот. Редкой бактерией, конечно же, оказалась C. scindens, обладающая критическим для синтеза вторичных желчных кислот геном 7α-гидроксистероид-дегидрогеназы (рис. 3). Именно на этой уникальной биохимической особенности и зиждется защитный механизм C. scindens против C. difficile. Внедрение C. scindens в микробиом животных, восприимчивых к C. difficile, восстанавливает необходимый уровень и соотношение вторичных желчных кислот: дезоксихолевой (DCA) и литохолевой (LCA). Обе эти кислоты подавляют рост C. difficile пропорционально своей концентрации. Примечательно, что C. scindens повышает количество вторичных желчных кислот до физиологического уровня и препятствует росту C. difficile даже у животных, прошедших курс антибиотикотерапии. Этот механизм консервативен — реализуется как в микробиоме мыши, так и в микробиоме человека.
Терапевтические перспективы
* — О черных делишках кишечных микробов-диверсантов, сокращающих пул желчных кислот и стимулирующих развитие атеросклероза, читайте в статье «Не доверяйте рекламе, или потенциальная связь метаболизма и развития атеросклероза» [6] — Ред.
Clostridium difficile
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile.
Автор: Трубачева Е.С., врач – клинический фармаколог
Разговор о клостридиях был бы неполным без самого внутрибольничного представителя оных — Clostridium difficile. К тому же сейчас самый подходящий случай о нем вспомнить, так как всевозможные схемы, в том числе и антибактериальной терапии, в лечении вирусных пневмоний, вызванных SARS-CoV-2, в перепрофилированных больницах могли еще сильнее натренировать внутрибольничную микрофлору, в состав которой и входит вышеупомянутая клостридия.
В настоящее время токсигенные штаммы C.difficile рассматриваются как однозначные возбудители внутрибольничных инфекций. То есть вызываемый ими псевдомембранозный колит является заболеванием, связанным с оказанием медицинской помощи, то есть ятрогенным. А все мы знаем, как Следственный Комитет к этому относится и, что самое главное, останавливаться не собирается (согласно последнему интервью председателя СК А. Бастрыкина). Поэтому необходимо максимально подробно разораться, как данное заболевание вызывается, что его провоцирует и как этого если не избежать, то максимально эффективно пролечить. Об этом и будет нынешний разговор.
Микробиологические аспекты
C.difficile, как и остальные клинически значимые клостридии, является строгим анаэробом. Основным поражающим фактором для нее, так же как и для остальных клостридий, являются токсины, и так же, как и другие клостридии, C.difficile умеет образовывать споры. Заболевание, вызываемое токсигенной C.difficile, именуется псевдомембранозным колитом.
Теперь отметим частности:
Эпидемиологические аспекты
Основным источником токсигенных C.difficile является либо больной, либо здоровый носитель. Путь распространения — фекально-оральный либо контактный. Так как споры C.difficile благополучно сохраняются до 180 суток, то некоторые вспышки могут происходить без видимо определяемого источника — достаточно плохо убранных туалетных помещений стационаров, а также давно или неправильно обработанных матрасов. Кроме того, если вдруг в отделении оказался бессимптомный носитель C.difficile из числа медицинского персонала, а остальные не особенно привыкли мыть руки, то эти самые споры будет разносить каждый второй сотрудник уже не отделения, а всей больницы — на руках, халатах, смартфонах, рассаживая ее по столам, перилам и клавиатурам, совершенно бессимптомно для себя, но с катастрофическими последствиями для больных.
Почему именно стационары? Потому что именно здесь используется самое большое количество антибактериальных препаратов, в том числе не всегда обоснованно, и C.difficile может получить селективное преимущество ввиду уменьшения количества бактерий-антагонистов, ранее сдерживавших ее размножение и токсиновыделение.
В каких отделениях чаще всего возможны случаи (или даже целые вспышки) псевдомебранозных колитов?
Поэтому если ваш пациент в течение недавнего прошлого оказывался по какой-либо причине в одном из таких отделений, то надо иметь в виду риск возможного носительства токсигенных C.difficile и развития ПМК в случае назначения антибиотиков.
Какие антибиотики чаще всего провоцируют рост количества тоскигенных C.difficile и развитие псевдомембранозного колита?
Проще говоря, то, что выбивает из толстой кишки основных конкурентов C.difficile, то и обеспечивает высокие риски развития ПМК. Но, помимо антибиотиков, ПМК провоцируют и цитостатические препараты, такие, как, например, препараты платины и метотрексат.
Какие пациенты подвергаются риску заражения токсигенной C.difficile и развитию ПМК? Чаще всего это изначально тяжелые пациенты с ожогами, после операций на толстом кишечнике, пациенты с почечной недостаточностью и любые пациенты, находящиеся в отделениях реанимации и интенсивной терапии. А пациенты с ВИЧ почему-то показывают статистику, аналогичную основной популяции — не больше и не меньше.
Исходя из всего сказанного, главным в деле сдерживания C.difficile является профилактика, краеугольным камнем которой стоит эпидемиологический надзор. Только тотальная чистота рук, туалетных комнат, как у пациентов, так и персонала, а также строжайшее выполнение требований СанПина, особенно в лечебных учреждениях, уже столкнувшихся с этим зверем, способна предотвратить новые случаи. Напомню, что летальность при псевдомембранозном колите — более 50%, а при развившемся токсическом мегаколоне — 100%.
Клинические аспекты
Основная проблема, связанная с C.difficile, — это ее диагностика. С одной стороны, все просто — давно есть коммерческие тест-системы, позволяющие проведение экспресс-тестов для обнаружения токсинов, с другой — ну и кто, положа руку на сердце, хоть раз в живую их видел? Автор за 15 лет работы не видела ни разу. Микробиологическая же диагностика требует наличия в лаборатории не только анаэробного анализатора, но еще и специально обученного бактериолога. И где всю эту роскошь взять? Вот и приходится практическому врачу ставить диагноз исходя из клинических проявлений, не забывая о дифдиагностике с другими возможными инфекционными заболевания толстого и тонкого кишечника (про которые мы уже написали в более ранних статьях: см. здесь, здесь и здесь). Кроме того необходимо думать о внутрибольничных кишечных инфекциях, которые тоже никто не отменял (хотя и давно не видел).
При этом нужно помнить и об антибиотик-ассоциированных диареях, ничего общего с ПМК и C.difficile не имеющими и объясняющимися исключительно фармакодинамикой назначенных препаратов. Например, диарея, связанная с приемом амоксициллина/клавуланата вызвана тем, что метаболиты оного стимулируют моторику толстой кишки, или макролиды, действующие на мотилиновые рецепторы и вызывающие точно такую же диарею. А уж когда эти два препарата назначены в комбинации, как любят делать в амбулаторной практике, то антибиотик-ассоциированная диарея не прилетит только к самым стойким пациентам. Кстати, если до сих пор не предупреждаете пациентов об этом чрезвычайно слабительном эффекте — то начинайте. Но, повторимся, к C.difficile это все не имеет совершенно никакого отношения. Почти всегда амбулаторные состояния решаются заменой препарата на что-то менее агрессивное в отношении кишечника и пересмотром сопутствующей терапии (например, там могут оказаться еще и НПВС, которые тоже способны провоцировать диарею).
Чем же диарея при инфицировании C.difficile отличается от всего остального? Четкой связью с госпитализацией и началом приема антибиотиков, особенно если пациент за пару месяцев до попадания к нам в руки побывал на госпитализации в ранее указанных отделениях. Если на третий день после назначения, например, цефтриаксона у такого пациента развилась диарея, тут же должен прозвучать тревожный звоночек. Если есть доступ к экспресс-тестам — определить наличие токсинов, если нет, то сразу отменять антибиотик. Если необходимость в антибактериальной терапии все еще существует, менять его на препарат из безопасного перечня. Бета-лактамы не назначать! Никакие! До выяснения происходящего с пациентом. За самим пациентом в это время (сутки, максимум двое) необходимо очень внимательно наблюдать и ни в коем случае не назначать никаких препаратов, снижающих моторику кишечника.
Если смена антибактериального препарата ничего в состоянии пациента не изменила, количество эпизодов диареи тоже нарастает или начинает пальпироваться напряженная толстая кишка, то речь может идти уже о псевдомембранозном колите, подтвердить который можно эндоскопическими методами, где в заключении будет указано наличие характерных псевдомембран на отдельных участках или всем протяжении толстой кишки, доступной к осмотру.
Чем и как лечить?
В чем преимущество метронидазола? Он не вызывает селекции резистентных штаммов энтерококков (об энтерококках мы рассуждали здесь), более доступен и в разы дешевле даже самого дешевого ванкомицина. При этом в связи с бесконтрольным его использованием на любой случай диареи образовал уже довольно приличный пул штаммов C.difficile, к нему устойчивых, поэтому метронидазол не стоит назначать пациентам, у которых уже наблюдались эпизоды внутрибольничных диарей, им же леченные, так как не факт, что перед вами не окажется пациент с уже перенесенным эпизодом ПМК, которому вегетативные C.difficile выбили, а споры устойчивых форм именно сейчас дождались своего часа.