Что будет если смешать кислоту и основание
Что будет если смешать кислоту и основание
Химическая реакция по определению образует новые химические вещества (называемые продуктами) из исходных химических веществ (называемых реагентами). Следует иметь в виду, что идентичность образующихся продуктов зависит от того, с какими реагентами мы начинаем. Добавление кислоты к основанию является примером химической реакции, поэтому мы должны ожидать появления новых продуктов. Несмотря на то, что у этого типа реакции есть закономерность, в конечном итоге образующиеся продукты зависят от того, какая кислота и какое основание используются.
Не простой ответ
Проблема в том, что это не так просто. Чтобы полностью ответить на этот вопрос, нам нужно быть намного более конкретным.
Отправная точка
Давайте начнем с смешивания сильной кислоты с сильным основанием. Добавление слова «сильный» означает, что эти кислоты и основания полностью диссоциируют (или распадаются) при попадании в воду. Использование сильной кислоты в эксперименте означает, что кислота уже растворена в воде (и это, скорее всего, верно и для основания). Если затем добавить кислоту к основанию, продукты будут водой (в дополнение к уже имеющейся воде) и солью (которая не обязательно является «столовой солью»).
Например, смешайте сильную кислоту HNO3 (азотную кислоту) с сильным основанием KOH (гидроксид калия).
В этом примере KNO3 является солью, поэтому вода и соль образуются, как и ожидалось. Эта реакция происходит в воде, поэтому, скорее всего, соль не связана вместе, а вместо этого отделяется в воде в виде ионов.
Полное ионное уравнение
На самом деле, химики пишут так называемое полное ионное уравнение, чтобы показать, какие химические вещества диссоциируют:
Это длинное уравнение показывает, что сильная кислота и сильное основание диссоциируют в воде («aq» означает водный), и образуется вода, оставляя ионы калия (K +) и нитрата (NO3-) в воде.
Чистое ионное уравнение
Это приводит к еще одному интересному вопросу: как образуется соль? В этом случае это не так. Ионы, которые образовали бы соль, есть, но в существующей форме они не образовали соль. Итак, химики пишут то, что называется уравнением чистой ионы, чтобы показать, что действительно произошло:
Слабые кислоты, слабые основания и газообразование
Что если кислота или основание (или оба) не являются «сильными»? Есть много слабых кислот и оснований, что означает, что они очень мало диссоциируют при смешивании с водой. Проще говоря, нейтрализация все же происходит (образуя воду и соль), но если мы пойдем дальше этого простого утверждения, мы обнаружим, что полные ионные и суммарные ионные уравнения очень отличаются от реакции сильной кислоты / сильного основания.
Есть еще одно осложнение: что, если кислоту смешать с чем-то вроде NaHCO3? Рассмотрим известную реакцию, которая происходит, когда вы смешиваете пищевую соду (NaHCO3) с кислым уксусом. Газ образуется. Нейтрализация происходит, но продукты перестают быть только водой и солью.
Посмотрите на соляную кислоту и пищевую соду, например:
Продуктами являются не только соль (NaCl) и вода (H2O), но и газ (CO2).
Заключение
Не существует простого решения проблемы того, какие продукты получают, смешивая кислоту с основанием. Конечный результат смешивания и кислоты с основанием зависит от того, какая кислота и основание используются, и сколько кислоты и основания вы используете. Сила или слабость кислоты и основания также влияет на продукты реакции. В целом, эти реакции приводят к образованию соли плюс вода, а иногда и газ.
Кислоты и щёлочи

И получается такое вещество, которое не относится ни к кислотам, ни к щелочам. Оно не способно вызывать ожоги. Но это будет только при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи — это как две противоположности. Но они очень важны при изготовлении таких вещей как: удобрения, пластик, мыла, моющие средства, красок, бумаги и даже взрывчаток. Это далеко не весь список.
Что такое кислота
Кислота — это и есть что-то кислое, оно характеризуется кислым вкусом. Кислота содержится в уксусе – уксусная кислота, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п. Но это всё так называемые слабые кислоты, помимо них существуют кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они гораздо опаснее для человека и пробовать их не рекомендуется никому. Они способны разъесть одежду, кожу, вызвать тяжёлый ожог на коже, разъесть бетон и другие вещества. Например, соляная кислота нам нужна для того, чтобы желудок быстрее переваривал пищу, а также для уничтожения большинства вредных бактерий, которые приходят вместе с пищей.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Кислоты и щёлочи – отличия
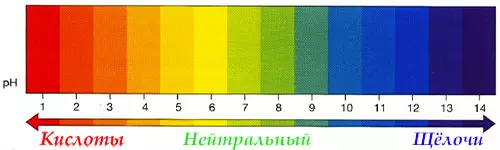
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 — это все кислоты, а больше 7 — это щёлочи.
pH продуктов
Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, в то время как работа с другими предполагает строгие меры безопасности.
Сильные кислоты — это те, которые полностью диссоциируют или ионизируются в водных растворах.
Один из способов визуализировать, как отличить слабые и сильные кислоты, по аналогии с игроками в регби:
Примеры сильных кислот
Среди известных сильных кислот выделяют:
Примеры слабых кислот
Обычно кислоты органических соединений известны как слабые:
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
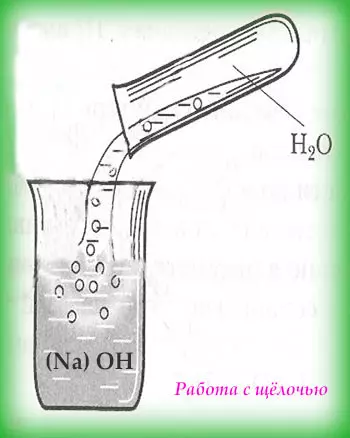
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.1.2. рН смеси растворов двух слабых кислот или оснований
Пусть кислота А1 сильнее, чем кислота А2, тогда основание В2 сильнее, чем основание В1, то есть в растворах до их сливания рН1 > pK2.
Система в состоянии равновесия описывается уравнением (9). Обратим внимание на то, что в этом состоянии [B1] = [A2], а [A1]= [B2]. В ходе установления равновесия рН1 и рН2 сравняются и установится новое значение рН раствора, которое можно найти путем суммирования выражений рН1 и рН2 отдельных кислотно-основных пар, учитывая, что к моменту достижения равновесия в системе рН1=рН2=рН:
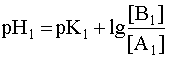
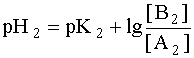
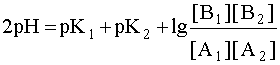
Поскольку дробь под знаком логарифма равна единице, то окончательно имеем:
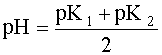
Полученное выражение позволяет сделать весьма важный вывод:
если в водном растворе сосуществуют две сопряженные кислотно-основные пары, то рН такого раствора не зависит от исходных концентраций содержащихся в нем форм, а зависит только от констант кислотности сосуществующих пар.
Данный вывод позволяет рассчитать рН растворов в некоторых особых случаях, что можно пояснить с помощью следующих примеров.
1. рН раствора соли слабого основания и слабой кислоты. Классическим примером такой соли является ацетат аммония NH4CH3COO. В водном растворе эта соль, будучи хорошо растворимой, существует в виде своих ионов:
С другой стороны, эти ионы в водной среде входят в состав сопряженных кислотно-основных пар, каждая из которых характеризуется своей константой кислотности:
NH4 + + H2O D NH3 + H3O + ; 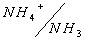
CH3COO –– + H2O D CH3COOH + OH – ; 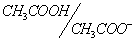
Таким образом, рассмотренный случай является типичным примером сочетания двух кислотно-основных пар и поэтому рН раствора равен
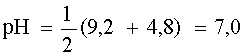
2. Смесь соли с кислотой (основанием). Если имеется эквимолярная смесь соли, образованной сильным основанием и слабой кислотой, с другой слабой кислотой; или соли, образованной слабым основанием и сильной кислотой с другим слабым основанием, то это тоже случай сочетания двух кислотно-основных пар, к которому применимо соотношение (10).
В качестве примера можно взять эквимолярную смесь NaF и CH3COOH. Здесь взаимодействуют между собой кислотно-основные пары 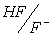
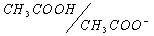
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Сильные и слабые кислоты и основания
Сильные кислоты
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
Слабые основания
Список слабых оснований
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Слабое основание и слабая кислота
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Способы определения pH
Инструментальный метод
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
Счет на секунды: что делать при ожоге серной кислотой в первую очередь
Врач рассказал о правилах первой помощи при ожогах серной кислотой
Фото, видео: Depositphotos / belchonock; 5-tv.ru
Эксперт назвал основные правила, следуя которым, можно снизить фактор поражения и облегчить состояние пациента до приезда медиков.
Химические ожоги от воздействия серной кислоты могут привести к фатальным последствиям для организма. Для того, чтобы облегчить состояние пострадавшего и не усугубить факторы поражения, необходимо действовать четко и в соответствии с основными правилами.
Как рассказал в беседе с 5-tv.ru директор Национального совета по первой помощи Станислав Манеров, их не много, и они достаточно простые, поэтому важно о них помнить.
Тем, кто оказался рядом с пострадавшим от воздействия серной кислоты, нужно осень быстро найти поблизости большое количество простой воды.
Между тем, ранее стали известны подробности шокирующего происшествия в Петербурге, где 24-летний мужчина, предположительно, из ревности облил серной кислотой девушку, к которой питал романтические чувства, и ее молодого человека.
В результате трагедии больше всего пострадала девушка. По словам ее спутника, который вызвал скорую помощь, все время до приезда медиков она страшно кричала от боли, а он даже знал, чем ей помочь и не мог даже дотронуться до нее.
Страшная трагедия разыгралась в центре Северной столицы вечером 10 декабря. По версии следствия, 24-летний мужчина облил серной кислотой свою бывшую возлюбленную и ее парня. Молодой человек не получил серьезного поражения, а вот его 16-летняя спутница испытала страшные мучения. Девушку экстренно госпитализировали с химическим ожогом лица, волосистой части головы, шеи, туловища и рук III степени.
Кроме того, бедняжка не успела даже спрятать глаза. Медики установили ожог роговиц и коньюктив II степени. По данному факту возбуждено уголовное дело по статье о причинении вреда здоровью средней степени тяжести.
Сегодня Октябрьский районный суд Петербурга вынес решение об аресте для нападавшего. Он останется за решеткой до 8 января 2022 года.