Что будет если смешать кислоту и щелочь
Кислоты и щёлочи

И получается такое вещество, которое не относится ни к кислотам, ни к щелочам. Оно не способно вызывать ожоги. Но это будет только при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи — это как две противоположности. Но они очень важны при изготовлении таких вещей как: удобрения, пластик, мыла, моющие средства, красок, бумаги и даже взрывчаток. Это далеко не весь список.
Что такое кислота
Кислота — это и есть что-то кислое, оно характеризуется кислым вкусом. Кислота содержится в уксусе – уксусная кислота, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п. Но это всё так называемые слабые кислоты, помимо них существуют кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они гораздо опаснее для человека и пробовать их не рекомендуется никому. Они способны разъесть одежду, кожу, вызвать тяжёлый ожог на коже, разъесть бетон и другие вещества. Например, соляная кислота нам нужна для того, чтобы желудок быстрее переваривал пищу, а также для уничтожения большинства вредных бактерий, которые приходят вместе с пищей.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Кислоты и щёлочи – отличия
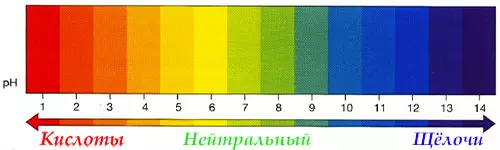
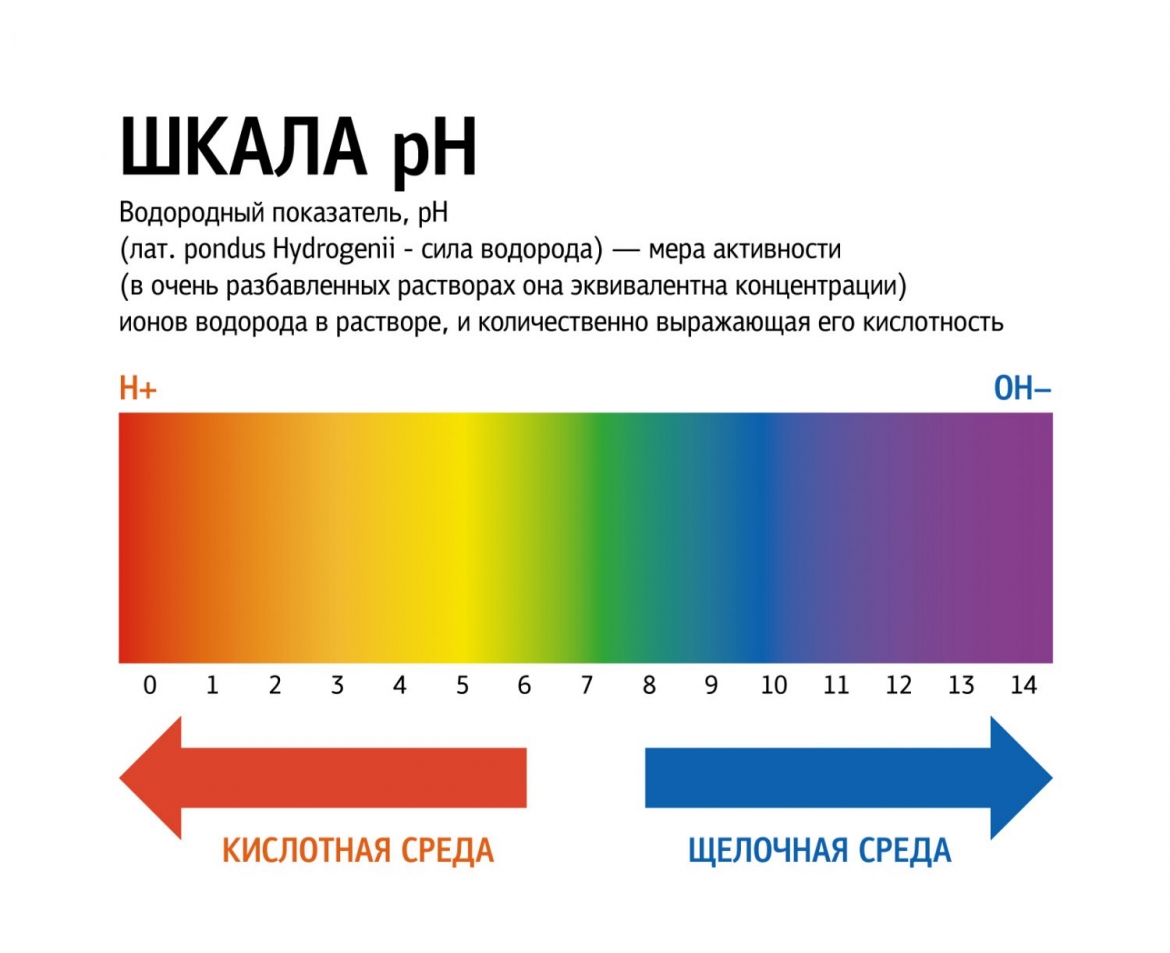
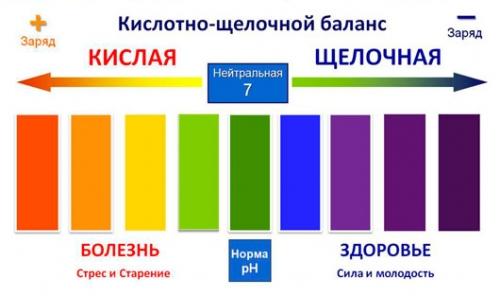
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 — это все кислоты, а больше 7 — это щёлочи.
pH продуктов
Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, в то время как работа с другими предполагает строгие меры безопасности.
Сильные кислоты — это те, которые полностью диссоциируют или ионизируются в водных растворах.
Один из способов визуализировать, как отличить слабые и сильные кислоты, по аналогии с игроками в регби:
Примеры сильных кислот
Среди известных сильных кислот выделяют:
Примеры слабых кислот
Обычно кислоты органических соединений известны как слабые:
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.
Гидроксиды
Автор текста Анисимова Е.С. Из курса лекций по биохимии
1. Элемент + О = оксид.
(Кроме фтора – его соединения с О называются не оксидами фтора, а фторидами кислорода).
В оксидах СО кислорода равна минус 2. А если СО (-1), то это пероксид. Бывают и надпероксиды.
2. Оксид (солеобразующий) + вода = гидроксид (гидрат)
Гидроксид – не синоним основания! Если оксид не превращается в гидроксид – его называют несолеобразующим или безразличным.
3. Гидроксид (кислотный) + гидроксид (основный) = соль. Это реакция нейтрализации.
4. Оксид + оксид = соль.
Если характер оксидов разный: один кислотный, а другой – основный.
5. Оксид + гидроксид = соль.
Если характер оксида и гидроксида разный: один кислотный, а другой основный.
6. ОснОвными являются оксиды и гидроксиды металлов 1 и 2 группы
и д-элементов в низких СО (хром +2).
7. Кислотными являются оксиды и гидроксиды неметаллов
и д-элементов в высоких степенях окисления (хром +6).
8. Остальные оксиды и гидроксиды могут быть и кислотами, и основаниями,
то есть являются амфотерными (двойственными) соединениями.
Они реагируют как кислоты с основаниями (или основными оксидами)
и как основания с кислотами (или кислотными оксидами).
9. Амфотерными являются оксиды и гидроксиды элементов
на границе металлов и неметаллов: Al, Zn, Fe, Pb, а также д-элементов в средних СО (хром +3).
10. Неметаллами считаются элементы от бора до астата. (по диагонали)
11. Элементы от бора и по диагонали до астата,
а также элементы справа от них (кроме благородных газов 8 группы) – неметаллы.
12. Элементы 1 и 2 группы – металлы. Но Ве слабый металл, отличается от других.
13. Al, Zn, Fe, Pb часто проявляют свойства и металлов, и неметаллов.
То есть они имеют двойственные свойства – являются амфотерными элементами.
Это значит, что их оксиды и гидроксиды реагируют с основаниями как кислотные,
а с кислотами – как оснОвные.
14. Остальные элементы – переходные (д) элементы с переменными степенями окисления (СО):
— в низких СО они ведут себя как металлы
(дают основные оксиды и гидроксиды),
— в высоких СО – как неметаллы
(дают кислотные оксиды и гидроксиды),
— а в средних СО – как амфотерные
(дают оксиды и гидроксиды, которые с кислотами реагируют как основные,
а с основаниями – как кислотные).
15. Неметаллы + О = кислотные оксиды.
16. Кислотные оксиды + вода = гидроксиды-кислоты.
17. Металлы + О = основные оксиды.
18. Основные оксиды + вода = гидроксиды-основания.
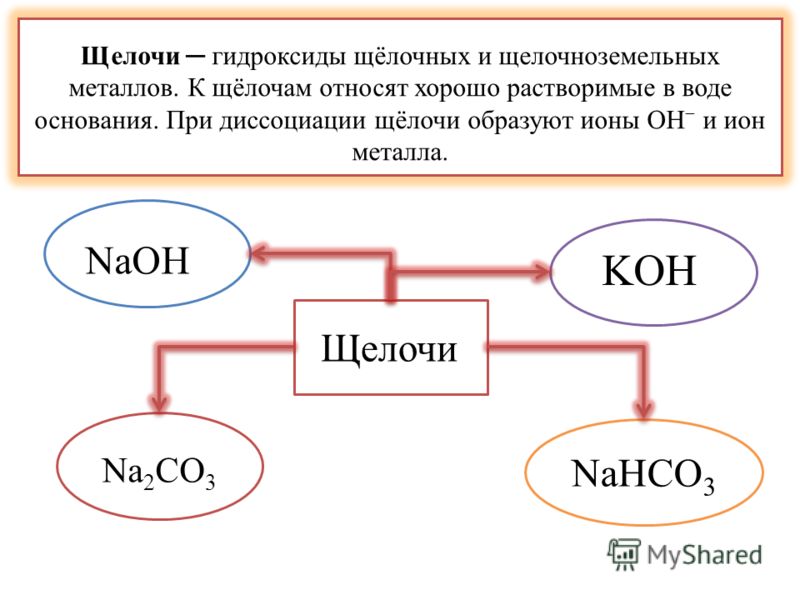
19. Если основание растворимо в воде – это щёлочь.
20. Щелочами являются гидроксиды активных металлов – 1 и 2 группы (от натрия и ниже, от кальция и ниже).
21. Гидроксиды оксидов неметаллов содержат атомы О – поэтому такие кислоты являются кислород-содержащими. Пример – серная кислота.
22. Если в кислоте нет атомов О – это бескислородная кислота. Пример – соляная кислота НCl
23. Если оксид не соединяется с водой, не даёт гидроксидов и солей – это несолеобразующий (безразличный) оксид. Примеры – СО, NO.
24. Оксиды неметаллов (кроме благородных газов) дают кислотные оксиды и кислотные гидроксиды (кислоты). И несолеобразующие оксиды.
25. Оксиды металлов дают оснОвные оксиды и осОвные гидроксиды (основания).
26. Соединение кислотного оксида и основного оксида даёт соль:
соединение металла, неметалла и кислорода.
27. Реакция кислоты и основания тоже даёт соль (и воду). Это реакция нейтрализации.
28. Основный оксид + кислота = соль.
29. Кислотный оксид + основание = соль.
30. Металл + неметалл = соль. Кальций и хлор – хлорид кальция.
31. В кислотах атомы Н пишут в начале, а атомы О в конце: HClO.
32. В основаниях атомы ОН пишут после металла: КОН.
33. Часть молекулы кислоты без атомов Н называют кислотным остатком.
34. Часть молекулы щёлочи без ОН-аниона – это катион металла.
Среда и рН
35. От (растворимых) кислот могут отделяться ядра атомов водорода (обозначаются как Н+ и называются протонами или ионами водорода) и переходить в раствор.
36. От (растворимых) оснований (щелочей) могут отделяться ОН-атомы с электроном (обозначаются как ОН– и называются гидроксильными анионами).
37. В растворах без кислот и щелочей содержание протонов и гидроксильных анионов равное, а среда считается нейтральной.
38. В растворах кислот есть избыток протонов: это называют кислой реакцией раствора.
39. В растворах щелочей есть избыток ОН–: это называют щелочной реакцией.
40. При смешивании кислоты и щелочи в нужных количествах содержание протонов и гидроксильных ионов равное, а среда нейтральная.
41. Среда выражается в показателе рН (водородный показатель).
42. В кислой среде рН меньше 7.
43. В щелочной среде рН больше 7.
44. В нейтральной среде рН равен 7.
Соли
45. Напоминание. Щёлочи в воде распадаются на катион металла и ОН-анион.
46. Кислоты в воде (растворимые) распадаются на протон и кислотный анион.
47. При смешении в воде кислоты и основания образуется смесь из катиона металла, кислотного остатка, протона и ОН-аниона.
48. Протон и ОН-анион соединяются, образуя НОН (воду).
49. Катион металла и кислотный анион при соединении между собой образуют соль.
50. Образование соли и воды при реакции между кислотой и основанием называется реакцией нейтрализации.
51. Соли, образованные и состоящие только из катиона металла и кислотного аниона, называют средними.
52. Соли (средние, растворимые) в воде распадаются (диссоциируют) на катионы металлов и кислотные анионы.
53. Если в соли есть, кроме катиона металла и кислотного аниона, ещё и Н+, то такая соль называется кислой.
54. Если в соли есть, кроме катиона металла и кислотного аниона, ещё и ОН-анион, то такая соль называется оснОвной.
55. Если в соли катионы не одного металла, а разны двух, то соль называют двойной.
56. Если в состав соли вошли два кислотных аниона – соль называют смешанной солью.
57. При растворении в воде разных кислот, солей и щелочей образуется смесь ионов, которые могут соединяться в новых сочетаниях..
58. Такие реакции, в которых происходит обмен ионами между веществами, называют реакциями ионного обмена.
59. Если в растворе есть избыток кислоты, то в состав соли могут войти протоны (Н+). Такие соли называют кислыми.
60. При растворении кислых солей в растворе появляются не только катион металла и кислотный анион, но и протоны.
61. Если в растворе кислоты и щёлочи есть избыток щёлочи, то в состав соли могут войти ОН-анионы, сделав соль оснОвной солью.
62. При растворении основных солей в растворе появляются не только катион металла и кислотный анион, но и ОН-анион.
63. Если водород кислоты заменить на атом металла – получится соль.
64. Соли можно рассматривать как продукт вытеснения водорода металлом.
65. Вытеснять водород из кислот могут только те металлы, которые стоят левее водорода в ряду напряжений металлов. То есть более активные восстановители.
66. Реакция между металлом и кислотой относится к реакциям замещения («вытеснения»).
67. При вытеснении водорода металлом из кислоты: водород выделяется в виде молекулярного водорода – Н2.
68. Металл можно «вытеснить» из соли более «сильным» металлом – то есть стоящим левее в ряду напряжений металлов (то есть более сильным восстановителем). Тогда получится другая соль.
Диссоциация
69. Некоторые соли, кислоты и щёлочи могут растворяться в воде. Они растворимые.
70. При растворении в воде кислоты, щёлочи и соли (растворимые) распадаются на ионы: катионы и анионы.
71. Распад на ионы называется диссоциацией.
72. Катионами являются ионы водорода (протоны) или ионы металлов.
73. Анионами являются гидроксильные анионы (ОН-) или кислотные остатки.
74. Кислоты в воде распадаются на ион водорода (протон) и анион кислотного остатка.
75. Основания в воде (щёлочи) распадаются на катион металла и анион ОН-.
76. Соли в воде распадаются (диссоциируют) на катион металла и анион кислотного остатка.
77. Растворы (и расплавы) кислот, солей и щелочей содержат ионы.
78. Поток заряженных частиц (электронов или ионов) называется электрическим током.
79. Из-за наличия ионов (и из-за того, что ионы имеют заряд) растворы растворимых кислот, щелочей и солей могут проводить электрический ток.
80. Растворы кислот, щёлочей и солей называют электролитами.
81. Электролитами называют вещества, растворы которых проводят электрический ток.
82. Распад молекулы кислоты на протоны и кислотный анион (отделение протонов от кислотного аниона) называют (электролитической) диссоциацией кислоты.
83. Распад молекулы щёлочи на катион металла и гидроксильный анион (отделение ОН-анионов от катиона металла) называют электролитической диссоциацией щёлочи.
84. Электролитическая диссоциация электролита – процесс обратимый.
85. Катион и анион электролита могут воссоединиться – ассоциировать.
Структура, строение и связи
86. Соли и щёлочи обычно твёрдые вещества с кристаллическим строением.
87. В узлах кристаллических решёток солей и щелочей – ионы (катионы металлов, кислотные анионы, гидроксильные анионы).
88. В узлах решёток кислот – молекулы кислот. Это вещества молекулярного строения.
89. Связи между ионами солей и щелочей – ионные.
90. Связи между атомами в молекулах кислот – ковалентные полярные.
91. Связи между молекулами кислот (узлами решёток) – водородные.
Чем отличаются кислоты от щелочей
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
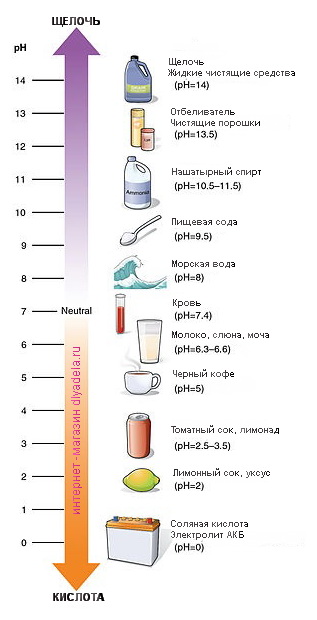
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.
Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.