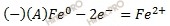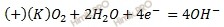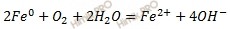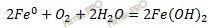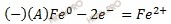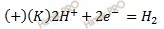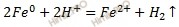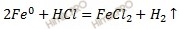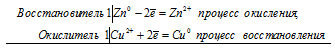Что будет окисляться на аноде при коррозии омедненного железа во влажном воздухе
Химик.ПРО – решение задач по химии бесплатно
Железное изделие покрыли никелем. Какое это покрытие анодное или катодное? Почему? Составьте электрические уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте (HCl). Какие продукты реакции получатся в первом и втором случае?
Решение задачи
1.Изделие находится во влажном воздухе, который является электропроводящей средой, следовательно, будет протекать электрохимическая коррозия.
При нарушении покрытия образуется гальванический элемент. Составим схему коррозионного гальванического элемента:
Вода – это нейтральная среда, поэтому окислителем (деполяризатором) является кислород – О2 воздуха. Следовательно, в этой схеме будет протекать электрохимическая коррозия с кислородной деполяризацией.
Никель имеет больший (-0,23 B) потенциал, чем железо (-0,44 B) (смотри таблицу электрохимических потенциалов металлов), поэтому в гальваническом элементе никель будет катодом (окислителем), железо – анодом (восстановителем).
Электроны двигаются от железа к никелю.
Запишем электронные уравнения процессов коррозии, протекающих на электродах, и составим суммарное уравнение процессов коррозии.
Составим молекулярное уравнение процесса коррозии окислительно-восстановительной реакции, протекающей при коррозии:
Вывод: коррозировать будет железо. Продуктом его коррозии является основание – гидроксид железа (II).
Ответ:
продукт процесса коррозии гидроксид железа (II).
2.Металлы находятся в кислой среде – растворе соляной кислоты (HCl). Раствор HCl – электролит, то есть электропроводящая среда, следовательно, будет протекать электрохимическая коррозия.
В данном случае среда кислая, поэтому окислителем (деполяризатором) является ион водорода (H + ). Следовательно, в этой схеме будет протекать электрохимическая коррозия с водородной деполяризацией.
Электроны двигаются от железа к никелю.
Запишем электронные уравнения процессов коррозии, протекающих на электродах, и составим суммарное уравнение процессов коррозии.
Составим молекулярное уравнение процессов коррозии окислительно-восстановительной реакции, протекающей при коррозии:
Запишем вывод: при коррозии железа, находящегося в контакте с никелем, окисляется железо. Продуктом его коррозии является соль – хлорид железа (II). На никелевом электроде выделяется водород.
Ответ:
продукты процессов коррозии хлорид железа (II), водород.
Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
2Н + + 2 
2Н + + 2 
Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Что будет окисляться на аноде при коррозии омедненного железа во влажном воздухе
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Коррозия железа
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Коррозия металлов
Ржавчина
При окислении железа промежуточным продуктом реакции является грязно-зелёный осадок гидроксида, содержащего Fe (II) и Fe (III).
Интересным, но неприятным свойством ржавчины является то, что она занимает намного больший объём, чем занимало железо. Это может вызвать катастрофические последствия: хотя с виду ржавчина кажется рыхлой и мягкой, при её росте развиваются гигантские усилия. Когда в Лондоне по проекту Кристофера Рена в 1675—1710 гг. строили грандиозный собор Святого Павла, каменные блоки колокольни для прочности соединили железными скобами, которые были уложены в желобки, выдолбленные в камне. За сотни лет скобы проржавели, увеличились в объёме и стали поднимать каменную кладку, отчего колокольню перекосило. Инженеры подсчитали: давление, развиваемое ржавчиной, настолько велико, что приподняло бы даже двухкилометровый слой камней! Пришлось разобрать кладку и вставить в желобки новые скобы из нержавеющей стали.
Скорость окисления железа (появление ржавчины) очень сильно зависит от обшей поверхности соприкосновения металла и воздуха. Так, обычный гвоздь, даже если он сильно нагрет, не скоро превращается в окалину. Мелкие опилки при сильном нагреве быстро сгорают, а при внесении в пламя — вспыхивают в виде искр. Химическим способом — восстановлением оксидов железа водородом — можно получить ещё более мелкий порошок железа; его называют пирофорным. Он вспыхивает на воздухе уже при обычной температуре. Пирофорными могут быть и многие другие металлы в мелкораздробленном состоянии, а также оксид FeO.
Известны различные виды коррозии металлов. Одним из основных её видов является химическая, которую иногда ещё называют газовой коррозия, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздействием некоторых агрессивных жидкостей. Основным этого процесса является то, что она происходит без возникновения в системе электрического тока. Ей подвергаются детали и узлы машин, работающих в атмосфере кислорода при высоких температурах, например турбинные двигатели, ракетные двигатели и некоторые другие, а также подвергаются детали узлы оборудования химического производства.
Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекания процесса. Теперь остановимся подробнее на электрохимической коррозии.
Виды коррозии
К основным видам наблюдаемой коррозии относятся:
— протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается плёнкой влаги, содержащей растворённый кислород. Интенсивность разрушения металла возрастает с ростом влажности воздуха, а также содержанием в нём газообразных оксидов углерода, серы, при наличии в металле шероховатостей, трещин облегчающих конденсацию влаги.
— её подвержены трубопроводы, кабели, подземные сооружения. В этом случае металлы соприкасаются с влагой почвы, содержащей растворённый кислород. Во влажной почве, с повышенной кислотностью трубопроводы разрушаются в течение полугода после их укладки (конечно, если не принять меры по их защите).
Электрохимическая коррозия
— наиболее распространённый видом разрушения металлов. Примером электрохимической коррозии является, например, разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. Как уже было отмечено, электрохимическая коррозия протекает на поверхности металлов под действием электрических токов, то есть происходят окислительно-восстановительные химические реакции, характеризующиеся отдачей электронов и их переносом, так как образуются катодные и анодные участки. Образованию катодов и анодов способствуют химическая неоднородность металлов (примеси и включения), наличие участков остаточной деформации, неоднородность покрывающих металл защитных плёнок и т.д. Наиболее часто в образовании данного вида разрушения металла участвуют не один фактор, а несколько. Когда метал начинает корродировать, он превращается в многоэлектронный гальванический элемент.
Что происходит: все наши гвозди будут иметь следы ржавчины (коррозии). В самом худшем состоянии будет тот гвоздь, который находился в растворе вместе с медной проволокой, а меньше всего корродировал тот, который привязан к цинку! Объяснение: все металлы обладают разной способностью отдавать электроны. Сравнить их в этой способности можно, ознакомившись с рядом напряжений металлов:
Li← K← Rb← Cs← Ba← Ca← Na← Mg← Al← Mn← Cr← Zn← Fe← Cd← Co← Ni← Sn← Pb← H2← Cu← Ag← Hg← Pt← Au
Производство оборудования для литья пластмасс: завод прессформ, см.
Заказать кованые изделия из металла с гарантией качества