Что в клетке является наиболее уязвимым для излучений
Биологическое действие ионизирующего излучения.
Тема: Биологическое действие ионизирующего излучения.
Ионизирующее излучение было открыто в 1895 году Вильгельмом Конрадом Рентгеном в Германии, который зафиксировал неизвестные ранее лучи, которые проникали сквозь тело человека. Эти лучи, однако, не были связаны с естественной радиоактивностью. Рентген получил их в электронной лампе, разгоняя поток электронов от одного электрода к другому. Это открытие вдохновило других учёных искать таинственные лучи, и в 1896 году было сделано следующее открытие: французский физик Анри Беккерель изучал минеральный образец урана и обнаружил, что он испускал лучи того же самого типа, что и лучи Рентгена. Беккерель обнаружил явление естественной радиоактивности.
Теперь поиск химических элементов, испускающих радиацию, стал более целенаправленным. В 1898 году учёные Мария и Пьер Кюри выделили два радиоактивных элемента: полоний и радий. Радий, который является высоко радиоактивным химическим элементом, скоро оказался полезным в медицине. А в то время об опасности вредного воздействия излучения на организм не было известно.
Многие из первопроходцев в области медицины и научных исследований были облучены, и в течение первых десятилетий прошлого столетия некоторые из них погибли от лучевой болезни.
В 1928 году на Международном Конгрессе по радиологии в Стокгольме была основана международная организация – сегодня известная, как Международная Комиссия по Радиационной Защите (МКРЗ). МКРЗ собирает информацию о воздействии радиации на здоровье и выпускает рекомендации по радиационной защите.
Воздействие ионизирующего излучения на вещество.
Любое вещество, поглощая энергию солнечного излучения, нагревается. Воздействие солнечного излучения на биологическую ткань приводит к биологическим эффектам (например, загар на теле человека). Так же и ионизирующее излучение воздействует различным образом на живую и неживую материю.
Тело человека поглощает энергию и находится под биологическим воздействием ионизирующего излучения. Чтобы понять, как ионизирующее излучение воздействует на нашу биологическую ткань, исследуем процесс на уровне элементов, составляющих ткань, то есть на уровне клетки.
Клетка и молекула ДНК живого организма.
Генетический материал человека состоит из 46 хромосом, составляющих 23 пары. Внутри хромосом находится молекула ДНК, которая является сложнейшей макро-молекулой. Молекула ДНК состоит их двух цепочек в форме двойной спирали, растянув которые можно получить нить длинной около 1,5 метра
Четыре базы, названные А, С, G, Т, связывают обе спирали вместе очень оригинальным способом. А в одной спирали всегда соединяется с Т в другой спирали, С всегда соединяется с G. В случае, если одна спираль повреждена, другая служит моделью для восстановления.
Деление клетки в организме.
Клетки могут разрушиться или быть повреждены вследствие каких-либо причин. Чтобы позволить тканям тела и органам поддерживать свои функции, клетка делится с образованием двух нормальных, здоровых дочерних клеток, идентичной материнской клетке, которые заменяют повреждённую клетку.
Когда клетка делится, обе цепочки каждой молекулы ДНК разделяются, каждая затем становится частью новой спирали ДНК и в результате – мы имеем две новые клетки.
Полный процесс деления занимает от двух минут до двух часов – это очень чувствительный период в жизни клетки. Повреждение ДНК во время этого процесса может привести к различным последствиям. Однако, способность клетки к восстановлению исправит большинство дефектов прежде, чем закончится образование новой клетки.
Повреждение ДНК происходит случайно, или в результате воздействия на неё ядовитых веществ, вирусов, ультрафиолетового или ионизирующего излучения.
Воздействии ионизирующего излучения на ДНК.
Некоторые клетки являются наиболее чувствительными к ионизирующему излучению, но все они чувствительны в период деления. Это означает, что растущая ткань или ткань, которая имеет высокую скорость деления клеток, более чувствительна к ионизирующему излучению, чем другие ткани. Вот почему дети, а особенно плод беременной женщины более чувствительны к излучению, чем взрослые. По той же причине клетки раковой опухоли более чувствительны к излучению, чем здоровая ткань, так как раковая опухоль растёт очень быстро за счёт частого деления раковых клеток. Эта особенность опухоли используется для лечения рака при помощи облучения раковых клеток.
Прямые и косвенные эффекты облучения.
Ионизирующее излучение может воздействовать на ДНК непосредственно или косвенно. Наши клетки состоят на 65-75% из воды. Поэтому, наиболее вероятная молекула, которая подвергается воздействию ионизирующего излучения молекула воды. Излучение ионизирует молекулы воды, приводя к образованию различных химических активных веществ. Эти вещества, которые называются свободными радикалами, могут воздействовать на молекулу ДНК. Прямое воздействие имеет менее важное значение, поскольку оно менее вероятно. Чтобы вызвать прямой эффект, ионизирующее излучение должно разрушить молекулу ДНК.
Бета- и гамма-излучения вызывают низкую плотность ионизации, поэтому вероятность повреждения обеих цепочек спирали ДНК относительно небольшая. Обычно ущерб наносится только одной цепочке или одной базе, и это повреждение может быть восстановлено относительно эффективными функциями восстановления организма. Альфа-излучение вызывает высокую плотность ионизации. При этом возникает большая вероятность разрушения обеих цепочек ДНК. Поскольку генетическая модель клетки, таким образом, разрушается, вероятна ошибка в процессе восстановления клетки, что может даже привести к гибели клетки.
Действие радиации на организм человека.
Существуют различия между последствиями радиационного воздействия, которые возникают вскоре после облучения – острые последствия – и последствиями, которые будут наблюдаться намного позже – хронические последствия.
Острые последствия облучения.
Острые последствия обусловлены большой дозой облучения тела или органа человека за короткий срок, и в большинстве случаев приводят к гибели клеток организма. При превышении порогового значения повреждения неизбежны, и они увеличиваются с увеличением дозы. Индивидуальное пороговое значение может быть разным, и это может изменить степень повреждения каждого индивидуума. Острая лучевая болезнь и повреждение плода у беременных – примеры острых повреждений организма в результате воздействия ионизирующего излучения.
Острая лучевая болезнь.
Клетки, которые являются наиболее чувствительными к воздействию радиации – клетки с высокой частотой деления. Поэтому в первую очередь ионизирующее излучение будет воздействовать на кроветворные органы (красный костный мозг), особенно чувствительные к ионизирующему излучению. Кратковременная доза облучения на всё тело более, чем 1000 мЗв (100 бэр) приведёт к острой лучевой болезни. Множество клеток и, следовательно, большие части живой ткани будут повреждены или погибнут. Функции облучённого органа будут нарушены. Последствия интенсивного облучения организма в дозах, превышающих пороговое значение, иногда проявляются уже через час или два: человек начнёт чувствовать слабость и начнётся рвота. Эти признаки обычно уменьшаются после двух дней, и в течение двух-трёх недель – самочувствие человека улучшается. Однако, за это время число белых кровяных клеток существенно уменьшится, уменьшится и сопротивление организма заразным болезням. Это может привести к воспалительным болезням с высокой температурой, диарее и кровотечениям. Если человек поправляется от острого облучения, то останется риск хронических последствий облучения.
Незамедлительное и целенаправленное квалифицированное лечение увеличивает процент выживания.
Генетические нарушения в организме.
Различают следующие виды воздействия на клетки организма вследствие облучения в зависимости от поглощённой дозы облучения и радиоустойчивости клетки:
— Без изменений – облучение не влияет на клетку
— Клетка восстанавливает молекулу ДНК
Молекула ДНК получает ложную информацию, ведущую к мутации клетки. Мутации не обязательно отрицательные, но они могут также привести к генетическим нарушениям и раковым заболеваниям.
Хронические последствия облучения.
Рак и наследственные болезни расцениваются как хронические последствия действия радиационного облучения.
Пороговое значение дозы облучения для хронических последствий отсутствует. Чем больше доза облучения, тем выше вероятность заболевания.
Клетка, у которой генетический код был изменён, может развиться в раковую клетку. Рак – болезнь, вызванная бесконтрольным делением мутирующих клеток. Примерно 20% всех смертных случаев в мире – от раковых болезней. Признаки лейкемии, вызванной ионизирующим излучением, обнаруживаются через 3-7 лет после облучения. Другие виды раковых болезней развиваются более длительное время.
Наследственные изменения в потомстве.
ДНК в половых клетках, также могут быть повреждены ионизирующим излучением. Эти повреждения могут быть переданы следующему поколению. Но для того, чтобы это случилось, дефект клеток должен быть унаследован от обоих родителей. Необходимые условия передачи генетических изменений следующему поколению:
— Хромосома в половой клетке повреждена.
— Повреждены одинаковые хромосомы в клетках отца и матери.
— Эмбрион должен развиться. Шансы эмбриона выжить уменьшаются, если клетки повреждены.
Эти условия объясняют, почему наследственные последствия нанесения вреда организму настолько трудно оценить. Вероятность каждого условия мала. Вероятность того, что все три условия выполняются одновременно – чрезвычайно мала.
Раздел 3. Биологическое действие ионизирующих излучений
Ю.А. Александров
Основы радиационной экологии
Учебное пособие. – Йошкар-Ола: Мар. гос. ун-т, 2007. – 268 с.
Раздел 3. Биологическое действие ионизирующих излучений
3.4. Молекулярные повреждения, возникающие в клетках
В результате процессов, происходящих на первичных стадиях действия излучений, изменения могут возникнуть в любых молекулярных структурах, входящих в состав живой клетки.
К наиболее биологически значимым повреждениям должны быть отнесены в первую очередь нарушения структуры ДНК. Прежде всего, это повреждения оснований, выщепление отдельных оснований из цепи, разрушение фосфоэфирных связей, лежащее в основе одиночных и двойных разрывов цепочек ДНК, распад дезоксирибозы, повреждения ДНК-мембранного комплекса, разрушение водородных связей, нарушение связей ДНК-белок, повышающее атакуемость ДНК вторичными радикалами и ферментами, сшивки ДНК-ДНК и ДНК-белок.
Аналогичные радиационно-химические изменения наблюдаются и в облученной РНК. Разница состоит лишь в том, что в РНК, в связи с ее однонитчатой структурой, не может быть двунитевых разрывов.
Не менее значимыми для жизнедеятельности клетки являются и вызванные прямым или непрямым действием радиации повреждения белка. В белковых молекулах участками, в которых чаще всего реализуется поглощенная энергия, являются тиоловые и дисульфидные группировки, а также аминокислоты, содержащие спаренные циклы (триптофан, фенилаланин, тирозин). В результате, хотя все аминокислоты поглощают энергию облучения с равной вероятностью, в конце физико-химической стадии некоторые из них оказываются избирательно пораженными.
При смертельных уровнях облучения (6-10 Гр) инактивация белков и ферментов незначительна и не обнаруживается сразу после облучения. Образующиеся в присутствии кислорода и воды свободные радикалы могут приводить к разрыву пептидной связи, образованию амида, кетокислоты и гидропе-рекисного радикала. Все это приводит к нарушению структуры белка: разрыву дисульфидных мостиков, водородных связей, пептидной цепи, образованию сшивок между пептидными цепями, отщеплению аммиака, сероводорода, окислению сульфгидрильных групп и ароматических аминокислот, к конформационным изменениям вторичной и третичной структуры белка.
В частности, возникают реакции окисления белковых SH-групп, которые нередко протекают по цепному механизму с образованием дисульфидов:
R–SH +
Кроме того, дисульфиды могут образовываться путем рекомбинации появляющихся при облучении радикалов R–S * :
или в результате взаимодействия тиолов с Н2О2:
Радиационно-химические повреждения структуры белка могут возникать и в результате реакций дезаминирования:
Радиационно-химические изменения белков, прежде всего изменения их вторичной и третичной структуры, могут привести к изменению биологических свойств, в том числе ферментативной активности.
В липидной фракции первичные изменения при воздействии ионизирующих излучений состоят в образовании свободных радикалов, которые, взаимодействуя с кислородом, являются источником возникновения перекисных соединений. Последние в свою очередь могут вступать в реакцию с жирами, в результате чего образуются гидроперекиси:
L * + 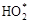
где L * – радикал липида.
Гидроперекиси очень нестойки и при наличии ионов металлов с переменной валентностью легко распадаются с образованием ряда высокоактивных радикалов:
Образовавшиеся радикалы могут дать толчок к развитию цепных реакций окисления, в том числе перекисного окисления липидов.
Перекисные соединения разрушаются в дальнейшем с образованием оксикислот, альдегидов и других продуктов окисления жиров. При облучении большими дозами радиации происходит декарбоксилирование жирных кислот и даже их распад.
Важные последствия лучевых повреждений структуры липидов проявляются в нарушении строения клеточных мембран. Вовлечение липидов мембран в процессы перекисного окисления может вызывать деструкцию липопротеидных комплексов, что служит причиной изменения проницаемости мембран, смещения ионных градиентов в клетке, нарушения процессов адсорбции и активного транспорта ряда веществ. Нарушаются также процессы окислительного фосфорилирования, нормальное течение которых обеспечивается упорядоченной локализацией ферментов на мембранах. Повреждение мембран лизосом приводит к выходу и активации гидролитических ферментов.
Продукты перекисного окисления ненасыщенных жирных кислот вследствие обнаруженных у них радиомиметических свойств (способность вызывать разрывы цепей ДНК, возникновение хромосомных аберраций, подавление репарации повреждений ДНК) получили наименование первичных или липидных радиотоксинов, и им отводится существенная роль в дальнейшем развитии лучевого поражения клетки. К первичным радиотоксинам относят также обнаруживаемые в облучаемых клетках хиноны и семихиноны – продукты окисления фенолов (по Ю.Б. Кудряшову, 2001).
Изменения структуры углеводов наблюдаются преимущественно при воздействии высоких доз ионизирующих излучений. Они сводятся к деполимеризации и окислению полисахаридов, что приводит к распаду углеводородной цепи и образованию кислоты формальдегида. Среди продуктов распада углеводов могут обнаруживаться глиоксаль и гиалуроновые кислоты. Довольно существенное значение для развития изменений в соединительнотканных структурах имеет распад мукополисахаридов, в частности, гиалуроновой кислоты.
По степени проявления морфологических изменений клетки и ткани млекопитающих, т.е. по степени возрастания радиочувствительности можно расположить в следующем порядке: нервная ткань, хрящевая и костная ткань, мышечная ткань, соединительная ткань, щитовидная железа, пищеварительные железы, легкие, кожа, слизистые оболочки, половые железы, лимфоидная ткань и костный мозг.
Действие ионизирующих излучений на клетку
Клетка – слаженная динамическая система биологически важных макромолекул, которые объединены в субклеточных образованиях, выполняющих определенные физиологические функции.
Наиболее радиочувствительными к облучению органеллами клеток млекопитающих являются ядро и митохондрии, повреждения этих образований происходят уже при малых дозах
и проявляются в самые ранние сроки. Так, при облучении митохондрий лимфатических клеток дозой 0,5 Гр и более наблюдаются угнетение процессов окислительного фосфолирования
и изменения физико-химических свойств нуклеопротеидных комплексов, происходят количественные и качественные изменения ДНК, разобщается процесс синтеза ДНК–РНК–белок. Морфологические изменения в митохондриях проявляются в форме набухания их, деструкции крист и просветления матрикса.
В ядрах радиочувствительных клеток угнетаются энергетические процессы, происходит выброс в цитоплазму ионов
натрия и калия, нарушается нормальная функция мембран. Одновременно возможны разрывы хромосом, хромосомные аберрации, точковые мутации, в результате которых образуются белки, утратившие свою нормальную биологическую активность.
Опыты Б.Л.Астаурова по пересадке ядра клеток показали, что главную ответственность в гибели клеток несет ядро. Он показал, что облучение самок тутового шелкопряда в дозе 50 кР вызывает разрушение яйцеклетки, при спаривании с необлученным самцом самка откладывает яйцеклетки с разрушенным ядром, место которых занимает ядро спермия, при слиянии ядер двух спермиев развивается особь мужского пола.
Эффект воздействия ИИ на клетки – результат комплексного воздействия взаимосвязанных и взаимообусловленных процессов. По А.М.Кузину, радиационные поражения клетки осуществляются в три этапа.
На первом этапе излучение воздействует на сложные макромолекулярные структуры, ионизируя и возбуждая их. При поглощенной дозе 10 Гр в клетке образуется до 3´10 6 ионизированных и возбужденных молекул. Поглощенная энергия может мигрировать по макромолекулам, реализуясь в SH-группах белков, хромофорных группах ДНК, ненасыщенных липидов.
Второй этап –химические преобразования. Они соответствуют процессам взаимодействия свободных радикалов с белками, липидами, нуклеиновыми кислотами и возникновению органических перекисей, которые приводят к появлению множества измененных молекул.
Третий этап –этап биохимических изменений, сопровождается высвобождением ферментов из органелл клетки вследствие повреждения их мембран органическими перекисями. Из лизосомальных образований высвобождаются гидролитические ферменты, из митохондрий и ядер – ДНКазы, РНКазы, катепсины, фосфатазы и др. Под воздействием этих ферментов происходит распад высокомолекулярных компонентов клетки, в том числе белков и нуклеиновых кислот. Таким образом, действие ничтожно малых количеств поглощенной энергии оказывается для клетки губительным из-за физического, химического
и биохимического усиления радиационного эффекта, и основную роль в развитии этого эффекта играет повреждение надмолекулярных структур, обладающих высокой радиочувствительностью.
В целом радиочувствительность клеток зависит от количества этих структур: диплоидные клетки более устойчивы или радиорезистентны,чем гаплоидные клетки (половые), уменьшение числа митохондрий повышает удельный вес поражения каждой из них, в результате чего радиочувствительность возрастает. Радиочувствительность также возрастает у клеток, для которых характерны интенсивно протекающие биохимические процессы – делящиеся, дифференцирующиеся и созревающие клетки красного костного мозга, половые клетки, клетки кишечного эпителия и роговицы глаза (в состоянии митоза), и снижается у клеток, пребывающих в стационарной фазе (профаза и пресинтетическая фаза клеточного цикла).
Следует подчеркнуть, что конечный эффект облучения также является результатом последующих процессов репарации или восстановления,так как значительная часть первичных повреждений возникает в виде потенциальных(возможных) повреждений, которые могут реализоваться в случае отсутствия восстановительных процессов и наоборот.
Таковы современные взгляды на механизм развития поражения на клеточном уровне, возникающие при радиационном воздействии на биологические объекты.
По степени проявления морфологических изменений, т.е. по степени возрастания радиочувствительности, клетки и ткани млекопитающих можно расположить в следующем порядке: нервная ткань, хрящевая и костная ткань, мышечная ткань, соединительная ткань, щитовидная железа, пищеварительные железы, легкие, кожа, слизистые оболочки, половые железы, лимфоидная ткань и костный мозг.
3.1.2.1. Генетическое воздействие
ионизирующих излучений
Мутагенное воздействие ИИ впервые установили отечественные ученые Г.А.Надсон и Г.С.Филиппов в 1925 году в опытах на дрожжах. В 1927 году это открытие было подтверждено Г.Меллером на классическом генетическом объекте – дрозофиле. ИИ способны вызывать все виды наследственных изменений – генные, хромосомные, геномные.Эти изменения носят дозозависимый характер, и современными представлениями считается, что любая дополнительная выше ПРФ доза ИИ, независимо от величины и мощности, приводит к опасности кумулятивного генетического эффекта и способна вызвать генетические изменения, поскольку биологическая репарация мутации невозможна (Дж. Коглл, 1986).
Исходы поражения зародышевых и соматических клеток при воздействии ионизирующей радиации различны. Когда поражаются зародышевые клетки, возникающие мутации (генные и хромосомные) с той или иной скоростью, зависящей от степени доминантности и от степени снижения жизнеспособности, элиминируются (выводятся) из популяции. Но многие мутации, в особенности реценсивные, благодаря генетическому дрейфу и эффекту родоначальника, могут размножаться в популяции
и приводить к увеличению числа случаев врожденных уродств, аномалий обмена веществ и т.д.
Мутационные изменения в соматических клетках могут выражаться в гибели клеток или в приобретении клеткой новых наследственных свойств, которые проявляются процессами малигнизации, преждевременного старения клеток и тканей, развитием новообразований.
Таким образом, прямое и косвенное действие ионизирующего излучения на биологические молекулы приводит к тому, что в живом организме отмечается много разных биологических эффектов, наблюдаемых после облучения, которые представлены в таблице 8.
Типы радиологических повреждений
| Тип биологической организации | Важнейшие радиационные эффекты |
| Молекулярный | Повреждение макромолекул – ферментов, РНК, ДНК, воздействие на обменные процессы |
| Субклеточный | Повреждение клеточных мембран, ядер, хромосом митохондрий и лизосом, высвобождение их ферментов |
| Клеточный | Нарушения деления клеток, их гибель и трансформация, в т.ч. злокачественная |
| Ткани, органы | Нарушения в красном костном мозге, желудочно-кишечном тракте, центральной нервной системе могут привести к радиационным повреждениям и гибели, отдаленным последствиям |
| Организм | Различные виды радиационных последствий, вплоть до летального исхода |
| Популяции | Изменение генетических характеристик вследствие генных, хромосомных мутаций у индивидуумов |
3.2. Биологическое действие ионизирующей радиации
на сельскохозяйственных животных
3.2.1. Виды и формы радиационного поражения
сельскохозяйственных животных
Если в общей радиобиологии под понятиемрадиобиологический эффектпонимают широкий круг явлений, то применительно к сельскохозяйственным животным действие ионизирующей радиации оценивается по следующим критериям: гибель животных, продолжительность жизни после облучения летальными дозами, продуктивность животных, воспроизводительная способность.
Летальные дозы облучения биологических объектов, Гр
| Вид | ЛД 50/30 | ЛД 100/30 |
| Морская свинка | 1,5-3,0 | 4,0-6,0 |
| Мышь | 4,6-7,5 | 7,0 |
| Крыса | 5,0-7,0 | 10,0 |
| Овца | 1,5-4,0 | 5,5-7,5 |
| Ягнята до 3 мес. | 1,5-3.0 | 6,0 |
| Крупный рогатый скот | 1,6-5,5 | 6,5 |
| Телята до 5 мес. | 2,0-5,5 | 8,0 |
| Свинья | 2,5-3,0 | 4,5 |
| Поросята до 2 мес. | 2,5-6,0 | — |
| Лошадь | 3,5-4,0 | 5,0-6,5 |
| Осел | 2,1-5,5 | 7,5 |
| Коза | 2,5 | — |
| Верблюд | 2,5-4,0 | 4,0-6,0 |
| Собака | 2,0-3,5 | 4,0-5,0 |
| Кошка | 5,0-7,5 | 8,0 |
| Щенки до3 мес. | 4,5-7,0 | 8,0-10,5 |
| Человек | 2,5-5,5 | 4,0-6,0 |
| Обезьяна | 2,5- 6,0 | 8,0 |
| Летучая мышь | 5,0-8,0 | 9,5 |
| Хомяк | 5,5-8,0 | — |
| Полевка | 6,0-9,0 | 9,0-10,0 |
| Суслик | 6,0-9,5 | 9,0-11,5 |
| Сурок | 8,0-10,0 | 11,0-12,0 |
| Кролик | 10,0-13,0 | 14,0 |
| Монгольская песчанка | — | 15,0-18,0 |
| Птицы, рыбы | 8,0-20,0 | — |
| Насекомые | 10,0-100,0 | — |
| Змеи | 80,0-200,0 | — |
Для реализации каждого из указанных критериев необходима соответствующая доза облучения. Дозы излучения, вызывающие гибель животных, называются летальными – ЛД.Дозу, вызывающую гибель 50 % подопытных животных, называют полулетальнойи обозначают ЛД50, а вызывающую 100 % гибель – абсолютно летальной (ЛД100).При этом принято указывать сроки наблюдения за животными после их облучения летальными дозами. Например, ЛД50/30 или ЛД100/30.Дозы облучения ниже летальных называются сублетальными.
Радиочувствительность бактерий и простейших составляет 1000-3000 Гр, а бактерий Micrococcus radiodurens, обитающих
в каналах ядерных реакторов, – до 10 6 Гр.
Радиочувствительность сельскохозяйственных культур определяется по снижению урожайности на 50 % при облучении от всходов до цветения, данные представлены в таблице 10.
Радиочувствительность основных сельскохозяйственных культур
| Сельскохозяйственные культуры | Экспозиц. доза, Р |
| Горох, озимая рожь | |
| Пшеница, ячмень, овес, подсолнечник | |
| Гречиха, просо, томаты | |
| Лен | |
| Картофель | |
| Сахарная свекла, турнепс | |
| Капуста, морковь, столовая свекла |
Действие ионизирующей радиации на растительные клетки, обусловлено ионизацией молекул, при которой образуются ионы и свободные радикалы из молекул воды, неорганических и органических соединений.
Химический этап взаимодействия энергии с веществом начинается с образования в облученных клетках активных радикалов и перекисей, энергично вступающих в химические реакции с ненарушенными молекулами других веществ клетки. Третий этап действия радиации на живую клетку – биологический.
Радиационно-химические изменения ведут к нарушению во всех частях и биологических структурах клетки – происходят изменения в молекулярных структурах ядер клеток, в хромосомном аппарате, в ДНК и РНК.
Далее следуют изменения физиологических функций клеток, повреждение ядерного аппарата, нарушение ростовых процессов, появление внешних морфологических аномалий и изменение генома, нарушается согласованный процесс ДНК–РНК–белок. Поражение ДНК обуславливает мутагенное действие радиации, хромосомные аберрации (перестройки), разрывы и другие нарушения.
Хотя клетка реагирует на излучение как единое целое, цитоплазма обладает сравнительно высокой резистентностью, а ядро проявляет высокую чувствительность даже к небольшим дозам ионизирующей радиации.
Различные хромосомные нарушения являются одной из основных причин задержки митоза и гибели клеток. Избирательность действия ИИ на различные ткани определяется законом Бергонье-Трибондо, согласно которому более радиочувствительны интенсивно делящиеся клетки (меристемные, ростковые клетки).
Очень важна способность клеток и тканей – противостоять неблагоприятным и повреждающим воздействиям ИИ, в ответ на которые включаются процессы репарации (восстановления).
Радиочувствительность разных видов и сортов растений колеблется в широких пределах.
Критические дозы облучения семян на порядок выше, чем вегетирующих травянистых растений. Для большинства вегетирующих растений критическая доза оценивается 1-5 крад, а летальная – в 5-10 крад, соответствующие дозы для облучения составляют 30-50 крад.
Радиорезистентность (радиоустойчивость) растений в разные периоды онтогенеза колеблется в значительной степени и составляет в последовательностях:
1) семена молочной спелости – восковой спелости – полной спелости – покоящиеся – возрастает;
2) семена покоящиеся – прорастающие – всходы – снижается;
3) всходы – заложение вегетативных органов – заложение оси соцветия – возрастает;
4) от заложения оси соцветия и перехода к генеративному состоянию – формированию элементов цветка – спорогенез – повышается;
5) от спорогенеза до гаметогенеза – снижается.
Снижение урожайности зерна озимых культур в зависимости от гамма-облучения в разные фазы развития представлено в таблице 11.
Зернобобовые культуры обладают наибольшей радиочувствительностью в период бутонизации.
Продовольственное и техническое качество сельскохозяйственной продукции существенно не ухудшается даже при снижении урожайности до 30-40 % от контроля (не облученных растений).
Снижение урожайности зерна озимых культур, %
| Фаза развития | Доза облучения, Р |
| Кущение | |
| Выход в трубку | |
| Колошение | |
| Цветение | |
| Молочная спелость | |
| Полная спелость |
Содержание белка и клейковины в зерне пшеницы, рассчитанное на единицу массы, не снижается.
Снижение масличности семян подсолнечника (на 8-27 %) наблюдается при облучении растений в фазы генеративного развития дозами 3-10 крад.
Аналогичная закономерность наблюдается и по выходу сахара в урожае корнеплодов.
Посевные и посадочные качества семян и клубней снижаются. При облучении картофеля до периода бутонизации и цветения клубни получаются безростковыми из-за высокой радиочувствительности промеристематических клеток, но по содержанию крахмала и по вкусовым качествам они не отличаются от обычных клубней. Данные по снижению полевой всхожести до 50 % представлены в таблице 12.
Дозы облучения, при которых семена непригодны для посева
| Культуры | Фазы развития | Доза, Р |
| Зерновые озимые | 1. Выход в трубку, колошение, цветение 2. Всходы, кущение | |
| Зерновые яровые | 1. Цветение 2. Всходы, кущение, выход в трубку, колошение | |
| Кукуруза | Выметывание метелки, цветение | |
| Горох | 1. Всходы, бутонизация, цветение 2. Созревание |
Степень радиочувствительности определяется видом и характером облучения. Источники ИИ могут находиться вне организма – в этом случае говорят о внешнем облучении организма, а воздействие ИИ от радионуклидов, поступивших и находящихся внутри организма, образует внутреннее или инкорпорированное облучение. В реальных случаях возможно сочетание внешнего и внутреннего облучения – такие варианты называются сочетанными радиационными поражениями.
Характер внешнего облучения по времени и частоте воздействия может быть различным: выделяют однократное облучение – облучение в течение короткого времени (до 4 суток), фракционированное (прерывистое) облучение, если животные подвергаются внешнему воздействию с перерывами, пролонгированное или хроническое облучение – воздействие длительное, непрерывное.
Выделяют также общее или тотальное облучение – при этом радиационному воздействию подвергается все тело животного. Может быть местное облучение – воздействие ИИ на отдельную часть организма.
3.2.2. Влияние ИИ на кровь
и кроветворные органы
Кроветворные органы являются критическими или жизненно важными органами, выходящими из строя при воздействии ионизирующей радиации в диапазоне поглощенных доз от 0,25 до 10 Гр. При такой дозе воздействия развивается костно-мозговой (кроветворный) синдром различной интенсивности – от лучевых реакций до острой лучевой болезни различной степени тяжести. Именно поражение кроветворного органа – красного костного мозга, является определяющим в развитии клинической картины радиационного поражения и исхода лучевого воздействия.
Основное назначение костного мозга – продукция зрелых, высокодифференцированных клеток крови, где костный мозг является «фабрикой», производящей клетки крови, а периферическая кровь – «службой сбыта», доставляющей органам, тканям и клеткам зрелые форменные элементы крови – лейкоциты, эритроциты, тромбоциты.
Согласно современным представлениям, родоначальницей всех клеток крови является стволовая кроветворная клетка,обладающая клоногенным свойством, при делении часть ее потомства предназначается для дифференциации в специфические (специализированные) клеточные линии, другая – используется для расселения в кроветворные органы и возобновления числа СКК. Деление и созревание (дифференциация) кроветворных клеток происходят в красном костном мозге, тимусе (вилочковой железе), селезенке, лимфатических узлах и в других скоплениях лимфоидной ткани (пейеровы бляшки в кишечнике млекопитающих, бурса или Фабрициева сумка у птиц).
В соответствии с правилом Трибондо и Бергонье, наибольшей радиочувствительностью обладают делящиеся стволовые кроветворные клетки и дифференцирующиеся в специализированные линии клетки (клоны), а зрелые клетки периферической крови более радиорезистентны. Поэтому сразу после облучения начинаются гибель стволовых кроветворных клеток и опустошение красного костного мозга, в периферической крови наблюдается снижение числа форменных элементов крови вследствие их миграции за пределы кровеносных сосудов в ткани
и органы, а также за счет их естественной гибели.
При общем облучении в пределах доз от ЛД50/30 до ЛД100/30 развивается типичный кроветворный (костномозговой) синдром, который характеризуется уменьшением числа форменных элементов крови, основной причиной которого является опустошение или аплазия (гипоплазия) костного мозга.
Изменение числа лейкоцитов является весьма характерной реакцией на лучевое поражение и носит дозозависимый фазный характер. В первые часы наблюдается кратковременное снижение их числа, а через 8 часов отмечается их увеличение на 10-15 % от исходного уровня, а к концу суток количество лейкоцитов резко снижается и удерживается на низком уровне длительное время. При больших дозах радиационного воздействия первые две фазы проявляются в слабой степени, а фаза угнетения (уменьшения) наступает раньше и выражена сильнее. Наиболее радиочувствительной клеткой крови является лимфоцит, поэтому изменения числа лимфоцитов – это более объективные показатели степени лучевого поражения организма, т.к. продолжительность жизни лимфоцитов составляет от нескольких часов до 1-2 суток.
Регистрируемое уменьшение числа лимфоцитов отмечается при облучении дозой 25-100 рад, по мере увеличения дозы лимфопенический эффект увеличивается, фазного повышения их количества не наблюдается, наибольшая лимфопения отмечается через 1-3 суток. В этот же период происходят морфологические изменения в них, нарушается соотношение малых, средних, больших форм, начинают преобладать малые лимфоциты, появляются двухъядерные клетки, зернистость и вакуолизация ядер и протоплазмы.
Изменение числа нейтрофилов. У большинства сельскохозяйственных животных нейтрофилы составляют наибольшую часть лейкоцитов (до 60-70 %). У животных после лучевого воздействия выделяют пять фаз в изменениях количества нейтрофилов.
1 фаза – фаза первоначального нейтрофилеза, наступающая
в результате быстрого выхода клеток из костного мозга.
2 фаза – фаза первого опустошения. Число нейтрофилов уменьшается до 10-20 % от исходного уровня, а в тяжелых случаях и ниже, продолжаясь до гибели животного. Появление этой фазы объясняется прекращением выхода нейтрофилов из костного мозга вследствие прекращения деления стволовых клеток и их гибели.
3 фаза – фаза абортивного подъема, максимум его отмечается на 7-17 день. В данный период количество нейтрофилов может достигнуть 70-80 % от исходного значения. К этому времени возобновляется пролиферация выживших костно-мозговых клеток.
4 фаза – фаза второго опустошения.
5 фаза – фаза восстановления, развивается медленно и характеризуется началом репопуляции (размножения) выживших стволовых кроветворных клеток.
Одновременно с фазными изменениями общего количества нейтрофилов изменяется соотношение форм клеток: в фазы подъема увеличивается процент молодых форм – юных и палочкоядерных (сдвиг влево); в периоды опустошения преобладают сегментоядерные формы (сдвиг вправо). В эти же периоды в крови появляются патологические формы – клетки с гиперсегментированными, пикнотическими, лизирующимися ядрами, с вакуолями в ядре и цитоплазме.
Изменение числа эритроцитов. Эритроциты относятся к радиорезистентным клеткам крови, продолжительность жизни сравнительно большая – 60-80 дней, поэтому при лучевом воздействии в сублетальных дозах количество их практически не изменяется, уровень гемоглобина в них не уменьшается. При воздействии летальными и полулетальными дозами отмечается уменьшение числа эритроцитов на 10-20 % на 14-21 день, особенно вследствие развития геморрагического синдрома, когда эритроциты через морфологически измененные стенки кровеносных сосудов переходят в ткани и органы. В это же время отмечаются снижение уровня гемоглобина и развитие анемии.
Изменение числа тромбоцитов. По радиочувствительности тромбоциты занимают среднее положение между эритроцитами и лейкоцитами. При облучении сублетальными дозами количество тромбоцитов остается на исходном уровне до 5-7 дня, затем оно падает до минимума на 9-15 сутки после воздействия.
В эти сроки у животных появляются кровоизлияния (геморрагии)различной степени выраженности, а при облучении в летальных дозах – геморрагический синдром. Помимо количественных изменений тромбоциты претерпевают и качественные изменения, которые и приводят к развитию геморрагического синдрома одновременно при нарушении функции других систем свертывания крови.
При лучевых воздействиях вследствие уменьшения количества тромбоцитов уменьшается также и образование тромбопластина, этому также способствует и повышение активности антикоагулянтов – гепарина, антитромбопластина. Существенным изменениям подвергается процесс образования фибрина из фибриногена, скорость образования фибрина уменьшается, хотя уровень фибриногена в сыворотке крови повышается. Поэтому
в результате изменения фибрина ухудшается ретракция (сжатие) кровяного сгустка – конечный этап формирования тромба.
Развитию геморрагического синдрома способствуют и структурные изменения стенок кровеносных сосудов – повышение их проницаемости для форменных элементов и плазмы крови.
Обычно геморрагический синдром развивается на 14-21 сутки после воздействия, проявляется в виде точечных и разлитых кровоизлияний под слизистые оболочки и кожу, появляются кровавый понос, гематурия, носовое кровотечение. Геморрагические явления нарастают паралельно тяжести заболевания и являются неблагоприятным прогностическим признаком.
3.2.3. Влияние ИИ на иммунологическую
реактивность животных