Что в переводе обозначает кислород
Значение слова «кислород»
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
КИСЛОРО’Д, а, мн. нет, м. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
кислоро́д
1. хим. химический элемент с атомным номером 8, обозначается химическим символом O
2. хим. простое вещество с молекулярной формулой O2, в обычных условиях газ без цвета и запаха ◆ В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород).
Фразеологизмы и устойчивые сочетания
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: кобылица — это что-то нейтральное, положительное или отрицательное?
Кислород
Кислоро́д / Oxygenium (Oxygen)(O), 8
3,4099 кДж/моль кДж/моль
a=5,403 b=3,429 c=5,086 β=135,53 Å
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium ). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
История открытия
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène ), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
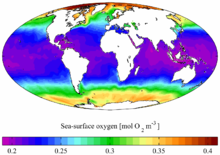
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при τ = 100 °C):
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
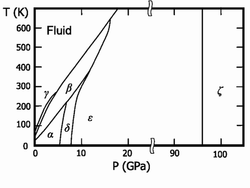
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
Ещё три фазы образуются при высоких давлениях:
Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:

Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Фториды кислорода
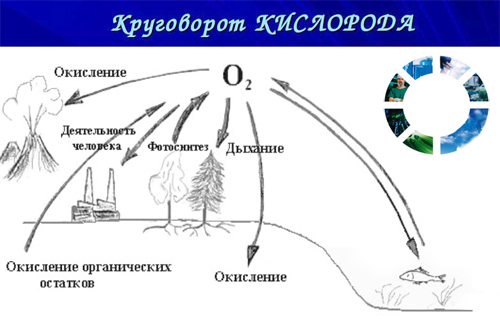
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
В пищевой промышленности
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), аммиака в окислы азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горение.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15 O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы
Кислород имеет три устойчивых изотопа: 16 О, 17 О и 18 О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16 О связано с тем, что ядро атома 16 О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода: от 12 О до 24 О. Все радиоактивные изотопы кислорода имеют малый период полураспада, а 12 O распадается за 5,8·10 −22 секунды.
Кислород (O, Oxygenium)
История кислорода
Открытие кислорода произошло дважды, во второй половине XVIII столетия с разницей в несколько лет. В 1771 году кислород получил швед Карл Шееле, нагревая селитру и серную кислоту. Полученный газ был назван «огненным воздухом». В 1774 английский химик Джозеф Пристли проводил процесс разложения оксида ртути в полностью закрытом сосуде и открыл кислород, но принял его за ингредиент воздуха. Только после того, как Пристли поделился своей находкой с французом Антуаном Лавуазье, стало понятно, что открыт новый элемент (calorizator). Пальма первенства данного открытия принадлежит Пристли потому, что Шееле опубликовал свой научный труд с описанием открытия лишь в 1777 году.
Общая характеристика кислорода
Кислород является элементом XVI группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 8 и атомную массу 15,9994. Принято обозначать кислород символом О (от латинского Oxygenium – порождающий кислоту). В русском языке название кислород стало производным от кислоты, термина, который был введён М.В. Ломоносовым.
Нахождение в природе
Кислород является самым распространённым элементом по нахождению в земной коре и Мировом океане. Соединения кислорода (в основном – силикаты) составляют не менее 47% массы земной коры, кислород вырабатывается в процессе фотосинтеза лесами и всеми зелёными растениями, большая часть приходится на фитопланктон морских и пресных вод. Кислород – обязательная составная часть любых живых клеток, также находится в большинстве веществ органического происхождения.
Физические и химические свойства
Кислород – лёгкий неметалл, состоит в группе халькогенов, имеет высокую химическую активность. Кислород, как простое вещество, представляет собой газ без цвета, запаха и вкуса, имеет жидкое состояние – светло-голубая прозрачная жидкость и твёрдое – светло-синие кристаллы. Состоит из двух атомов кислорода (обозначается формулой О₂).
Полезные свойства кислорода и его влияние на организм
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Биологическая роль кислорода
Кислород – основа основ жизнедеятельности всех живых организмов на Земле, является основным биогенным элементом. Находится в составе молекул всех важнейших веществ, которые отвечают за структуру и функции клеток (липиды, белки, углеводы, нуклеиновые кислоты). Каждый живой организм содержит гораздо больше кислорода, чем какого-либо элемента (до 70%). Для примера, организм взрослого среднестатического человека массой 70 кг содержит 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и человек) благодаря органам дыхания и поступлению воды. Помня о том, что в организме человека самый главный орган дыхания – это кожа, становится понятно, сколько кислорода может получать человек, особенно летом на берегу водоёма. Определить потребность человека в кислороде достаточно сложно, ведь она зависит от многих факторов – возраст, пол, масса и поверхность тела, система питания, внешняя среда и т.д.
Применение кислорода в жизни
Кислород применяется практически повсеместно – от металлургии до производства ракетного топлива и взрывчатых веществ, применяемых для дорожных работах в горах; от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E941, как пропеллент и упаковочный газ.
Кислород или поцелуй творца. Этимология
Что такое кислород, почему его так назвали и обозначили О2, я смотрю всё подряд в сети пользования и копирую сюда. Я уже давно забыл, чему меня учили в школе и, читать историю кислорода заново было интересно. Между делом вспоминаются детские сказки о налоге на «дышать» и другие. Они сами приходят. Не пойму пока связи между, но как только написал слово кислород, так тут же в голове возникла сказка и она мешает мне писать дальше о серьёзном.
Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2) «о два» произносится. Кислородом называют бесцветный газ, входящий в состав воздуха и различных органических кислот. Латинское — oxigenium. Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота». Вообще, вот эту oxigenium могли назвать как угодно и написать 2О, но нет. А смысл?
Дальше моя логика может разойтись с логикой читателя. Равно как иудеи не приняли Новый Завет, могут возникнуть споры о профессионализме художника Остапа Бендера. Да, ему мешало солнце, корабль качали волны, натурщик не держал позы. Высадили на берег вместе с мальчиком. Времена атеизма. Можно я вас буду называть Кисой? Турецкоподданный явно знал что такое кислород. А как вы тогда жили все это время без этого знания? Ну ладно! А что мешает знать сейчас. Его история получилась просто oxyg;нная (в смысле логики), а вы спрашиваете, откуда пошёл греческий язык?
Час назад я ещё не знал о чём буду писать сегодня. Просто проснулся и вздохнул. И так каждый день. Сегодня день Параскавеи Пятницы, славянской богини Макошь, а на неё наложили день милиции. Чтоб не сбежала. Ах, уже полиции? Не успеваешь за всем. Наверное, покажут красивое кино и будет праздничный концерт.
кислород
Полезное
Смотреть что такое «кислород» в других словарях:
КИСЛОРОД — ( Охуgenum ). Бесцветный газ без запаха и вкуса. Мало растворим в воде (приблизительно 1:43). Ингаляциями кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких … Словарь медицинских препаратов
КИСЛОРОД — (Oxygenium), О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994; газ, tкип 182,962шC. Кислород наиболее распространенный элемент, в атмосфере 23,10% по массе свободного кислорода, в гидросфере и… … Современная энциклопедия
КИСЛОРОД — (лат. Oxygenium) О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций О2 ( обычный кислород) и О3 (озон). О2 газ без цвета и запаха, плотность 1,42897… … Большой Энциклопедический словарь
КИСЛОРОД — КИСЛОРОД, самый легкий элемент VI группы периодической системы Менделеева, симв. О, порядковый номер 8. К. газ без цвета, запаха и вкуса. Изотопов не имеет. Ат. в. 16,000, мол. в. 32,000. Уд. в. К. по отношению к воздуху 1,10535; при 0° и 760 … Большая медицинская энциклопедия
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (символ О), обычно газообразный химический элемент, необходимый для ДЫХАНИЯ растений и животных и для горения. Был открыт в 1774 г. Джозефом ПРИСТЛИ и независимо от него Карлом ШЕЕЛЕ (около 1772 г.). Газ без вкуса и запаха, являющийся самым… … Научно-технический энциклопедический словарь
КИСЛОРОД — (Oxygenium), O, хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса 15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16 О(99,762%),17 О (0,038%) и 18O (0,200%). Ядра атомов 16 О содержат 8 протонов и 8… … Физическая энциклопедия
кислород — халькоген, органоген, озон, оксиген Словарь русских синонимов. кислород сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
КИСЛОРОД — КИСЛОРОД, кислорода, мн. нет, муж. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КИСЛОРОД — КИСЛОРОД, а ( у), муж. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения. | прил. кислородный, ая, ое. Кислородное голодание, кислородная недостаточность (пониженное содержание кислорода в организме; … Толковый словарь Ожегова
КИСЛОРОД — самый распространенный в природе элемент, представляющий собой газ без цвета, запаха и вкуса. Встречается в соединении с водородом (вода), с разными металлами и металлоидами, в минералах и горных породах и в свободном состоянии в воздухе. Для… … Технический железнодорожный словарь