что значит цельная кровь с эдта
Что значит цельная кровь с эдта
Клинический анализ крови – лабораторное исследование с оценкой количественных и качественных характеристик всех классов форменных элементов крови, включающее цитологическое исследование мазка периферической крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Общий анализ крови (ОАК), гемограмма, КАК, развернутый анализ крови.
Complete Blood Count (CBC), Hemogram, CBC with White Blood Cell Differential Count, Peripheral Blood Smear, Blood Film Examination.
Какой биоматериал можно использовать для исследования?
Венозная кровь, капиллярная кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Клинический анализ крови выполняется для диагностики количественных и качественных изменений форменных элементов – клеток крови: эритроцитов, лейкоцитов и тромбоцитов. Их изменения могут быть обусловлены нарушениями процесса кроветворения, но чаще всего носят реактивный характер – отражают реакцию кроветворения на другие патологические состояния и заболевания. Поэтому клинический анализ крови является одним из наиболее распространенных рутинных исследований и используется врачами различных специальностей, ему отводится ведущая роль в первичном диагностическом поиске.
Для исследования может использоваться как венозная, так и капиллярная кровь, при этом использование венозной крови предпочтительнее. Взятие производится при помощи вакуумной системы, чаще всего из вен на локтевом сгибе. В специальной пробирке – вакутейнере уже содержится антикоагулянт (ЭДТА), который препятствует свертыванию крови. Объем набранной в вакутейнер крови должен соответствовать отметке на нём – так достигается необходимая концентрация антикоагулянта, что препятствует формированию микросгустков и, как следствие, неправильному подсчету количества клеточных элементов и искажению их морфологической структуры.
В настоящее время клинический анализ крови чаще всего выполняется на гематологическом анализаторе – высокотехнологичном приборе, способном определять и автоматически рассчитывать более 30 характеристик крови, в том числе осуществлять подсчет форменных элементов, включая основные популяции лейкоцитов. Принцип работы гематологических анализаторов основан на прохождении суспензии клеток через чувствительный элемент – лазерный луч или электрический ток. Каждая клетка преломляет лазер или меняет сопротивление электрического тока, эти изменения пропорциональны размеру клетки, на чем и основано их различение анализатором.
При наличии отклонений по результатам исследования на гематологическом анализаторе врач лабораторной диагностики производит морфологическое изучение мазка крови. В данное исследование микроскопия мазка включена изначально. Для визуального подсчета форменных элементов одну-две капли крови капают на предметное стекло, другим стеклом одним движением размазывают её тонким слоем и фиксируют специальными веществами. Затем мазки окрашиваются красителями для удобства различения и визуализации клеток и изучаются врачом под микроскопом. Традиционно подсчет проводят на сто клеток и полученные цифры записывают в процентах. Зная общее количество лейкоцитов, проценты можно пересчитать в абсолютные значения, которые гораздо более объективно отражают состояние лейкоцитарной популяции.
Параметры, определяемые в исследовании
Эритроциты – наиболее многочисленные клетки крови, их основной функцией является транспорт кислорода, который они выполняют с помощью содержащегося в них специального белка – гемоглобина. Гематологический анализатор определяет количество эритроцитов, содержание гемоглобина, гематокрит и рассчитывает на основании этого ряд характеристик – так называемых эритроцитарных индексов.
Эритроциты (RBC, Red Blood Cell) – безъядерные клетки, образуются в костном мозге из ретикулоцитов, имеют форму двояковогнутого диска, что позволяет достичь максимально возможную площадь поверхности для связывания кислорода. Эритроциты имеют диаметр 7-10 микрометров, они эластичны, легко могут менять форму для безопасного прохождения по мельчайшим сосудам – капиллярам. В мазке крови выглядят как бледно-красные круглые элементы с просветлением в центре. Единица измерения – 10 12 в литре (триллионов клеток в литре).
Гемоглобин (HGB) – белок, основной компонент эритроцита, обладает сродством к кислороду, благодаря чему обеспечивается транспортная функция эритроцитов. Насыщенный кислородом гемоглобин придает эритроцитам и крови в целом красный цвет.
Гематокрит (HCT) – характеризует соотношение объема эритроцитов и плазмы. Это расчетный параметр – гематологический анализатор рассчитывает объем эритроцитов из их количества и среднего объема одной клетки (MCV).
Средний объем эритроцита (MCV, Mean Corpuscular Volume) – рассчитывается анализатором путем деления суммы клеточных объемов на количество эритроцитов. Может иметь нормальное значение при наличии в крови одновременно микроцитоза и макроцитоза. В таких ситуациях следует обращать внимание на параметр RDW. Единица измерения – фемтолитр.
Среднее содержание гемоглобина в эритроците (MCH, Mean Corpuscular Hemoglobin) – отражает степень насыщения эритроцита гемоглобином. Рассчитывается путем деления концентрации гемоглобина на количество эритроцитов.
Средняя концентрация гемоглобина в эритроците (MCHC, Mean Corpuscular Hemoglobin Concentration) также характеризует насыщение эритроцита гемоглобином. Рассчитывается путем деления гемоглобина на гематокрит.
Распределение эритроцитов по объему (RDW, Red Cell Distribution Width) – характеризует степень вариабельности объема эритроцитов – анизоцитоз. При наличии в крови популяции эритроцитов с измененным, но достаточно однородным размером значения RDW могут оставаться в норме. При выраженных различиях в объеме эритроцитов, когда MCV, характеризующий средний объем всех клеток нормален, RDW будет повышен.
Тромбоциты (PLT, Platelet) – форменные элементы крови, участвующие в остановке кровотечений путем формирования тромбов. Не являются клетками, представляют собой осколки цитоплазмы мегакариоцитов костного мозга. Диаметр 2-4 мкм.
Средний объем тромбоцитов (MPV, Mean Platelet Volume) – объем тромбоцитов уменьшается по мере старения клеток, поэтому увеличение данного параметра свидетельствует о преобладании в популяции молодых тромбоцитов.
Распределение тромбоцитов по объему (PDW, Platelet Distribution Width) – характеризует вариабельность размеров тромбоцитов.
Лейкоциты (WBC, White Blood Cell) – гетерогенная популяция ядросодержащих клеток крови, основной функцией которых является защита организма от чужеродных агентов. К лейкоцитам относятся клетки гранулоцитарного (эозинофилы, базофилы, нейтрофилы), моноцитарного и лимфоидного (Т- и В-лимфоциты) рядов. Современные анализаторы могут дифференцировать основные пять типов лейкоцитов, однако микроскопия мазка по-прежнему остается наиболее точным методом оценки лейкоцитарной популяции, так как позволяет не только определить количество разных лейкоцитов, но и выявить изменения в их морфологии, а также обнаружить атипичные клетки.
Процентное соотношение разных видов лейкоцитов в мазке крови называется лейкоцитарной формулой. Окраска мазков крови позволяет дифференцировать 5 типов лейкоцитов за счет разного окрашивания ядер и внутриклеточного пространства (цитоплазмы):
Вышеперечисленные типы лейкоцитов встречаются в мазке периферической крови в норме. При некоторых заболеваниях в кровь из костного мозга могут выходить клетки, которых в норме в мазке быть не должно: например, бласты – морфологический субстрат острого лейкоза. В заключении к исследованию обязательно указываются количество и по возможности морфологические особенности атипичных клеток.
Помимо подсчета лейкоцитов, при микроскопии оцениваются морфологические характеристики эритроцитов – их размер, форма. Эти параметры важны в диагностике различных приобретенных и врождённых анемий.
Скорость оседания эритроцитов. Тест основан на способности эритроцитов оседать под действием силы тяжести в крови, лишенной возможности свертываемости. В норме эритроциты оседают медленно, ускорение этого процесса происходит при агглютинации – слипании эритроцитов друг с другом, что приводит к увеличению массы оседающих частиц. Обычные эритроциты имеют на мембране отрицательный заряд, способствующий их отталкиванию друг от друга. При инфекционно-воспалительных, аутоиммунных и некоторых опухолевых (особенно парапротеинемических гемобластозах) заболеваниях происходит изменение белкового состава плазмы в сторону повышения содержания белков (например, иммуноглобулинов). Все белковые молекулы снижают мембранный заряд эритроцитов, способствуя их склеиванию между собой и увеличению скорости оседания. Тест проводится в течение часа, высоту полученного осадка измеряют в миллиметрах.
Для чего используется исследование?
Когда назначается исследование?
Современные технологии для качественного анализа капиллярной крови
В клинической практике довольно часто возникают ситуации, когда невозможно взять кровь для лабораторных исследований из периферических вен. Это, прежде всего, недоношенные дети и дети первого года жизни, пожилые люди и тучные пациенты, находящиеся в критическом состоянии. Для этого существуют системы, предназначенные для взятия, транспортировки и последующего исследования капиллярной крови. Наибольший спектр микропробирок (микротейнеров со встроенным коллектором) для взятия капиллярной крови с тем же спектром реагентов, что и для пробирок, предназначенных для взятия венозной крови (за исключением пробирок для исследования гемостаза), производится компанией «Бектон Дикинсон». Как известно, лабораторное исследование делится на три основных этапа: преаналитический (внелабораторный), аналитический и постаналитический. Аналитический этап непосредственно связан с функцией лаборатории, и он легко контролируется специалистами лабораторий, а использование современных систем для диагностики (автоматические анализаторы, диагностические наборы, контрольные материалы и калибраторы) сводят к минимуму ошибки на лабораторном этапе. Преаналитический этап в наименьшей степени может контролироваться лабораторией, т. к. значительная часть этого этапа осу ществляется сотрудниками лечебных учреждений. И именно с этим этапом связано до 93% ошибок при производстве анализов [5].
Централизованная клинико-диагностическая лаборатория центра «Охраны материнства и детства» выполняет исследования для 40 лечебных учреждений города Красноярска. Поэтому очень остро стоит вопрос правильной подготовки пациентов и взятия биологического материала у детей. Контроль преаналитических факторов является ключевым для обеспечения качественных результатов. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество исследований, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов. Немаловажным является психологический и физический дискомфорт пациента, когда встает вопрос о повторном получении биоматериала (дети и беременные женщины).
В ЦКДЛ выполняются исследования для детей амбулаторно-поликлинической службы города, что составляет 43% от всех выполняемых исследований. И 57% выполняется для пациенток женских консультаций города.
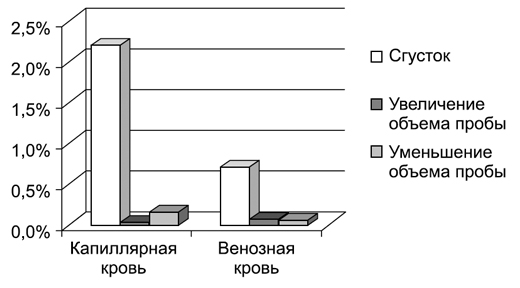
Проведенный анализ отбракованных гематологических проб за год позволил оценить частоту возникновения ошибок на преаналитическом этапе. Исследования гемограмм в среднем в месяц составляют 17 500. Для выполнения гематологических исследований мы используем капиллярную и венозную кровь. Гематологические исследования из капиллярной крови мы проводим только у детей, и эта доля составляет 58%, а 42% составляет исследование венозной крови (это дети старшего возраста и женское население). Процент брака при получении капиллярной крови составил 2,2%, при венепункции процент составил 0,7%. Таким образом, процент ошибок при взятии капиллярной крови в три раза выше, чем при взятии венозной. Основные причины низкого качества взятых проб крови: сгустки в пробе и нарушение объема пробы, которое приводит к нарушению соотношения кровь-антикоагулянт (рис. 1).
Рис. 1. Основные причины низкого качества взятых проб крови
Пробы, полученные со сгустками, составили наибольшую долю ошибок как при получении капиллярной, так и при получении венозной крови. Сгустков в капиллярной крови было получено в три раза больше, чем в венозной. Чем можно объяснить данный факт?
Венозная кровь считается лучшим материалом для лабораторных исследований. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ (например: при низком гемоглобине назначить ретикулоциты) и, как следствие, минимизировать необходимость повторных процедур взятия крови (очень важный фактор для детей) и влияние на правильность и точность результатов.
Взятие капиллярной крови для лабораторных исследований возможно в следующих ситуациях:
Анатомическое строение кровеносной системы детей обуславливает необходимость правильно сделать выбор места пункции и медицинского инструментария. В педиатрической практике возможно взятие капиллярной крови из пальца, пятки и в редких случаях из мочки уха. Пункция пальца не должна производиться у младенцев, так как это может привести к повреждению костной ткани. В таком случае подходящим местом прокола для получения образца является пятка у дистальной части пяточной кости. В связи с этим представляется важным использование автоматических ланцетов, гарантирующих низкую травматичность и соблюдение нужной глубины прокола, в зависимости от типа выбранного ланцета. Между объемом получаемой крови и глубиной прокола существует прямая зависимость. В связи с этим тип ланцета должен подбираться в соответствии с местом прокола и объемом получаемого образца. Компания «Бектон Дикинсон» производит одноразовые ланцеты с разным типом прокалывающего устройства: игла или лезвие, а также с разной глубиной прокола. Контактно-активируемые ланцеты BD Microtainer ® c корпусом фиолетового цвета предназначены для получения одной капли крови и гарантируют отсутствие болевого синдрома у пациентов не менее, чем в 90% случаев [2], тогда как ланцеты BD Microtainer ® c корпусом голубого цвета преднзначены для получения до 0,5 мл крови и обеспечивают скорость капиллярного кровотока не менее 2 мкл/с [1]. Для взятия капиллярной крови у новорожденных предпочтение должно отдаваться контактно-активируемым BD Quikheel™ с лезвием, осуществляющим полукруговое режущее движение, что позволяет получить хороший ток крои из ранки не менее, чем в 90% случаев [7].
Учитывая возрастные особенности поведения детей во время процедуры взятия крови (подвижность, эмоциональный стресс и т. д.), следует обратить внимание на последовательность заполнения пробирок. Для корректного забора капиллярной крови начать следует с пробирок с антикоагулянтами (на гематологические исследования), а затем использовать микротейнеры или пробирки для получения сыворотки или плазмы, предназначенной для биохимических, иммунологических и других видов исследований. Так, например, использование пробирки BD Microtainer ® PST™ с корпусом янтарно-желтого цвета гарантирует стабильность образцов плазмы при анализе крови на билирубин не менее 24 часов при комнатной температуре [4]. Необходимо отметить, что исследование гематологических показателей, группы крови, глюкозы и некоторых других биохимических показателей у детей возможно из капиллярной крови, но исследование показателей системы гемостаза, гормонов необходимо проводить только из венозной крови.
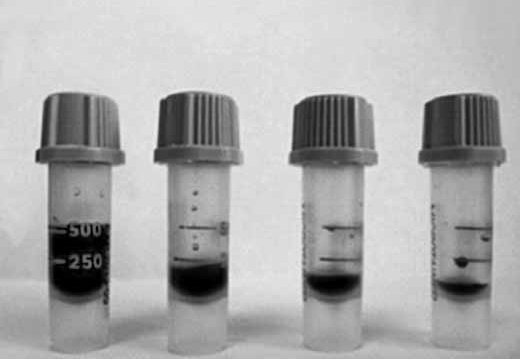
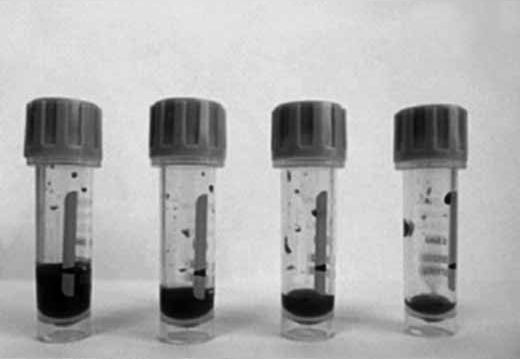
Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. Мы посмотрели влияние объема полученного образца на результаты исследований. Взятие капиллярной крови производилось одномоментно у одного пациента в микротейнеры с К2ЭДТА и К3ЭДТА разных производителей. Пробы были взяты с учетом рекомендаций производителей и с нарушением объема, как это часто бывает на практике (рис. 2, 3).
Рис. 2. Пробы с К2ЭДТА с метками для взятия 250–500 мкл крови
Рис. 3. Пробы с К3ЭДТА с метками для взятия 500 мкл крови
Избыток ЭДТА, независимо от концентрации, негативно воздействует на эритроциты, вызывая сначала их сморщивание, а затем с течением времени и набухание, что приводит к увеличению среднего объема и уменьшению среднего содержания гемоглобина в одном эритроците. Кроме того, использование К2ЭДТА в пробирках BD Microtainer ® сопровождается отсутствием формирования микросгустков [6], а пробирка BD Microtainer ® МАР с К2ЭДТА, предназначенная специально для автоматических анализаторов капиллярной крови, обеспечивает риск образования микросгустков не более 2% [6] и стабильность гематологических показателей не менее 12 часов при хранении проб при комнатной температуре [3]. При этом выявленные в ходе проведенных нами исследований нарушения наиболее выражены в пробах с КЗЭДТА. Нарушение соотношения кровь-антикоагулянт приводит к набуханию тромбоцитов и их расщеплению, что выражается в увеличении их количества, т. к. образующиеся фрагменты имеют достаточно крупные размеры и могут быть подсчитаны как нормальные кровяные пластинки. Также КЗЭДТА вызывает уменьшение общего количества лейкоцитов и их дегенеративные изменения. В связи с этим следует обращать внимание на используемый антикоагулянт, на точное соблюдение рекомендованного производителем объема образца, а также на тщательное и своевременное перемешивание пробы.
При централизации исследований взятие крови в наименьшей степени может контролироваться лабораторией. Зачастую выбор материала и места прокола осуществляется персоналом ЛПУ без учета требований лаборатории, что вынуждает отбраковывать часть образцов. В нашей лаборатории разработаны критерии отказа в проведении исследований в следующих случаях: взятый материал находится в несоответствующей пробирке (т. е. не с тем наполнителем); наличие сгустков в пробе с антикоагулянтами; несоответствие объема пробы (допускается отклонение +10%); гемолиз пробы (кроме исследований, на которые гемолиз влияния не оказывает); отсутствие штрих-кода на направлении или пробирке; отсутствие перечня исследований и т. д. Так как процедурная медицинская сестра не входит в штат лаборатории, а за конечный результат перед пациентом отвечает именно лаборатория, необходимо выработать четкие инструкции:
Немаловажным считаем обучение медицинских сестер на курсах повышения квалификации приемам и правилам забора капиллярной и венозной крови с использованием вакуумных систем и микротейнеров, с последующей выдачей сертификата.
Соблюдение правил преаналитического этапа позволит свести к минимуму ошибки лабораторных исследований.
Таблица 1. Результаты сравнительного анализа гематологических показателей при взятии разного объема капиллярной крови в пробирки с К2ЭДТА
Объем пробы, рекомендованный производителем
ЭДТА-зависимая псевдотромбоцитопения (EDTA-PTCP) у пациентов с коронавирусной (COVID-19) пневмонией и гепатолиенальным шистосомозом S. Mansoni
ЭДТА-зависимая псевдотромбоцитопения (EDTA-PTCP) у пациентов с коронавирусной (COVID-19) пневмонией и гепатолиенальным шистосомозом S. Mansoni
После вспышки новой коронавирусной пневмонии (COVID-19) в декабре 2019 года, по данным Китая, частота тромбоцитопении, осложненной COVID-19, составляет около 5–36,2%.
Был описан случай в практике, когда был диагностирован EDTA-PCTP, осложненный COVID-19. Сначала этот случай был ошибочно диагностирован как истинная тромбоцитопения in vivo.
Случай произошел в госпитале автономного района Гуанси-Чжуан, Китай.
Пациентка 59-летняя женщина была госпитализирована в изолированное отделение с тяжелым типом пневмонии, вызванным SARS-CoV-2. Диагноз был подтвержден. На момент поступления количество тромбоцитов было в пределах нормы (100–400 × 109 / л). Несмотря на лечение противовирусными препаратами у пациента появилась одышка. Парциальное давление кислорода в артериальной крови / концентрация кислорода составляли 276 мм рт.ст., а уровень ИЛ-6 достигал 140,50 пг / мл, что указывало на тяжелое течение заболевания. Пациент был переведен в отделение интенсивной терапии. При этом количество тромбоцитов было в норме. Через два дня результаты исследования образца крови в пробирках с ЭДТА показали внезапное низкое количество тромбоцитов 91 × 109 / л. С тех пор количество тромбоцитов постепенно уменьшалось.
Данный феномен исчез через 17 дней, когда пациентка выздоровела. Возможная причина появления данного феномена заключается в том, что антитело коронавируса имеет эпитоп, связывающийся с антигеном тромбоцитов, что вызывает перекрестную реакцию антиген-антитело. Примечательно, что после антивирусной обработки антитела IgG / IgM к SARS-CoV-2 изменились с положительного на отрицательный, а также исчезли EDTA-PCTP.
ЭДТА-зависимая псевдотромбоцитопения (EDTA-PTCP) может встречаться как у здоровых людей, так и у пациентов с различными заболеваниями, такими как аутоиммунные заболевания, опухоли, инфекции. Ошибочная трактовка результатов исследований может привести к ошибочному диагнозу и к неправильному лечению пациента. Особенно это важно для пациентов с осложнённым течением заболевания.
В настоящее время в большинстве лабораторий для гематологических тестов используют преимущественно калиевые соли ЭДТА (К2ЭД-ТА, К3ЭДТА). При этом пробирки с цитратом натрия берутся параллельно при подозрении на EDTA-PTCP. Не исключается возможность пересмотра мазка периферической крови, поскольку это самый простой лабораторный тест. Однако для крупных лабораторий, с большим потоком проб ручной метод анализа может стать непреодолимой преградой из-за нехватки человеческих и временных ресурсов. В таком случае рекомендуется использовать современный парк оборудования, анализаторы, которые имеют специализированные каналы для точного подсчета количества тромбоцитов, а также их степень зрелости.
Шистосомоз (шистосоматоз) —тропическое паразитарное заболевание, вызываемое кровяными сосальщиками (трематодами) из рода Schistosoma.
Симптомы шистосомоза определяются видом паразита (так, кишечный шистосомоз чаще всего вызывается гельминтом Schistosoma mansoni).
Кишечный шистосомоз может вызывать боли в области живота, диарею и появление крови в фекалиях. В запущенных случаях наблюдается увеличение печени, что часто связано с накоплением жидкости в брюшной полости и гипертензией абдоминальных кровяных сосудов. В таких случаях селезенка может быть увеличена.
При этом в крови у пациентов при гепатолиенальном шистосомозе может наблюдаться снижение количества тромбоцитов в образце крови. Этот in vitro феномен известен как ЭДТА-зависимая псевдотромбоцитопения (EDTA-PTCP) и связан с реакцией агглютинации тромбоцитов под воздействием антикоагулянтов. Распространенность EDTA-PCTP при шистосомозе неизвестна, но один случай был полностью описан. Целью исследователей из Института тропической медицины (Бразилия) было определить распространенность EDTA-PTCP у пациентов с гепатолиенальным шистосомозом и оценить альтернативные методы преодоления этой аналитической ошибки.
Для проведения эксперимента были собраны образцы крови от 56 пациентов с гепатолиенальным шистосомозом и 56 здоровых добровольцев. Подсчет тромбоцитов проводился с использованием стандартной микроскопии и автоматизированных (электрический импеданс) методов. Автоматический подсчет тромбоцитов и наличие сгустков тромбоцитов в мазках крови оценивали в пробах, собранных в пробирки с ЭДТА или цитратом натрия через 20 и 180 минут после сбора крови.
Результаты исследования показали, что ЭДТА-зависимая псевдотромбоцитопения чаще встречалась у пациентов с шистосомозом, чем у здоровых добровольцев (8,92% против 0,00%, p
На основании этого ученые сделали вывод, что использование пробирок с цитратом натрия не может применяться в качестве альтернативного метода.
Также исследователи рекомендуют проводить автоматический подсчет тромбоцитов в образцах крови от пациентов с гепатолиенальном шистосомозом сразу после взятия крови в пробирки с ЭДТА и проверять путем ручного подсчета в мазках крови.
Около 200 млн. человек во всем мире страдают хроническим шистосомозом. К эндемичным регионам относят не только Африку, Южную Америку, но и Дальний Восток, Юго-Восточную Азию.
ЭДТА-зависимая псевдотромбоцитопения (EDTA-PTCP), вызванная антикоагулянтами ЭДТА, является лабораторным феноменом и может привести к ошибочному диагнозу, что в конечном счете может привести к неправильному лечению пациента.
В настоящее время в абсолютном большинстве лабораторий для гематологических тестов используют преимущественно калиевые соли ЭДТА (К2ЭД-ТА, К3ЭДТА), так как они обеспечивают большую стабильность размера клеток крови и не разбавляют образец.
Действительно, в большинстве случаев лаборатория пересматривает мазки с помощью микроскопии, однако нужно помнить, что сейчас существуют специальные анализаторы, например, анализаторы типа Sysmex серии XN со специальным PLT-F каналом, который позволяет точно подсчитывать количество тромбоцитов, а также их степень зрелости. При этом можно использовать стандартные пробирки, необходимость пересматривать глазами мазки или использовать специальные/дополнительные пробирки – полностью исключена. Это особенно важно для крупных лабораторий, с большим потоком пациентов.