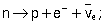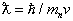движение нейтрона в электрическом поле
Движение нейтрона в электрическом поле
Нейтрон — нейтральная частица, относящаяся к классу адронов. Открыта в 1932 г. английским физиком Дж. Чедвиком. Вместе с протонами нейтроны входят в состав атомных ядер. Электрический заряд нейтрона 




Как и протон и прочие адроны, нейтрон не является истинно элементарной частицей: он состоит из одного м-кварка с электрическим зарядом 


Нейтроны устойчивы лишь в составе стабильных атомных ядер. Свободный нейтрон — нестабильная частица, распадающаяся на протон 




По энергетическому балансу различных ядерных реакций определена величина разности масс нейтрона и протона: 




Нейтрон участвует во всех видах фундаментальных взаимодействий (см. Единство сил природы). Сильные взаимодействия связывают нейтроны и протоны в атомных ядрах. Пример слабого взаимодействия — бета-распад нейтрона — здесь уже рассматривался. Участвует ли эта нейтральная частица в электромагнитных взаимодействиях? Нейтрон обладает внутренней структурой, и в нем при общей нейтральности существуют электрические токи, приводящие, в частности, к появлению у нейтрона магнитного момента. Иными словами, в магнитном поле нейтрон ведет себя подобно стрелке компаса.
Это лишь один из примеров его электромагнитного взаимодействия.
Большой интерес приобрели поиски диполь-ного электрического момента нейтрона, для которого была получена верхняя граница: 
Гравитационные взаимодействия нейтронов наблюдались непосредственно по их падению в поле тяготения Земли.
Сейчас принята условная классификация нейтронов по их кинетической энергии: медленные нейтроны 



Другой метод хранения ультрахолодных нейтронов основан на их волновых свойствах. При малой энергии длина волны де Бройля (см. Квантовая механика) настолько велика, что нейтроны отражаются от ядер вещества подобно тому, как свет отражается от зеркала. Такие нейтроны можно просто хранить в замкнутой «банке». Эта идея была высказана советским физиком Я. Б. Зельдовичем в конце 1950-х гг., и первые результаты были получены в Дубне, в Объединенном институте ядерных исследований спустя почти десятилетие. Недавно советским ученым удалось построить сосуд, в котором ультрахолодные нейтроны живут до своего естественного распада.
Свободные нейтроны способны активно взаимодействовать с атомными ядрами, вызывая ядерные реакции. В результате взаимодействия медленных нейтронов с веществом можно наблюдать резонансные эффекты, дифракционное рассеяние в кристаллах и т. п. Благодаря этим своим особенностям нейтроны широко используются в ядерной физике и физике твердого тела. Они играют важную роль в ядерной энергетике, в производстве трансурановых элементов и радиоактивных изотопов, находят практическое применение в химическом анализе и в геологической разведке.
Движение нейтрона в электрическом поле
среднее время жизни Н. t » 16 мин. В веществе свободные Н. существуют ещё меньше (в плотных веществах единицы — сотни мксек) вследствие их сильного поглощения ядрами. Поэтому свободные Н. возникают в природе или получаются в лаборатории только в результате ядерных реакций (см. Нейтронные источники). В свою очередь, свободный Н. способен взаимодействовать с атомными ядрами, вплоть до самых тяжёлых; исчезая, Н. вызывает ту или иную ядерную реакцию, из которых особое значение имеет деление тяжёлых ядер, а также радиационный захват Н., приводящий в ряде случаев к образованию радиоактивных изотопов. Большая эффективность Н. в осуществлении ядерных реакций, своеобразие взаимодействия с веществом совсем медленных Н. (резонансные эффекты, дифракционное рассеяние в кристаллах и т.п.) делают Н. исключительно важным орудием исследования в ядерной физике и физике твёрдого тела. В практических приложениях Н. играют ключевую роль в ядерной энергетике производстве трансурановых элементов и радиоактивных изотопов (искусственная радиоактивность), а также широко используются в химическом анализе (активационный анализ) и в геологической разведке (нейтронный каротаж).
Основные характеристики нейтронов
Масса. Наиболее точно определяемой величиной является разность масс Н. и протона: mn — mр = (1,29344 ± 0,00007) Мэв, измеренная по энергетическому балансу различных ядерных реакций. Из сопоставления этой величины с массой протона получается (в энергетических единицах)
Спин и статистика. Значение 1 /2 для спина Н. подтверждается большой совокупностью фактов. Непосредственно спин был измерен в опытах по расщеплению пучка очень медленных Н. в неоднородном магнитном поле. В общем случае пучок должен расщепиться на 2J + 1 отдельных пучков, где J — спин Н. В опыте наблюдалось расщепление на 2 пучка, откуда следует, что J = 1 /2. Как частица с полуцелым спином, Н. подчиняется Ферми — Дирака статистике (является фермионом); независимо это было установлено на основе экспериментальных данных по строению атомных ядер (см. Ядерные оболочки).
Магнитный дипольный момент нейтрона, определённый из экспериментов по ядерному магнитному резонансу, равен:
Н. участвуют во всех известных взаимодействиях элементарных частиц — сильном, электромагнитном, слабом и гравитационном.
При низких энергиях реальные взаимодействия Н. и протонов с заряженными частицами и атомными ядрами сильно различаются из-за наличия у протона электрического заряда, обусловливающего существование дальнодействующих кулоновских сил между протоном и др. заряженными частицами на таких расстояниях, на которых короткодействующие ядерные силы практически отсутствуют. Если энергия столкновения протона с протоном или атомным ядром ниже высоты кулоновского барьера (которая для тяжелых ядер порядка 15 Мэв), рассеяние протона происходит в основном за счёт сил электростатического отталкивания, не позволяющих частицам сблизиться до расстояний порядка радиуса действия ядерных сил. Отсутствие у Н. электрического заряда позволяет ему проникать через электронные оболочки атомов и свободно приближаться к атомным ядрам. Именно это обусловливает уникальную способность Н. сравнительно малых энергий вызывать различные ядерные реакции, в том числе реакцию деления тяжёлых ядер. О методах и результатах исследований взаимодействия Н. с ядрами см. в статьях Медленные нейтроны, Нейтронная спектроскопия, Ядра атомного деление, Рассеяние медленных Н. на протонах при энергиях вплоть до 15 Мэв сферически симметрично в системе центра инерции. Это указывает на то, что рассеяние определяется взаимодействием n — р в состоянии относительного движения с орбитальным моментом количества движения l = 0 (так называемая S-волна). Рассеяние в S-cocтоянии является специфически квантовомеханическим явлением, не имеющим аналога в классической механике. Оно превалирует над рассеянием в др. состояниях, когда де-бройлевская длина волны Н.
порядка или больше радиуса действия ядерных сил ( 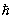
Гравитационное взаимодействие нейтрона. Н. — единственная из имеющих массу покоя элементарных частиц, для которой непосредственно наблюдалось гравитационное взаимодействие — искривление в поле земного тяготения траектории хорошо коллимированного пучка холодных Н. Измеренное гравитационное ускорение Н. в пределах точности эксперимента совпадает с гравитационным ускорением макроскопических тел.
Нейтроны во Вселенной и околоземном пространстве
Вопрос о количестве Н. во Вселенной на ранних стадиях её расширения играет важную роль в космологии. Согласно модели горячей Вселенной (см. Космология), значительная часть первоначально существовавших свободных Н. при расширении успевает распасться. Часть Н., которая оказывается захваченной протонами, должна в конечном счёте привести приблизительно к 30%-ному содержанию ядер Не и 70%-ному — протонов. Экспериментальное определение процентного состава He во Вселенной — одна из критических проверок модели горячей Вселенной.
Эволюция звёзд в ряде случаев приводит к образованию нейтронных звёзд, к числу которых относятся, в частности, так называемые пульсары.
В первичной компоненте космических лучей Н. в силу своей нестабильности отсутствуют. Однако взаимодействия частиц космических лучей с ядрами атомов земной атмосферы приводят к генерации Н. в атмосфере. Реакция 14 N (n, р) 14 С, вызываемая этими Н., — основной источник радиоактивного изотопа углерода 14 C в атмосфере, откуда он поступает в живые организмы; на определении содержания 14 C в органических остатках основан радиоуглеродный метод геохронологии. Распад медленных Н., диффундирующих из атмосферы в околоземное космическое пространство, является одним из основных источников электронов, заполняющих внутреннюю область радиационного пояса Земли.
Лит.: Власов Н. А., Нейтроны, 2 изд., М., 1971; Гуревич И. И., Тарасов Л. В., Физика нейтронов низких энергий, М., 1965.
Физики уточнили максимальное значение заряда нейтрона
C. Siemensen et al. / Phys. Rev. D
Исследователи из Франции и Германии измерили заряд ультрахолодных нейтронов, помещая их в сильное электрическое поле и заставляя отражаться от цилиндрического зеркала. В результате физики получили значение q ≈ (−0,3 ± 3,7) × 10 −20 e, которое сравнимо с другими экспериментами по определению заряда нейтрона и может быть легко уточнено в дальнейшем. Статья опубликована в Physical Review D.
В рамках школьного курса физики учат, что электрический заряд квантуется. Другими словами, заряд любой элементарной частицы и любого физического тела вообще должен быть кратен вполне определенному значению, равному одной трети от заряда электрона. При этом наименьшим возможным зарядом обладают кварки, которые не могут существовать в виде свободных частиц из-за конфайнмента, поэтому для удобства квантом электрического заряда можно считать заряд электрона, примерно равный e = −1,6 × 10 −19 кулонов.
Тем не менее, до сих пор физики не вполне понимают, с чем связано такое поведение. В 1948 году Поль Дирак предложил объяснить этот эффект, вводя в теорию магнитные монополи, однако ни в квантовой электродинамике, ни в Стандартной модели, нет механизмов, которые должны вызывать квантование заряда. Поэтому некоторые ученые считают, что в действительности заряд может меняться непрерывно, и проводят эксперименты по поиску таких изменений. В частности, наиболее чувствителен к таким изменениям будет нейтрон, который в обычных условиях зарядом не обладает, а потому не может вступать в электрические взаимодействия, — однако при отсутствии квантования частица может приобрести небольшой заряд, который удастся измерить на практике. На данный момент различные эксперименты ограничивают заряд нейтрона величиной порядка q
В этой статье группа ученых под руководством Кристиана Плонка (Christian Plonka) приводит результаты нового измерения заряда нейтрона, точность которого немного превышает точность предыдущих экспериментов. Чтобы измерить заряд, исследователи накладывали на систему внешнее электрическое поле и следили, как пучок ультрахолодных нейтронов — нейтронов с энергией не выше 300 наноэлектронвольт, то есть со скоростью не больше 7,6 метров в секунду — отражается от цилиндрического зеркала. Если бы частицы действительно имели небольшой электрический заряд, поле изменяло бы их траекторию, причем немного по-разному для частиц, отраженных от зеркала под различными углами. Поэтому по величине отклонений можно судить о величине заряда нейтронов.
Схема экспериментальной установки: пунктирными линиями отмечены траектории нейтронов, стрелками — направление электрического поля (f), красным — отражающее масляное зеркало (e). Нейтроны «впрыскиваются» в установку в дальней части (c) и отражаются от цилиндрического зеркала в ближней части (b)
C. Siemensen et al. / Phys. Rev. D
Схема экспериментальной установки, вид сверху
Протоны, нейтроны и электроны: строение атомов
В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Здесь будем использовать уравнение.
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Заключение
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
Короткое, но познавательное видео про элементарные частицы: