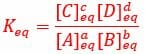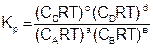какие значения может принимать константа равновесия
Константа равновесия – определение и выражение
Определение константы равновесия
Константа равновесия, Keq, представляет собой переменную, которая описывает тенденцию химической реакции к завершению, то есть все реагенты превращаются в продукты. Равновесие реакции – это точка, в которой превращение реагентов в продукты равно конверсии продуктов обратно в реагенты.
Обзор константы равновесия
Большая константа равновесия означает, что реакция идет в прямом направлении, от реагентов до продуктов, пока почти все реагенты не будут превращены в продукты. Небольшая константа равновесия или когда Keq меньше единицы, означает, что химическая реакция благоприятствует реагентам, и реакция будет идти в противоположном направлении. Константа равновесия 1 указывает, что реагенты и продукты будут равны, когда реакция достигнет равновесия.
Ученые используют константу равновесия уравнения, чтобы лучше понять, как быстро будет достигнуто равновесие и будет ли равновесие благоприятствовать реагентам или продуктам. Константа может быть рассчитана с использованием отношения продуктов к реагентам, когда уравнение достигнет равновесия. Константа равновесия часто представлена переменной Keq, которая определяется выражением константы равновесия, показанным ниже.
Выражение константы равновесия для реакции
Выражение константы равновесия описывает концентрацию продуктов, деленную на концентрацию реагентов, когда реакция достигает равновесия. Это выражение можно увидеть ниже.
В реакции: аа + бб cC + dD
Каждый термин описывает концентрацию реагента или продукта в реакции, в которой химические вещества A и B объединяются, образуя продукты C и D. Строчные буквы обозначают количество молей каждого химического вещества. Скобки вокруг буквы, [A]указать концентрацию каждого химического вещества, а нижний индекс означает, что константа равновесия определяется концентрацией каждого химического вещества. молекула в равновесии.
Дж. Уиллард Гиббс Известный ученый, изучавший энергию, присутствующую в реакциях, показал, что константа равновесия напрямую связана с величиной изменения свободной энергии, которое происходит во время реакции и обозначается как ∆G. Гиббс показал, что каждая реакция имеет стандартное изменение свободной энергии, или ∆G °. В то время как полное изменение свободной энергии каждой реакции также определяется начальными концентрациями химических веществ, стандартная свободная энергия рассчитывается с помощью приведенного ниже уравнения с использованием константы равновесия уравнения.
Это уравнение показывает, что стандартное изменение свободной энергии это просто другой способ описания движущих сил реакции и того, как они будут развиваться. В то время как константа равновесия говорит нам, будет ли у нас больше реагента или продуктов в конце реакции, это не намекает на то, как быстро будет происходить эта реакция. Это известно как константа скорости и обозначается строчной буквой k. Константа скорости связана с множеством других уравнений, связанных со скоростью, с которой происходят реакции. Константа равновесия важна для ряда биологических реакций, как видно из приведенных ниже примеров.
Примеры константы равновесия
Ионизация воды
Вода – основа всей жизни на Земле. Одна из главных причин, почему вода такая хорошая растворитель является его способность образовывать водородные связи как с собой, так и с не водяными молекулами. Эта способность не только позволяет воде растворять и рассеивать растворенные вещества, но также позволяет воде переносить электрический ток. Когда вода, H2O, образует водородные связи, водород отделяется от кислорода, и молекула диссоциирует на ион водорода (H +) и гидроксид-ион (OH–).
Отдельные протоны водорода редко существуют свободно в решение и сразу же образует связь с молекулой воды, с которой он был связан водородом. Это образует ион гидрония, или H3O +. Следовательно, константа равновесия для этой реакции представляет собой концентрацию ионов водорода и гидроксид-ионов, деленную на концентрацию нормальных молекул воды, как показано ниже.
Константа равновесия этой реакции может быть измерена по электропроводности воды, которая определяется концентрацией (H3O +). Ионы гидроксония передают электрический сигнал в виде переноса электронов, который может быть измерен чувствительным электрическим оборудованием. Таким образом, константа равновесия воды была измерена чувствительным электрическим оборудованием, чтобы быть 1,8 х 10-16, что означает, что вода имеет гораздо большую вероятность быть реагентом H2O, в отличие от превращения в ион гидрония Процесс можно увидеть на изображении ниже.
Можно также сказать, что эти реакции имеют положительное изменение в свободной энергии, то есть они выделяют энергию для реакций вокруг них. Другие важные реакции являются эндергоническими, то есть они требуют энергии, чтобы иметь место. Эти реакции имеют низкую константу равновесия, описывающую их тенденцию оставаться в качестве реагентов. Клетки связывают эти реакции, чтобы позволить эндергоническим реакциям иметь место. Это можно наблюдать во многих типичных клеточных реакциях, в которых используется высокая константа равновесия АТФ, превращающихся в АДФ, для стимулирования эндергонических реакций, таких как образование белков или жирные кислоты.
Какие значения может принимать константа равновесия
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 
Дифференцируем уравнение (6 – 5)

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе
В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим


Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
Константа химического равновесия



Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
Перенесем константы скорости в одну сторону, а концентрации в другую:
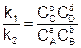
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
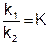
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
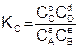
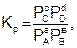
где РС, РD, РА и РВ – равновесные давления участников реакции.
Перенесем объем в правую сторону
р = 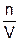
Подставим уравнение (6.9) в (6.7), для каждого реагента и упростим
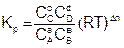
где Dn – изменение числа молей газообразных участников реакции
Dn = (с + d) – (а + в) (6.11)
Из уравнения (6.12) видно, что KР = КС, если не меняется количество молей газообразных участников реакции (Dn = 0) или газы в системе отсутствуют.
Необходимо отметить, что в случае гетерогенного процесса концентрацию твердой или жидкой фазы в системе не учитывают.
Например, константа равновесия для реакции вида 2А + 3В = С + 4D, при условии, что все вещества газы и имеет вид
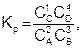
а если D – твердое, то
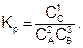
Константа равновесия имеет большое теоретическое и практическое значение. Численное значение константы равновесия позволяет судить о практической возможности и глубине протекания химической реакции.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
6.3. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции).
Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884): если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается.
Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида:
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CАили CВ ®; CСили CD ¬; ¯ CАили CВ ¬; ¯ CСили CD ®).
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Dn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Dn = 0, то давление не влияет на смещение химического равновесия; если Dn 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. (Схематично можно записать: при Dn = 0 Р не влияет; при Dn 0 Р ¬, ¯Р ®). Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Константа равновесия химической реакции

Всего получено оценок: 121.
Всего получено оценок: 121.
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
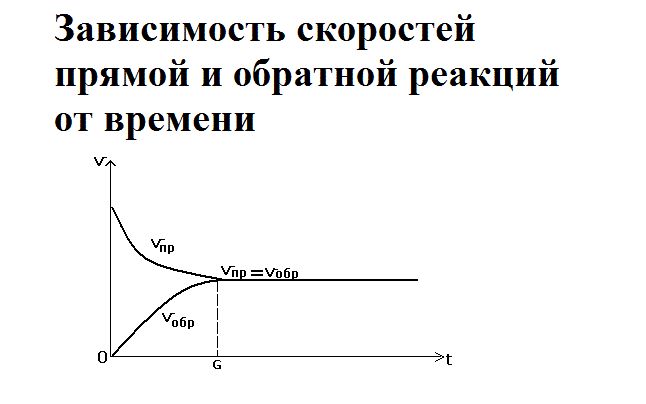
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакции будут равны: