природные горючие газы состав свойства единицы измерения параметров газа
Природные горючие газы: состав, свойства, единицы измерения параметров газа. Основные законы идеальных газов.
+лекция газоснаб1 стр 3
Удельный вес газа определяется отношением веса единицы объема газа по отношению к весу одинакового объема сухого атмосферного воздуха, удельный вес которого принимают 1,0 при температуре 0°С и давлении 760 мм рт. ст.
Чем больше удельный вес газа, тем богаче газ тяжелыми углеводородами. Наоборот, небольшой удельный вес указывает на обилие в газе метана.
Плотность – масса вещества в единице объема в кг/м3 или г/см 3.
Плотность газа. 1 грамм-молекула любого газа при нормальных условиях (температура 0°С и давление 0,1 МПа) занимает 22,412 л, т.е. в 1 м3 любого газа содержится 44,6 моля. Обычно пользуются относительной плотностью газа по воздуху.
При температуре 0°С и давлении 0,1 МПа, масса 1 м3 воздуха составляет 1,293 кг.
18. Добыча газа. Методы и оборудование для подготовки природного газа: осушка, очистка, одоризация.
Происхождение углеводородных газов связано главным образом с биохимическими процессами, в результате которых происходило разложение и преобразование органических веществ, состоявших из остатков отмерших животных организмов и растительности. Веществом, послужившим основой для образования нефти и газа, явился органический осадок застойных водных бассейнов, содержавший преимущественно примитивные водоросли и погибшие животные организмы.
Залежь нефти или газа представляет собой скопление углеводородбв, которые заполняют поры проницаемых пород. Если скопление велико и его эксплуатация экономически целесообразна, залежь считают промышленной. Залежи, занимающие значительные площади, образуют месторождения.
Газоносные (продуктивные) пласты состоят из пород с пористой структурой (пески, песчаники, пористые известняки или доломиты). В зависимости от структуры и состава газоносные пласты имеют различную крепость. Обычно чем больше геологический возраст пласта, тем он прочнее. Мощность (толщина) газоносных пластов измеряется десятками, а иногда и сотнями метров. Газоносные пласты залегают между газонепроницаемыми породами (сланцевыми глинами, плотными известняками, мергелями). Большинство известных газовых месторождений представляет собой антиклинали, т. е. складки земной коры, обращенные выпуклостью кверху, или купола.
На рис. 2.1 показана наиболее простая форма газовой залежи. Газ заключен в куполообразном подземном пласте. В верхних горизонтах газ скапливается в виде газовых шапок. Внизу находится нефть (в газо-нефтяных месторождениях) или пластовая вода (в чисто газовых месторождениях). Основная масса газовых месторождений имеет контакт с пластовой водой.
Рис. 2.1. Форма газовой залежи
а — полнопластовая; б — неполнопластовая; 1 — внешний контур газоносности; 2 — внутренний контур газоносности; 3 — газовозмещающий коллектор; 4 — вода краевая; 5 — вода подошвенная; Н — высота залежи (этаж газоносности); h — мощность вмещающего продуктивного коллектора
Газовая скважина является основным элементом промыслов. Верх скважины называют устьем, низ — забоем. Бурят скважину быстровращающимся буром-долотом, который разрушает породы в забое. В настоящее время для этой цели применяют шарошечные долота, в которых шарошки, вращаясь вокруг своих осей, дробят и скалывают породу.
Специфика эксплуатации газовых месторождений состоит в том, что весь добытый газ следует немедленно транспортировать к объектам потребления. Поэтому при назначении режима работы газовых скважин нужно учитывать подготовленность потребителей к использованию газа и их режим работы. Если вблизи городов, потребляющих газ, есть подземные хранилища, режим работы газовых промыслов может не соответствовать режиму потребления, так как избыточный газ будут направлять в хранилища.
Отдельные скважины на газовых промыслах присоединяют газопроводами к коллекторам, которые заканчиваются промысловой газораспределительной станцией. На выкидных линиях после фонтанной елки устанавливают предохранительные клапаны и манометры. Выкидные линии соединяют с сепараторами, в которых газ очищается от твердых и жидких механических примесей. Из сепаратора газ поступает в газосборный коллектор. Количество добываемого газа измеряют счетчиком. В месте присоединения газоотводящей линии к коллектору устанавливают задвижку, обратный клапан и отвод с задвижкой для продувки газопровода.
При прохождении через регулирующий штуцер вследствие падения давления газ сильно охлаждается, поэтому необходимо принимать меры против образования гидратных и ледяных пробок. Кристаллогидратами называют соединения углеводородов с водой, по внешнему виду напоминающие лед. Для предохранения газопровода от закупоривания в него обычно подают метанол (метиловый спирт). Действие метанола заключается в том, что он образует с водяными парами раствор, который имеет низкую температуру замерзания и легко может быть удален из газопровода.
На промысловой газораспределительной станции газ вновь очищают в сепараторах, осушают и производят его учет. Если газ содержит сероводород, тогда до подачи в магистральный газопровод его от сероводорода очищают. Из газораспределительной станции газ поступает в головную компрессорную станцию или, если давление отбора достаточно велико, непосредственно в магистральный газопровод.
Осушка газа. Содержание влаги в газе при его транспортировании часто вызывает серьезные эксплуатационные затруднения. При определенных внешних условиях (температуре и давлении) влага может конденсироваться, образовывать ледяные пробки и кристаллогидраты, а в присутствии сероводорода и кислорода вызывать коррозию трубопроводов и оборудования. Во избежание перечисленных затруднений газ осушают, снижая температуру точки росы на 5—7° ниже рабочей температуры в газопроводе.
При транспортировании осушенного газа трубопровод можно прокладывать на меньшую глубину, что уменьшает капиталовложения. Наибольшие трудности при транспортировании газов по магистральным газопроводам возникают при образовании кристаллогидратов. Многие газы (метан, этан, пропан, бутан, углекислый газ и сероводород), насыщенные влагой, при определенных значениях температуры и давления образуют с водой (в жидкой фазе) соединения, называемые кристаллогидратами. Если влага удалена из газа и газ оказывается ненасыщенным, кристаллогидраты не образуются.
Очистка газа от сероводорода и углекислого газа. В горючих газах, используемых для газоснабжения городов, содержание сероводорода не должно превышать 2 г на 100 м 3 газа. Содержание углекислого газа нормы не лимитируют, однако по технико-экономическим соображениям в транспортируемом газе оно не должно превышать 2%.
Существуют сухие и мокрые методы очистки газа от HS. Сухие методы очистки газа основаны на применении твердых поглотителей (гидрата окиси железа, содержащегося в болотной руде, и активированного угля). При мокрых методах очистки газа используют жидкие поглотители.
Одоризация газа. Природный газ не имеет запаха. Поэтому для своевременного выявления утечек газа ему придают залах — газ одорируют, В качестве одоранта применяют этилмеркаптан (C2H5SH). По токсичности качественно и количественно он идентичен сероводороду, имеет резкий неприятный запах. Количество вводимого в газ одоранта определяют таким образом, чтобы при концентрации в воздухе газа, не превышающей 1/5 нижнего предела взрываемости, ощущался резкий запах одоранта. На практике средняя норма расхода этилмеркаптана для одоризации природного газа, поступающего в городские сети, установлена 16 г на 1000 м 3 газа при 0°С и давлении 101,3 кПа.
Горючие газы
Горючие газы в смеси с кислородом предназначены для газопламенной обработки металлов. Наиболее часто для газовой сварки применяют ацетилен. Для газовой резки сталей, когда температура подогревающего пламени не оказывает решающего влияния на протекание процесса, а лишь увеличивает продолжительность начального подогрева металла перед резкой, рекомендуется использовать газы-заменители ацетилена, у которых температура пламени не менее 1800-2000°C.
В качестве газов-заменителей ацетилена используют:
Содержание
Ацетилен
Ацетилен С2Н2 является основным горючим газом для газовой сварки и резки металлов, температура его плавления при сгорании в смеси с технически чистым кислородом достигает 3150°С.
Ацетилен является химическим соединением углерода и водорода. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом, обусловленным содержащимися в нем примесями сероводорода, аммиака, фосфористого водорода и др. Длительное вдыхание его вызывает тошноту, головокружение и даже отравление.
Повышение давления существенно снижает температуру самовоспламенения. Присутствие в ацетилене других веществ увеличивает поверхность контакта и тем понижает температуру самовоспламенения.
Зависимость температуры воспламенения ацетилена от давления приведена ниже:
| Температура, °С | 630 | 530 | 475 | 350 |
| Абсолютное давление, МПа | 0,2 | 0,3 | 0,4 | 2,2 |
Присутствие окиси меди снижает температуру самовоспламенения ацетилена до 240°С. При определенных условиях ацетилен реагирует с медью, образуя взрывоопасные соединения, вот почему категорически запрещается при изготовлении ацетиленового оборудования применение сплавов, содержащих более 70% меди.
Взрываемость ацетилена понижается при растворении его в жидкостях. Особенно хорошо он растворяется в ацетоне. В одном объеме технического ацетона при 20°С и нормальном атмосферном давлении можно растворить до 20 объемов ацетилена. Растворимость в ацетоне увеличивается с увеличением давления и понижением температуры.
Технический ацетилен получают двумя способами:
Ацетилен, полученный из природного газа, называется пиролизным. Получение его из природного газа на 30-40% дешевле, чем из карбида кальция.
К месту сварки ацетилен доставляется в специальных стальных баллонах, заполненных пористой пропитанной ацетоном массой, под давлением 1,9 МПа.
При сварке температура пламени должна примерно в два раза превышать температуру плавления металлов, поэтому газы-заменители, температура пламени которых ниже, чем у ацетилена, необходимо использовать при сварке металлов с более низкой температурой плавления, чем у сталей. При кислородной резке используются горючие газы, которые при сгорании в смеси с кислородом дают пламя с температурой не ниже 2000°С. Выбор горючего газа зависит от его теплотворной способности.
Теплотворная способность количество теплоты в килоджоулях, получаемое при полном сгорании 1 м 3 газа
Чем выше теплотворная способность газа, тем меньше его расход при сварке и резке металлов. Для полного сгорания одинакового объема различных горючих газов требуется различное количество кислорода, от этого зависит эффективная мощность пламени.
Эффективной мощностью пламени называется количество тепла, вводимое в нагреваемый металл в единицу времени
Для расчетов замены ацетилена другим газом-заменителем пользуются коэффициентом замены ацетилена.
Водород
Ниже представлена лишь справочная информация о водороде, для более подробной информации читайте статью плотность, формула, масса, получение и другие характеристики водорода
Водород H2 в нормальных условиях представляет собой горючий газ без цвета и запаха. Это один из самых легких газов, он в 14,5 раза легче воздуха. Водород способен образовывать в определенных пропорциях взрывоопасные смеси с воздухом и кислородом. Поэтому при сварочных работах необходимо строго соблюдать правила безопасности труда. Получают водород разложением воды электрическим током. К месту сварки водород доставляют в стальных баллонах в газообразном состоянии под давлением 15 МПа. Баллоны для водорода окрашивают в зеленый цвет. Водород, применяемый для сварочных работ, должен удовлетворять требованиям ГОСТ 3022-80. Водородно-кислородное пламя имеет синюю окраску и не имеет четких очертаний зон пламени, что затрудняет, его регулировку.
Коксовый газ
Городской газ
Пропан
Смесь легко превращается в жидкое состояние, например при температуре 233 К пропан-бутановая смесь сжижается при атмосферном давлении. Сжиженные газы хранят только в закрытых емкостях, так как испарение жидкости происходит даже при 273 К.
Плотность пропан-бутана больше плотности воздуха, поэтому необходимо тщательно следить за герметичностью аппаратуры и коммуникаций во избежание образования взрывоопасной смеси газа с воздухом внизу помещения. Заполнение емкостей пропаном и пропан-бутановой смесью, транспортирование их, а также слив газа должны выполняться в соответствии с «Правилами устройства и безопасной эксплуатации сосудов, работающих под давлением», утвержденными Госгортехнадзором.
Пропан-бутановые смеси широко применяются при резке сталей, сварке и пайке легкоплавких цветных металлов, закалке, газовой сварке пластмасс. К месту сварки смесь поставляют в стальных баллонах под давлением 1,6 МПа или по газопроводам через перепускную рампу. При испарении 1 кг пропана образуется 500 дм 3 газа.
Бензин
Бензин является продуктом переработки нефти. Он представляет собой легко испаряющуюся прозрачную жидкость с резким характерным запахом. Пары бензина при сгорании в кислороде дают температуру пламени 2400-2500°С. Для очистки бензина его фильтруют через войлок. Бензин используется для кислородной резки, а также для сварки и пайки легкоплавких металлов.
Керосин
Керосин также является продуктом переработки нефти и представляет собой бесцветную желтоватую легко испаряющуюся жидкость. Керосин, применяемый для сварки и резки металлов, должен удовлетворять требованиям ТУ 38.71-58-10-90. Керосин применяют также для сварки и пайки легкоплавких цветных металлов.
Итак, мы узнали, что ацетилен является основным горючим газом для газовой сварки, но для газовой резки применяют другие, менее дорогие газы, которые позволяют осуществлять процесс резки без существенной потери производительности и качества.
Состав и основные параметры природных газов



ЛЕКЦИЯ 2 СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ
Природные газы, добываемые из газовых и газоконденсатных месторождений, состоят из предельных углеводородов с общей формулой CnH2n+2 и неуглеводородных компонентов: азота (N2), углекислого газа (СО2), сероводорода (H2S), инертных газов (гелия, аргона, криптона, ксенона). Кроме того, природные газы насыщены парами воды, содержание которых зависит от давления, температуры, состава газа и воды. Число углеродных атомов в молекуле углеводородов п может достигать 17-40.
По составу компонентов природные газы можно подразделить на три группы:
1. Газы, добываемые из чисто газовых месторождений. Это сухие
газы без тяжелых углеводородов.
2. Газы, добываемые с нефтью (попутный нефтяной газ), это физическая смесь сухого газа, сжиженного газа и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений. Они со
стоят из сухого газа и жидкого углеводородного конденсата.
Объемный (молярный) состав газа можно пересчитать в массовый для каждого компонента смеси по формуле
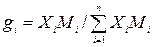
Если состав природного газа задан в массовых долях, то для пересчета его в объемные (молярные) единицы используется формула
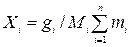
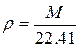
Плотность газа известного состава определяется как сумма произведений плотности отдельных компонентов 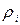
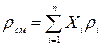
или по известным молекулярным массам:
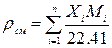
Для практических расчетов часто используется относительная плотность газа по воздуху 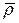
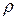
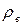
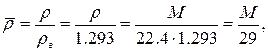
Плотность природных газов при различных давлениях и температурах определяют по формуле
Состав и свойства природных газов
1. Состав природных газов
Физико-химические и теплотехнические характеристики природных газов обусловлены различием в составе горючих компонентов и наличием в газе негорючих газообразных компонентов (балластов) и вредных примесей.
К горючим компонентам относят следующие вещества.
Метан СН4. Содержание метана в природных газах достигает 98 %, и его свойства практически полностью определяют свойства природных газов.
Вследствие содержания в метане 25 % водорода (по массе) имеется большое различие между высшей и низшей теплотой сгорания.
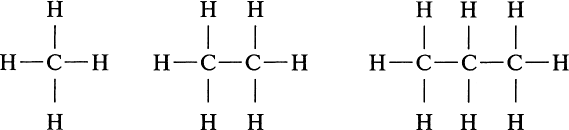
Метан обладает сравнительно низкой реакционной способностью, так как на разрыв четырех связей в молекуле метана требуются большие затраты энергии. Кроме метана в горючих газах могут содержаться этан С2Н6, пропан С3Н8, бутан C4H10. Углеводороды метанового ряда имеют общую формулу СnН2n+2, где n – углеродное число, равное 1 (для метана), 2 (для этана) и 3 (для пропана). Структура молекул этих углеводородов может быть представлена в следующем виде (рис. 1):
Рис. 1. Структура молекул углеводородов
С увеличением числа атомов в молекуле тяжелых углеводородов возрастают их плотность и теплота сгорания.
Водород Н2 – бесцветный нетоксичный газ без вкуса и запаха, масса 1 м 3 равна 0,09 кг. Он в 14,5 раза легче воздуха, отличается высокой реакционной способностью; водородно-воздушные смеси имеют широкие пределы воспламенения и весьма взрывоопасны.
Таблица 1. Физиологическое воздействие оксида углерода СО на организм человека
| Содержание СО в воздухе | Длительность и характер воздействия | |
| объем, % | мг/л | |
| 0,01 | 0,125 | В течение нескольких часов не оказывает воздействия |
| 0,05 | 0,625 | В течение 1 ч нет заметного воздействия |
| 0,1 | 1,25 | Через 1 ч наблюдаются головная боль, тошнота, недомогание |
| 0,5 | 6,25 | Через 20–30 мин оказывает смертельное воздействие |
В негорючую часть газообразного топлива входят азот и диоксид углерода.
Азот N2 – двухатомный бесцветный газ без запаха и вкуса, масса 1 м 3 азота равна 1,25 кг. Атомы азота соединены между собой в молекуле тройной связью, на разрыв этой связи расходуется 170200 ккал/моль. Азот практически не реагирует с кислородом, поэтому при расчетах процесса горения его рассматривают как инертный газ.
Диоксид углерода СО2 – бесцветный газ, тяжелый и слабореакционный при низких температурах, имеет слегка кисловатый запах и вкус. Концентрация СО2 в воздухе в пределах 4–5 % приводит к сильному раздражению органов дыхания; 10 %-ная концентрация СО2 в воздухе вызывает сильное отравление. Масса 1 м 3 СО2 составляет 1,98 кг. Диоксид углерода тяжелее воздуха в 1,53 раза, при температуре –20 °С и давлении 5,8 МПа превращается в жидкость, которую можно перевозить в стальных баллонах.
В горючих газах могут содержаться также сероводород и кислород.
Сероводород H2S – тяжелый газ с сильным и неприятным запахом, напоминающим запах тухлых яиц, обладает высокой токсичностью. Масса 1 м 3 сероводорода равна 1,54 кг; является газообразной кислотой и, воздействуя на металлы, образует сульфиды. Поэтому он сильно корродирует газопроводы, особенно при одновременном содержании в нем H2S, H2O и О2. При сжигании газа сероводород образует сернистый газ, вредный для здоровья. Содержание сероводорода не должно превышать 2 г на 100 м 3 газа.
Кислород О2 – газ без запаха, цвета и вкуса, масса 1 м 3 кислорода составляет 1,43 кг. Содержание кислорода в газе понижает его теплотворную способность и делает газ взрывоопасным. Поэтому содержание кислорода в газе не должно быть более 1 % по объему.
Все природные газы в большинстве своем не имеют запаха. Чтобы утечки газа были своевременно обнаружены, горючие газы одоризируют, то есть придают им специфический запах, по которому их легко обнаружить даже при незначительных концентрациях в воздухе помещений. Наиболее часто в качестве одоранта применяют этилмеркоптан.
2. Единицы измерения параметров газа
Измерение давления газа. Величину избыточного давления газа измеряют манометрами, а для получения абсолютного давления необходимо к избыточному давлению прибавить атмосферное давление.
Таблица 2. Соотношение между единицами давления газа
| Обозначение единиц | Па | дин/ cм 2 | кгс/м 2 | кгс/cм 2 (ат) | бар | мм вод. ст. | мм рт. ст. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 паскаль (Па) | 1 | 10 | 0,10 2 | 102·10 –6 | 10 –5 | 0,10 2 | 7,5·10 –3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 дин/cм 2 | 0,1 | 1 | 10,2·10 –3 | 1,02·10 –6 | 10 –6 | 10,2·10 –3 | 750·10 –6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 кгс/м 2 | 9,81 | 98,1 | 1 | 10 –4 | 98,1· 10 –6 | 1 | 73,56· 10 –3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 кгс/cм 2 (ат) | 98,1·10 3 | 98·10 3 | 10 4 | 1 | 0,981 | 10 4 | 735,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 бар | 10 5 | 10 6 | 10,2·10 3 | 1,02 | 1 | 10,2·10 3 | 750 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 мм вод. ст. | 9,81 | 98,1 | 1 | 10 –4 | 98,1· 10 –6 | 1 | 73,56· 10 –3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 мм рт. ст. | 133,3 | 1333 | 13,6 | 1,36·10 –3 | 1,333· Измерение температуры. При нагревании тела расширяются и увеличиваются в объеме. Больше всего расширяются газообразные тела, меньше – твердые. Например, газопровод длиной 100 м при нагревании до 100 °С увеличит свою длину только на 12 см; 100 л воды при нагревании до 100 °С увеличат свой объем на 4 л. При нагревании газа от 0 до 273 °С его объем увеличивается в два раза. Температуру газа измеряют жидкостными термометрами, шкала которых имеет две постоянные точки: таяния льда (0 °С) и кипения воды (100 °С). Наиболее точны и просты в обращении ртутные термометры. Применяют также и шкалу Кельвина, в которой точка 0 соответствует абсолютному нулю, то есть такой степени охлаждения тела, при которой прекращается всякое движение молекул любого вещества. Абсолютный нуль, принимаемый за начало отсчета температур в системе СИ, в технической системе равен 273,16 °С. Таким образом, показания абсолютной шкалы больше на 273,2 °С. Пример. Если продукты сгорания газа имеют температуру по Цельсию 200 °С, то по абсолютной шкале Кельвина та же температура равна 200 + 273,16 = 473,16 К. Измерение количества теплоты. В качестве основной единицы измерения количества теплоты ранее принималась калория (кал) – это количество теплоты, которое необходимо сообщить 1 г дистиллированной воды для повышения ее температуры с 19,5 до 20,5 °С при давлении 101,325 кПа. В теплотехнике применяется укрупненная единица измерения – килокалория (ккал), равная 1000 кал. Килокалория – это количество теплоты, которое необходимо сообщить 1 кг дистиллированной воды для повышения ее температуры на 1 °С. В системе единиц СИ теплота выражается универсальной единицей – джоулем (Дж). Джоуль – это работа, которую совершает сила в 1 Н на пути в 1 м. Можно применить и более крупную и удобную единицу (килоджоуль, кДж), равную 1000 Дж, 1 Дж = 0,239 кал. Количество теплоты, которое выделяется при полном сгорании 1 м 3 газа, называется удельной теплотой сгорания газового топлива. Теплоту сгорания газа измеряют в ккал/м 3 при температуре 20 °С и давлении 760 мм рт. ст. Различают низшую теплоту сгорания QН и высшую QB. Высшую и низшую теплоту сгорания природного газа подсчитывают по следующим формулам: где СН4, С2Н6, С3Н8, С4Н10 – содержание в природном газе метана, этана, пропана и бутана в процентах по объему. Цифровые значения обозначают низшие и высшие теплоты сгорания метана, этана и т. д., пересчитанные на 1 % горючего компонента. Перевод физических единиц количества теплоты в систему СИ приведен в табл. 3. Таблица 3. Перевод количества теплоты, выраженной в калориях, на джоули
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





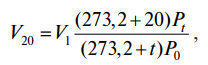 (2)
(2)