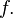укажите экстенсивный параметр термодинамической системы
Укажите экстенсивный параметр термодинамической системы
Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Общая схема разделения термодинамических параметров состояния на основые виды дана на рис. 2.4.
Предмет химической термодинамики. Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функции состояния. Внутренняя энергия. Теплота и работа.



Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Параметры состояния связаны уравнением состояния.
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др.
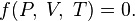 |
Таким образом, задать термическое уравнение состояния значит конкретизировать вид функции
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Функция состояния — это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния.
Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы. Функции состояния: внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G).
Внутренняя энергия — сумма всех видов энергий движения и взаимодействия частиц, составляющих систему.
Теплота — форма передачи энергии путем хаотического движения
микрочастиц.
Работа — форма передачи энергии путём направленного движения
макросистемы как целого.
Параметры состояния системы



I. Основные понятия термодинамики
Тема : Термодинамика химического равновесия.
Цель лекции : изучение вопросов по термодинамике химического равновесия
План:
Содержание лекции:
Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией.
Примером открытой системы является живая клетка.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Например, для оценки состояния человеческого организма, как термодинамической системы, врач должен оценить некоторые его свойства (температура, давление, концентрация биологических жидкостей).
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы.
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Параметры состояния связаны уравнением состояния.
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Внутренняя энергия является одной из таких функций.
В XIX веке немецкий судовой врач Майер Ю.Р. и английский ученый Джоуль Д. показали, что теплота и работа способны к взаимопревращениям, являясь разными способами передачи энергии.
Наблюдая за людьми в разных климатических зонах, Майер сделал вывод, что теплота сгорания пищи используется на поддержание постоянной температуры тела и на выполнение мускульной работы. Это наблюдение легло в основу 1 закона термодинамики.
ЭКСТЕНСИВНЫЕ ПАРАМЕТРЫ
Полезное
Смотреть что такое «ЭКСТЕНСИВНЫЕ ПАРАМЕТРЫ» в других словарях:
экстенсивные параметры — экстенсивные термодинамические параметры; экстенсивные параметры Термодинамические параметры, пропорциональные массе данной термодинамической системы, значение которых равно сумме значений таких же параметров отдельных частей системы … Политехнический терминологический толковый словарь
ЭКСТЕНСИВНЫЕ ПАРАМЕТРЫ — см. Параметры состояния … Химическая энциклопедия
экстенсивные термодинамические параметры — экстенсивные термодинамические параметры; экстенсивные параметры Термодинамические параметры, пропорциональные массе данной термодинамической системы, значение которых равно сумме значений таких же параметров отдельных частей системы … Политехнический терминологический толковый словарь
ПАРАМЕТРЫ СОСТОЯНИЯ — (термодинамические параметры), физ. величины, характеризующие состояние термодинамич. системы: темп pa, давление, уд. объём, намагниченность, электрич. поляризация и др. Различают э к с т е н с и в н ы е П. с., пропорц. массе системы, и и н т е н … Физическая энциклопедия
Параметры — [гр. parametron отмеривающий] – величина, характеризующая какое либо свойство вещества, процесса, устройства и т. п.: состояния термодинамические физические величины, характеризующие состояние системы, температура, давление, удельный объем … Энциклопедия терминов, определений и пояснений строительных материалов
ПАРАМЕТРЫ СОСТОЯНИЯ — (от греч. parametron отмеривающий, соразмеряющий) (термодинамич. параметры, термодинамич. переменные), физ. величины, характеризующие состояние термодинамич. системы в условиях термодинамического равновесия. Различают экстенсивные П. с.… … Химическая энциклопедия
Параметры состояния — термодинамические параметры, физические величины, характеризующие состояние термодинамической системы (например, температура, давление, удельный объём, намагниченность, электрическая поляризация и др.). Различают экстенсивные П. с.,… … Большая советская энциклопедия
ТОНКИЕ ЖИДКИЕ ПЛЁНКИ — (ТЖП) плёнки жидкой фазы a, граничащие с одинаковыми b (симметричные ТЖП) или разными b и b (несимметричные ТЖП) текучими (жидкими или газообразными) фазами и имеющие столь малую толщину, что взаимодействие их межфазных границ становится… … Физическая энциклопедия
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ — ф ции параметров состояния макроскопич. системы (т ры Т, давления р, объема V, энтропии S, чисел молей компонентов хим. потенциалов компонентов m, и др.), применяемые гл. обр. для описания термодинамического равновесия. Каждому Т. п.… … Химическая энциклопедия
Фазовый переход — Фазовые переходы Статья является частью серии «Термодинамика». Понятие фазы Равновесие фаз … Википедия
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Функция состояния термодинамической системы: энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
В ходе самопроизвольного процесса в закрытых системахG уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0).
В изолированных системахэнтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0
Энтальпийный и энтропийный фактор действуют независимо друг от друга и могут направлять процесс в противоположные стороны.
эннтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG 0).
Диффузия
диффузией является перемешивание молекул вещества при их беспорядочном тепловом движении.
процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму
примеры: 1)растворение молока в кофе;
2)заваривание чая;
3)распространение запахов;
Осмос. Эндо- экзоосмос
Осмос — результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полу24проницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества.
Односторонняя диффузия растворителя через полупроницаемую мембрану, отделяющую раствор от чистого растворителя.
наблюдаются, когда жидкости приходят во взаимодействие через перепонки.
ЭНДООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из внешней среды внутрь клетки
ЭКЗООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из клетки в окружающую внешнюю среду
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом.
22. Осмотичекое давление (закон Вант-Гоффа)
Осмотическое давление равно тому давлению, которое имело бы растворенное вещество, будучи в газообразном состоянии в объеме раствора
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.