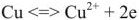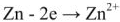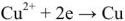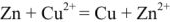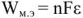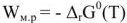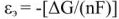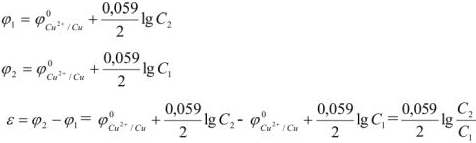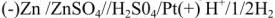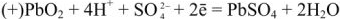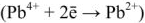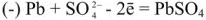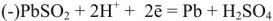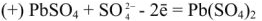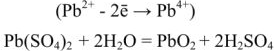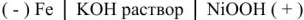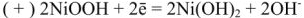Что в гальваническом элементе служит положительным электродом что отрицательным
Тест по физике Электрический ток 8 класс
Тест по физике Электрический ток. Источники электрического тока для учащихся 8 класса с ответами. Тест состоит из 10 заданий и предназначен для проверки знаний к главе Электрические явления.
1. Электрическим током называют
1) движение заряженных частиц
2) направленное движение частиц
3) направленное движение заряженных частиц
4) направленное движение электронов
2. Чтобы в проводнике возник электрический ток, необходимо
1) действие на электроны сил, вызывающих их движение
2) создание в проводнике электрического поля
3) наэлектризовать проводник
3. Каково назначение источника тока?
1) Поддерживать существование в проводнике электрического поля
2) Создавать электрические заряды в проводнике
3) Освобождать электроны в проводнике от связи с атомами
4. Какой процесс происходит во всех источниках тока?
1) Разделение положительно и отрицательно заряженных частиц
2) Создание потоков заряженных частиц
3) Скопление электронов или ионов
5. Полюсы источника тока — это место, где
1) разделяются электрические заряды
2) накапливаются электрические заряды разного знака
3) электрические заряды взаимодействуют
6. Сколько полюсов и какие имеет источник тока?
1) 2; положительный и отрицательный
2) 3; положительный, отрицательный и нейтральный
3) 2; отрицательный и нейтральный
4) 2; положительный и нейтральный
7. Какая энергия необходима для разделения в источнике тока электрических зарядов?
1) Механическая
2) Внутренняя
3) Химическая
4) Любая из перечисленных или другой вид энергии
8. За счет какой энергии происходит разделение заряженных частиц в гальваническом элементе?
1) Механической
2) Внутренней
3) Энергии химических реакций
4) Энергии света
9. Что в гальваническом элементе служит положительным электродом, что — отрицательным?
1) Положительным — угольный стержень, отрицательным — слой смолы
2) Положительным — угольный стержень, отрицательным — цинковый сосуд
3) Положительным — слой смолы, отрицательным — цинковый сосуд
4) Положительным — угольный стержень, отрицательным — клейстер
10. Аккумулятор дает электрический ток только после того, как
1) его согрели в теплом помещении
2) наэлектризовали его электроды
3) его зарядили от другого источника тока
Ответы на тест по физике Электрический ток. Источники электрического тока
1-3
2-2
3-1
4-1
5-2
6-1
7-4
8-3
9-2
10-3
Гальванический электрод 2.0: полный обзор
Гальванический электрод — это электрод, который погружен в электролит или соприкасается с ним. Используется в процессе электролиза.
Гальванический электрод: назначение
Повторимся, что данный электрод используется в электролизе (в процессе, в результате которого от гальванических элементов при прохождение электрического тока отделяется часть растворенных веществ), а также в гальванических источниках тока и т.д.
На границе гальванического электрода с электролитом происходят электрохимические процессы, которые могут быть восстановительными или окислительными. Участвовать в таких процессах могут материалы электрода и соответствующие ионы электролита (так называемые растворимые гальванические электроды, например, Cu 2+ + 2е ⇆ Cu).
Различают разрушаемые (в результате наводороживания, коррозии, растрескивания и т. п.) и неразрушаемые.
Полярность (+ Анод или — Катод) находится в прямой зависимости от характера происходящих на электроде процессов или подключения к тому или иному полюсу внешнего источника напряжения.
Также применяются биполярные гальванические элементы. У них одна из сторон выступает в роли катода, а другая — анода. Это происходит в результате последовательного включения нескольких гальванических электродов в электрическую цепь.
При изготовлении электродов могут использоваться дисперсные материалы (псевдоожиженный гальванический электрод, иногда с магнитным удержателем у токоподвода).
Важнейшей характеристикой является электродный потенциал (разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом). Электродный потенциал устанавливается на границе электрод-электролит.
По применению выделяют гальванический электрод сравнения, индикаторный и др.
Подробнее об электролизе
Как уже говорилось, электролиз — физико-химический процесс, который состоит в выделении на электродах составных частей растворённых веществ или других веществ. Они являются результатом вторичных реакций на электродах. Вторичные реакции возникают при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих ток жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, которые соединены с полюсами источника электрической энергии.
Катодом при электролизе принято называть отрицательный гальванический электрод, анодом — положительный.
Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, которые происходят при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите.
Разделение реакций на первичные и вторичные помогло Майклу Фарадею (английскому физику-экспериментатору и химику) установить законы электролиза.
Род элементов
Обратимые
Ионоселективные мембранные
Таблица: стандартные потенциалы электродов (25 o С)
Гальванический электрод и его потенциал. ЭДС реакции
Окислительно — восстановительный потенциал представляет собой частный, узкий случай понятия электродного потенциала. Разберем детальнее.
В окислительно-восстановительной реакции передача электронов восстановителями окислителям проходит при непосредственном контакте частиц. Энергия химической реакции переходит в тепловую.
Энергию любой ОВР, которая протекает в растворе электролита, возможно превратить в электрическую.
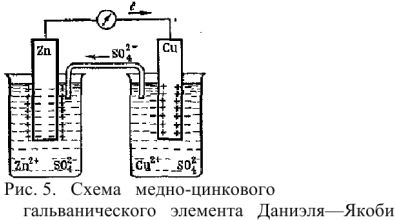
Гальванический электрод Даниэля-Якоби, в котором левый сосуд заполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной способствует тому, что гальванический электрод приобретает электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, которые содержатся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Как рассчитать потенциал электрода?
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, которые можно измерить относительно нормального водородного электрода (его потенциал принят равным нулю).
Для определения стандартных электродных потенциалов применяют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный гальванический.
По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Гальванический элемент в химии
Гальванический элемент (гэ). Напряжение гальванического элемента
Гальванический элемент — это, прибор, который преобразует химическую энергию окислительно-восстановительной реакции в электрическую энергию.
Схема простейшего ГЭ Даниэля-Якоби представлена на рис. 5.
Гальванический элемент состоит из двух электродов, каждый из которых опущен в сосуд с соответствующим раствором соли: цинковый электрод погружен в раствор соли 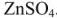
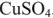
Сосуды соединены электролитическим мостиком, заполненным концентрированным раствором электролита (например, 

На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходит от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместиться вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместиться влево и произойдет разряд ионов меди.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1) реакция окисления цинка
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди
Процессы восстановления в электрохимии получили название электродных процессов, а электроды, на которых идут процессы восстановления, назвают катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: через электролитический мостик анионов 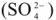
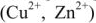
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода — двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
для упрощения в таких схемах обычно опускается внешняя цепь. Как видно, в гальваническом элементе идет химическая реакция, а во внешней цепи элемента протекает электрический ток, т.е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Электродвижущая сила. Напряжение элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силон (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
= 
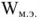
где 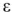
В то же время максимальная полезная работа 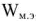
Так как 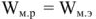
Согласно уравнения Нернста один и тот же электрод при различных концентрациях ионов имеет различное значение потенциала, поэтому возможны так называемые концентрационные ГЭ. Рассмотрим, например, ГЭ, составленный из двух медных электродов, опущенных в электролиты с разными концентрациями ионов 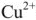
Положим, что 
Работа в концентрационном ГЭ совершается не за счет реакции окисления восстановления, а за счет выравнивания концентрации растворов. Если концентрация электролитов отличаются в 10 раз, то напряжение (э.д.с.) ГЭ равна 0,0295 в, а если в 100 раз, то — 0,059 в.
Применяются для определения одной из концентраций 
Концентрационная и химическая поляризация электронов.
На медном катоде в замкнутом элементе происходит восстановление ионов меди. При этом концентрация их при электродном слое снижается и тем сильнее, чем больше сила тока. Это затрудняет протекание реакции восстановления, и скорость катодной реакции определяется скоростью диффузии ионов к электроду. Уменьшение концентрации катионов меди по формуле Нернста приводит к уменьшению величины потенциала меди. Цинковый анод растворяется и тем с большей скоростью, чем больше сила тока. Это приводит к накоплению ионов цинка в приэлектродном слое, в результате чего его потенциал смещается по указанной причине в положительную сторону. Электроды в этом случае поляризуются благодаря изменению концентрации ионов у их поверхности. Такая поляризация носит название концентрационный или диффузионный.
В ряде случаев кроме поляризации, при протекании тока имеет место и так называемая химическая поляризация. Для иллюстрации этого явления составим следующую цепь:
В данном случае на платине восстанавливаются не ее ионы, поскольку их нет в растворе, а ионы водорода до атомного водорода, который адсорбируется на платине и частично растворяется в ней, а также превращается в молекулярный водород. Платиновый электрод, таким образом, превратится в водородный, т.е. изменится химическая природа электрода. При этом его потенциал сместится в отрицательную сторону. Иными словами, произойдет химическая поляризация катода, которая, как и концентрационная, приводит к уменьшению напряжения гальванического элемента.
Классификация гальванических элементов
Гальванический элемент состоит из двух электродов: катода (+) и анода (-) и из одного или дух электролитов, разделенных между собой пористой перегородкой, ограничивающей их смешивание. Известны типы гальванических элементов: химические, концентрационные,
окислительно-восстановительные. В гальваническую пару можно сочетать также электроды, принадлежащие к различным видам. При таком сочетании электродов не представляется возможным классифицировать элементы, исходя из природы электродов. Классификация окажется очень громоздкой. Поэтому элементы подразделяют по другим признакам: по особенностям работы, назначению и конструкциям.
Гальванические элементы делят на первичные химические источники тока и вторичные. К первичным относятся вес ранее рассмотренные элементы. Их можно использовать только один раз. После разряда они становятся непригодными к дальнейшей работе.
К вторичным относят аккумуляторы (накопители электричества). Аккумулятор после разряда можно снова зарядить, г.е. превратить продукты реакции путем электролиза в исходные вещества. При этом электрическая энергия превращается в химическую.
Первичные источники тока в свою очередь делят на элементы с жидким электролитом (наливные) и «сухие» (непроливающиеся) элементы с загущенным электролитом. Сухие элементы можно подразделить по признаку катодных деполяризаторов на элементы с твердыми окислителями, воздушной системы и смешанной марганцово-воздушной системы.
Аккумуляторы. Аккумуляторы — обратимые гальванические элементы.
Вещества, из которых изготовляют электроды, и электролиты подобраны в аккумуляторах с таким расчетом, чтобы обратимость химических процессов при электролизе (зарядке) достигалась с минимальной потерей энергии на побочные реакции и в виде теплоты.
Понятно, что медно-цинковый элемент с двумя разделенными пористой перегородкой растворами не пригоден в качестве аккумулятора. Так как происходящие в нем диффузионные процессы необратимы. При этом восстановление ионов цинка до металлического при зарядке будет сопровождаться побочной реакцией восстановления водорода.
Из огромного количества исследованных гальванических элементов удовлетворяют указанным требованиям свинцовый аккумулятор Плантэ, железо-никелевый (кадмиево-никелевый) аккумулятор Эдиссона и серебряно-цинковый аккумулятор Андре.
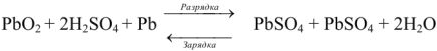
Свинцовый аккумулятор (рис. 6) был изобретен в результате работ Якоби, Плате и братьев Тюдор. В незаряженном виде он состоит из свинцовых пластин, отлитых в виде решеток. Отверстия отрицательных решеток заполнены пастой из свинцового глета РЬО и воды, а положительных — суриком 

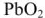
Перед использованием в аккумулятор наливают 30%-ый раствор серной кислоты.
При этом образуется гальваническая цепь:
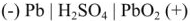
При разрядке аккумулятора на электродах протекают следующие реакции: на катоде
на аноде
Вещества катода и анода превращаются в сернокислый свинец, а химическая энергия — в электрическую.
При зарядке аккумулятора на электродах протекают следующие реакции:
на катоде
на аноде
Суммируя процессы зарядки и разрядки, получим:
После того как на катоде закончится восстановление катионов свинца до металлического свинца, а на аноде — окисление 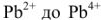
Емкость свинцового аккумулятора около 35вт/ч (20000 кулонов) на 1 кг веса. Последняя возрастает с повышением концентрации кислоты до некоторого предела; максимум емкости соответствует концентрации кислоты около 30% (плотность 1,224).
Свинцовый аккумулятор отдает около 80% подведенной к нему электроэнергии и дает примерно 4 а/ч на 1 дм2 поверхности пластин. Аккумулятор считают практически разряженным, если его напряжение на зажимах упало на 10% (от 2 в).
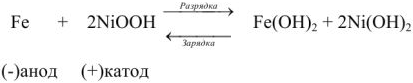
В щелочном аккумуляторе Эдиссона электродами служат порошкообразное железо и (гидрат окиси никеля, который частично дегидратируется до 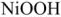
К электролиту часто добавляют гидрат окиси лития 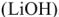
Электроды щелочных аккумуляторов изготавливают в виде пакетов из стальной стали с большим числом отверстий для прохода электролита к действующей массе, закладываемой в пакеты. При сборке пластины изолируют одну от другой эбонитовыми стержнями.
При разрядке на электродах протекают следующие процессы:
на катоде
на аноде
Напряжение щелочного аккумулятора равна 1,33 — 1,40 в.
При зарядке на катоде железо из гидрата закиси восстанавливается до металлического; на аноде 
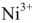
Суммарно процесс зарядки и разрядки можно изобразить следующим уравнением:
Максимальное напряжение при зарядке щелочного аккумулятора равно 1,8 в, конечное напряжение при разрядке 1 — 1,1 в. К.п.д. у щелочных аккумуляторов меньше, чем у свинцовых. Преимуществом щелочных аккумуляторов является их малый вес, простота ухода за ними, а также то обстоятельство, что случайные короткие замыкания не приносят такого вреда, как свинцовым аккумуляторам. При большой скорости образования сернокислого свинца он полу рыхлым, в результате чего электроды аккумулятора разрушаются.
Срок службы щелочных аккумуляторов в зависимости от электролита составляет 250-750 циклов.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института